Липопротеин

ApoA , ApoB , ApoC , ApoE — аполипопротеины ; зеленые частицы — фосфолипиды ; Т представляет собой триглицерид ; С – эфир холестерина .
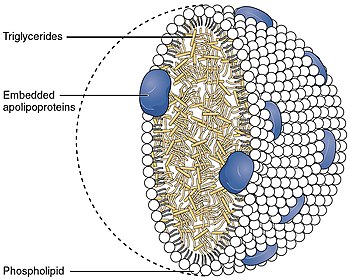
Липопротеин комплекс , — это биохимический основной функцией которого является транспортировка молекул гидрофобных липидов (также известных как жир ) в воде, например, в плазме крови или других внеклеточных жидкостях . Они состоят из триглицеридного и холестеринового центра, окруженного внешней оболочкой из фосфолипидов , причем гидрофильные части ориентированы наружу, к окружающей воде, а липофильные части ориентированы внутрь, к липидному центру. Особый вид белка, называемый аполипопротеином , встроен во внешнюю оболочку, одновременно стабилизируя комплекс и придавая ему функциональную идентичность, определяющую его роль.
Частицы липопротеинов плазмы обычно делят на пять основных классов в зависимости от размера, липидного состава и содержания аполипопротеинов: ЛПВП , ЛПНП , ЛПНП , ЛПОНП и хиломикроны . Подгруппы этих частиц плазмы являются основными движущими силами или модуляторами атеросклероза . [1]
Многие ферменты , транспортеры , структурные белки, антигены , адгезины и токсины иногда также относят к липопротеинам, поскольку они образованы липидами и белками.
Объем
[ редактировать ]Трансмембранные липопротеины
[ редактировать ]Некоторые трансмембранные протеолипиды , особенно те, которые обнаружены в бактериях , называются липопротеинами; они не связаны с частицами липопротеинов, о которых идет речь в этой статье. [2] Такие трансмембранные белки трудно изолировать, поскольку они прочно связываются с липидной мембраной, часто требуют липидов для отображения правильной структуры и могут быть нерастворимыми в воде. Детергенты обычно необходимы для изоляции трансмембранных липопротеинов от связанных с ними биологических мембран.
Частицы липопротеинов плазмы
[ редактировать ]Эта статья нуждается в дополнительных цитатах для проверки . ( октябрь 2021 г. ) |
Поскольку жиры нерастворимы в воде, они не могут самостоятельно транспортироваться во внеклеточной воде, включая плазму крови. Вместо этого они окружены гидрофильной внешней оболочкой, которая выполняет функцию транспортного средства. Роль частиц липопротеинов заключается в транспортировке молекул жира, таких как триглицериды , фосфолипиды и холестерин, из внеклеточной воды организма ко всем клеткам и тканям организма. Белки, входящие во внешнюю оболочку этих частиц, называемые аполипопротеинами, синтезируются и секретируются во внеклеточную воду как клетками тонкого кишечника , так и клетками печени . Внешняя оболочка также содержит фосфолипиды и холестерин.
Все клетки используют и полагаются на жиры и холестерин в качестве строительных блоков для создания многочисленных мембран , которые клетки используют как для контроля внутреннего содержания воды и внутренних водорастворимых элементов, так и для организации своей внутренней структуры и белковых ферментативных систем. Наружная оболочка липопротеиновых частиц имеет направленные наружу гидрофильные группы фосфолипидов, холестерина и аполипопротеинов. Такие характеристики делают их растворимыми в пуле крови на основе соленой воды. Триглицериды и эфиры холестерина переносятся внутри, защищенные от воды внешней оболочкой. Вид аполипопротеинов, содержащихся во внешней оболочке, определяет функциональную идентичность липопротеиновых частиц. Взаимодействие этих аполипопротеинов с ферментами в крови, друг с другом или со специфическими белками на поверхности клеток определяет, будут ли триглицериды и холестерин добавлены к липопротеиновым транспортным частицам или удалены из них.
Характеристика в плазме человека [3]
| Хиломикроны | ЛПОНП | ЛПНП | ЛПВП | |
|---|---|---|---|---|
| Электрофоретическая подвижность | Источник | Предварительная бета | Бета | Альфа |
| Плотность | менее 0,96 | 0.96-1.006 | 1.006-1.063 | 1.063-1.21 |
| Диаметр (нм) | 100-1000 | 30-90 | 20-25 | 10-20 |
| Аполипопротеины | B 48 , Ал, Все | Б 100 ИН, CII | Б 100 | ИИ, АИИ, КИ |
| Состав (% от общего содержания) | ||||
| · Белок | 2 | 10 | 20 | 40 |
| · Липид | 98 | 90 | 80 | 60 |
| Липидный компонент (% от общего содержания липидов) | ||||
| · Триглицериды | 88 | 55 | 12 | 12 |
| · Эфиры холестерина | 4 | 24 | 59 | 40 |
| · Фосфолипиды | 8 | 20 | 28 | 47 |
| · Свободные жирные кислоты | - | 1 | 1 | 1 |
Структура
[ редактировать ]Липопротеины представляют собой сложные частицы, имеющие центральное гидрофобное ядро из неполярных липидов, в первую очередь эфиров холестерина и триглицеридов. Это гидрофобное ядро окружено гидрофильной мембраной, состоящей из фосфолипидов, свободного холестерина и аполипопротеинов. Плазменные липопротеины, обнаруженные в плазме крови , обычно делятся на пять основных классов в зависимости от размера, липидного состава и содержания аполипопротеинов: ЛПВП , ЛПНП , ЛПНП , ЛПОНП и хиломикроны . [4]
Функции
[ редактировать ]Метаболизм
[ редактировать ]Обращение с частицами липопротеинов в организме называется метаболизмом частиц липопротеинов . Он делится на два пути: экзогенный и эндогенный , в зависимости от того, состоят ли рассматриваемые липопротеиновые частицы главным образом из пищевых (экзогенных) липидов или же они возникают в печени (эндогенные) в результате de novo синтеза триглицеридов .
Гепатоциты ; являются основной платформой для обработки триглицеридов и холестерина печень также может хранить определенное количество гликогена и триглицеридов. Хотя адипоциты являются основными клетками-хранилищами триглицеридов, они не производят липопротеинов.
Экзогенный путь
[ редактировать ]
Желчь эмульгирует жиры, содержащиеся в химусе , затем липаза поджелудочной железы расщепляет молекулы триглицеридов на две жирные кислоты и одну 2-моноацилглицерин. Энтероциты легко поглощают небольшие молекулы из химуса. Внутри энтероцитов жирные кислоты и моноацилглицериды снова превращаются в триглицериды. Затем эти липиды собираются с аполипопротеином В-48 в образующиеся хиломикроны . Эти частицы затем секретируются в млечные клетки в процессе, который в значительной степени зависит от аполипопротеина B-48. Циркулируя по лимфатическим сосудам , образующиеся хиломикроны минуют циркуляцию печени и попадают через грудной проток в кровоток.
В кровотоке возникающие частицы хиломикронов взаимодействуют с частицами ЛПВП, что приводит к донорству ЛПВП аполипопротеина C-II и аполипопротеина E возникающему хиломикрону. Хиломикрон на этой стадии считается зрелым. Посредством аполипопротеина C-II зрелые хиломикроны активируют липопротеинлипазу (ЛПЛ), фермент эндотелиальных клеток, выстилающих кровеносные сосуды. ЛПЛ катализирует гидролиз триглицеридов, который в конечном итоге высвобождает глицерин и жирные кислоты из хиломикронов. Глицерин и жирные кислоты затем могут всасываться в периферических тканях, особенно в жировой и мышечной , для получения энергии и хранения.
Гидролизованные хиломикроны теперь называются остатками хиломикронов . Остатки хиломикронов продолжают циркулировать в кровотоке до тех пор, пока не вступят во взаимодействие через аполипопротеин Е с рецепторами остатков хиломикронов, обнаруженными главным образом в печени. Это взаимодействие вызывает эндоцитоз остатков хиломикронов, которые впоследствии гидролизуются в лизосомах . Лизосомальный гидролиз высвобождает в клетку глицерин и жирные кислоты, которые можно использовать для получения энергии или хранить для дальнейшего использования.
Эндогенный путь
[ редактировать ]Печень является центральной платформой для обработки липидов: она способна хранить глицерины и жиры в своих клетках, гепатоцитах . Гепатоциты также способны создавать триглицериды посредством синтеза de novo. Они также производят желчь из холестерина. Кишечник отвечает за поглощение холестерина. Они переносят его в кровоток.
В гепатоцитах триглицериды и эфиры холестерина собираются с аполипопротеином B-100 с образованием зарождающихся частиц ЛПОНП . Возникающие частицы ЛПОНП высвобождаются в кровоток посредством процесса, который зависит от аполипопротеина B-100.
В кровотоке возникающие частицы ЛПОНП сталкиваются с частицами ЛПВП; в результате частицы ЛПВП отдают аполипопротеин C-II и аполипопротеин E возникающим частицам ЛПОНП. После загрузки аполипопротеинами C-II и E зарождающаяся частица ЛПОНП считается зрелой. Частицы ЛПОНП циркулируют и сталкиваются с ЛПЛ, экспрессируемым на эндотелиальных клетках . Аполипопротеин C-II активирует ЛПЛ, вызывая гидролиз частиц ЛПОНП и высвобождение глицерина и жирных кислот. Эти продукты могут всасываться из крови периферическими тканями, главным образом жировыми и мышечными. Гидролизованные частицы ЛПОНП теперь называются остатками ЛПОНП или липопротеинами промежуточной плотности (ЛПНП). Остатки ЛПОНП могут циркулировать и посредством взаимодействия между аполипопротеином Е и остаточным рецептором абсорбироваться печенью или могут дополнительно гидролизоваться печеночной липазой .
Гидролиз печеночной липазы высвобождает глицерин и жирные кислоты, оставляя после себя остатки ЛНП , называемые липопротеинами низкой плотности (ЛПНП), которые содержат относительно высокое содержание холестерина. [5] ( см. структуру нативного ЛПНП при 37°C на YouTube ). ЛПНП циркулируют и поглощаются печенью и периферическими клетками. Связывание ЛПНП с тканью-мишенью происходит посредством взаимодействия между рецептором ЛПНП и аполипопротеином В-100 на частице ЛПНП. Абсорбция происходит посредством эндоцитоза , а интернализованные частицы ЛПНП гидролизуются в лизосомах, высвобождая липиды, главным образом холестерин.
Возможная роль в транспорте кислорода
[ редактировать ]Липопротеины плазмы могут переносить газообразный кислород. [6] Это свойство обусловлено кристаллической гидрофобной структурой липидов, обеспечивающей подходящую среду для растворимости O 2 по сравнению с водной средой. [7]
Роль в воспалении
[ редактировать ]Воспаление , реакция биологической системы на такие стимулы, как внедрение патогена , играет основную роль в многочисленных системных биологических функциях и патологиях. Это полезная реакция иммунной системы, когда организм подвергается воздействию патогенов, таких как бактерии, в местах, которые могут оказаться вредными, но также могут иметь пагубные последствия, если их не регулировать. Было продемонстрировано, что липопротеины, особенно ЛПВП, играют важную роль в воспалительном процессе. [8]
Было показано, что когда организм функционирует в нормальных, стабильных физиологических условиях, ЛПВП полезны по нескольким причинам. [8] ЛПНП содержат аполипопротеин В (апоВ), который позволяет ЛПНП связываться с различными тканями, такими как стенка артерии, если гликокаликс поврежден высоким уровнем сахара в крови . [8] В случае окисления ЛПНП могут попасть в ловушку протеогликанов, предотвращая их удаление путем оттока холестерина ЛПВП. [8] Нормально функционирующие ЛПВП способны предотвратить процесс окисления ЛПНП и последующие воспалительные процессы, наблюдаемые после окисления. [8]
Липополисахарид , или ЛПС, является основным патогенным фактором клеточной стенки грамотрицательных бактерий . Грамположительные бактерии имеют аналогичный компонент, называемый липотейхоевой кислотой или LTA. ЛПВП обладают способностью связывать ЛПС и ЛТА, создавая комплексы ЛПВП-ЛПС для нейтрализации вредного воздействия на организм и выведения ЛПС из организма. [9] ЛПВП также играют важную роль во взаимодействии с клетками иммунной системы, модулируя доступность холестерина и модулируя иммунный ответ. [9]
При определенных аномальных физиологических состояниях, таких как системная инфекция или сепсис , основные компоненты ЛПВП изменяются. [9] [10] Состав и количество липидов и аполипопротеинов изменяются по сравнению с нормальными физиологическими состояниями, например, снижается уровень холестерина ЛПВП (ХС-ЛПВП), фосфолипидов, апоА-I (основной липопротеин в ЛПВП, который, как было показано, обладает полезными анти- воспалительные свойства) и увеличение сывороточного амилоида А. [9] [10] Этот измененный состав ЛПВП обычно называют острой фазой ЛПВП при острой фазе воспалительной реакции, в течение которой ЛПВП могут потерять способность ингибировать окисление ЛПНП. [8] Фактически, этот измененный состав ЛПВП связан с повышенной смертностью и худшими клиническими исходами у пациентов с сепсисом. [9]
Классификация
[ редактировать ]По плотности
[ редактировать ]Липопротеины можно разделить на пять основных групп, расположенных от большей и меньшей плотности к меньшей и более высокой плотности. Липопротеины становятся крупнее и менее плотными, когда соотношение жира и белка увеличивается. Они классифицируются на основе электрофореза , ультрацентрифугирования и спектроскопии ядерного магнитного резонанса с помощью анализатора Vantera . [11]
- Хиломикроны переносят триглицериды (жиры) из кишечника в печень, скелетные мышцы и жировую ткань.
- Липопротеины очень низкой плотности (ЛПОНП) переносят (вновь синтезированные) триглицериды из печени в жировую ткань.
- Липопротеины промежуточной плотности (ЛПНП) занимают промежуточное положение между ЛПОНП и ЛПНП. Они обычно не обнаруживаются в крови при голодании .
- Липопротеины низкой плотности (ЛПНП) переносят по всему телу от 3000 до 6000 молекул жира (фосфолипиды, холестерин, триглицериды и т. д.). Частицы ЛПНП иногда называют «плохими» липопротеинами, поскольку концентрации двух видов ЛПНП (сд-ЛПНП и ЛПА) коррелируют с прогрессированием атеросклероза. У здоровых людей большая часть ЛПНП большая и плавучая (фунт ЛПНП).
- крупные плавучие частицы ЛПНП (фунт ЛПНП)
- мелкие плотные частицы ЛПНП (сд ЛПНП)
- Липопротеин(а) (ЛПА) — липопротеиновая частица определенного фенотипа.
- Липопротеины высокой плотности (ЛПВП) собирают молекулы жира из клеток/тканей организма и возвращают их в печень. ЛПВП иногда называют «хорошими» липопротеинами, поскольку более высокие концентрации коррелируют с низкой скоростью прогрессирования и/или регрессии атеросклероза.
Для молодых здоровых испытуемых весом ~70 кг (154 фунта) эти данные представляют собой средние значения для обследованных лиц, проценты представляют собой % сухого веса:
| Плотность (г/м л ) | Сорт | Диаметр (нм) | % белка | % холестерина и эфиров холестерина | % фосфолипида | % триглицеридов |
| >1,063 | ЛПВП | 5–15 | 33 | 30 | 29 | 4-8 |
| 1.019–1.063 | ЛПНП | 18–28 | 25 | 46-50 | 21-22 | 8-10 |
| 1.006–1.019 | МВУ | 25–50 | 18 | 29 | 22 | 31 |
| 0.95–1.006 | ЛПОНП | 30–80 | 10 | 22 | 18 | 50 |
| <0,95 | Хиломикроны | 75-1200 | 1-2 | 8 | 7 | 83-84 |
[12] [13] Однако эти данные не обязательно надежны для какого-либо отдельного человека или для общей клинической популяции.
Альфа и бета
[ редактировать ]Также можно классифицировать липопротеины как «альфа» и «бета» в соответствии с классификацией белков при электрофорезе белков сыворотки . Эта терминология иногда используется при описании липидных нарушений, таких как абеталипопротеинемия .
Подразделения
[ редактировать ]Липопротеины, такие как ЛПНП и ЛПВП, можно разделить на подвиды, выделенные с помощью различных методов. [14] [15] Они подразделяются по плотности или содержанию белков/белков, которые они несут. [14] Хотя исследования в настоящее время продолжаются, исследователи узнают, что разные подвиды содержат разное содержание аполипопротеинов, белков и липидов между видами, которые имеют разные физиологические роли. [14] Например, в подвидах липопротеинов ЛПВП большое количество белков участвует в общем липидном обмене. [14] Однако выясняется, что подвиды ЛПВП также содержат белки, участвующие в следующих функциях: гомеостаз , фибриноген , каскад свертывания крови , воспалительные и иммунные реакции, включая систему комплемента , ингибиторы протеолиза , белки острофазового ответа и белок, связывающий ЛПС. , метаболизм гема и железа, регуляция тромбоцитов , связывание витаминов и общий транспорт. [14]
Исследовать
[ редактировать ]Высокие уровни липопротеина(а) являются значительным фактором риска атеросклеротических через механизмы , сердечно-сосудистых заболеваний связанные с воспалением и тромбозом . [16] Связи механизмов между различными изоформами липопротеинов и риском сердечно-сосудистых заболеваний, синтезом, регуляцией и метаболизмом липопротеинов, а также связанные с ними риски генетических заболеваний находятся в стадии активных исследований по состоянию на 2022 год. [16]
См. также
[ редактировать ]- Липидно-заякоренный белок
- Остаточный холестерин
- Обратный транспорт холестерина
- Вертикальный автоматический профиль
Ссылки
[ редактировать ]- ^ Гофман Дж.В., Джонс Х.Б., Линдгрен Ф.Т., Лайон Т.П., Эллиот Х.А., Стризовер Б. (август 1950 г.). «Липиды крови и атеросклероз человека» . Тираж . 2 (2): 161–78. дои : 10.1161/01.CIR.2.2.161 . ПМИД 15427204 .
- ^ «Микробные протеолипиды и липопептиды – гликопептидолипиды, сурфактин, итурнины, полимиксины, даптомицин» . ЛипидВеб . Проверено 21 июля 2019 г.
- ^ Сатьянараяна, У. (2002). Биохимия (2-е изд.). Калькутта, Индия: Книги и сопутствующие товары. ISBN 8187134801 . OCLC 71209231 .
- ^ Фейнгольд, Кеннет Р.; Грюнфельд, Карл (2000), Файнгольд, Кеннет Р.; Анавальт, Брэдли; Бойс, Элисон; Хрусос, Джордж (ред.), «Введение в липиды и липопротеины» , Endotext , Южный Дартмут (Массачусетс): MDText.com, Inc., PMID 26247089 , получено 10 декабря 2020 г.
- ^ Кумар В., Батчер С.Дж., Эрни К., Энгельхардт П., Хейкконен Дж., Каски К., Ала-Корпела М., Кованен П.Т. (май 2011 г.). «Трехмерная криоЭМ-реконструкция нативных частиц ЛПНП с разрешением 16 Å при физиологической температуре тела» . ПЛОС ОДИН . 6 (5): e18841. Бибкод : 2011PLoSO...618841K . дои : 10.1371/journal.pone.0018841 . ПМК 3090388 . ПМИД 21573056 .
- ^ Петяев, И.М.; Вуйльстеке, А.; Бетьюн, Д.В.; Хант, СП (1998). «Кислород плазмы во время искусственного кровообращения: сравнение уровня кислорода в крови с кислородом, присутствующим в липидах плазмы». Клиническая наука . 94 (1): 35–41. дои : 10.1042/cs0940035 . ISSN 0143-5221 . ПМИД 9505864 .
- ^ Бачич, Г.; Вальчак, Т.; Демсар, Ф.; Шварц, HM (октябрь 1988 г.). «Электронно-спиновый резонанс тканей с участками, богатыми липидами». Магнитный резонанс в медицине . 8 (2): 209–219. дои : 10.1002/mrm.1910080211 . ISSN 0740-3194 . ПМИД 2850439 . S2CID 41810978 .
- ^ Jump up to: а б с д и ж Намири-Калантари Р., Гао Ф., Чаттопадьяй А., Уилер А.А., Наваб К.Д., Фариас-Эйснер Р., Редди С.Т. (май 2015 г.). «Двойная природа ЛПВП: противовоспалительная и провоспалительная». Биофакторы . 41 (3): 153–9. дои : 10.1002/биоф.1205 . ПМИД 26072738 . S2CID 28785539 .
- ^ Jump up to: а б с д и Пирилло А., Катапано А.Л., Нората Г.Д. (2015). «ЛПВП при инфекционных заболеваниях и сепсисе». Липопротеины высокой плотности . Справочник по экспериментальной фармакологии. Том. 224. Спрингер. стр. 483–508. дои : 10.1007/978-3-319-09665-0_15 . hdl : 2434/274561 . ISBN 978-3-319-09664-3 . ПМИД 25522999 .
- ^ Jump up to: а б Нората Г.Д., Пирилло А., Аммирати Э., Катапано А.Л. (январь 2012 г.). «Новая роль липопротеинов высокой плотности как игрока в иммунной системе». Атеросклероз . 220 (1): 11–21. doi : 10.1016/j.atherosclerosis.2011.06.045 . ПМИД 21783193 .
- ^ «Клинический анализатор Vantera – финалист MDEA 2013» . YouTube.com . 2500 Sumner Blvd, Роли, Северная Каролина 27616: LipoScience, Inc.
{{cite web}}: CS1 maint: местоположение ( ссылка ) - ^ Биохимия 2-е изд. 1995 Гаррет и Гришэм
- ^ Принципы биохимии 2-е изд. 1995 Зубай, Парсон и Вэнс
- ^ Jump up to: а б с д и Шах А.С., Тан Л., Лонг Дж.Л., Дэвидсон В.С. (октябрь 2013 г.). «Протеомное разнообразие липопротеинов высокой плотности: наше новое понимание его важности в транспорте липидов и за его пределами» . Журнал исследований липидов . 54 (10): 2575–85. дои : 10.1194/jlr.R035725 . ПМК 3770071 . ПМИД 23434634 .
- ^ Гарсия-Риос А., Николич Д., Перес-Мартинес П., Лопес-Миранда Дж., Риццо М., Хугевен Р.К. (2014). «Субфракции ЛПНП и ЛПВП, дисфункциональные ЛПВП: варианты лечения». Текущий фармацевтический дизайн . 20 (40): 6249–55. дои : 10.2174/1381612820666140620154014 . ПМИД 24953394 .
- ^ Jump up to: а б Рейес-Соффер Г., Гинзберг Х.Н., Берглунд Л., Дуэлл П.Б., Хеффрон С.П., Камструп П.Р., Ллойд-Джонс Д.М., Марковина С.М., Йенг С., Кошинский М.Л. (январь 2022 г.). «Липопротеин (а): генетически детерминированный, причинный и распространенный фактор риска атеросклеротических сердечно-сосудистых заболеваний: научное заявление Американской кардиологической ассоциации» . Атеросклероз, тромбоз и сосудистая биология . 42 (1): е48–е60. дои : 10.1161/ATV.0000000000000147 . ПМЦ 9989949 . PMID 34647487 .
Внешние ссылки
[ редактировать ]- Липопротеины Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)