Аполипопротеин H
| АПОН | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | APOH , B2G1, B2GP1, BG, аполипопротеин H | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 138700 ; МГИ : 88058 ; Гомологен : 26 ; GeneCards : APOH ; ОМА : APOH – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
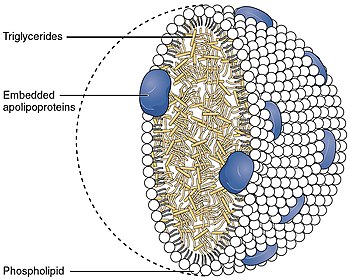
β 2 -гликопротеин 1 , также известный как бета-2 гликопротеин 1 и аполипопротеин H ( Apo-H ), представляет собой многофункциональный плазменный белок массой 38 кДа, который у людей кодируется геном APOH . [5] Одной из его функций является связывание кардиолипина . При связывании структура кардиолипина и β 2 -GP1 претерпевает большие структурные изменения. [6] В структуре Apo-H имеется участок положительно заряженных аминокислот (положения белковой последовательности 282–287), Lys-Asn-Lys-Glu-Lys-Lys, участвующих в связывании фосфолипидов (см. изображение справа). [7]
β2 - GP1 принимает сложное участие в агглютинации . По-видимому, он изменяет опосредованную аденозиндифосфатом (АДФ) агглютинацию тромбоцитов. [8] В норме β 2 -GP1 проявляет антикоагулянтную активность в сыворотке (путем ингибирования факторов свертывания крови ); однако изменения факторов крови могут привести к обращению этой активности вспять.
Хотя ранее его называли аполипопротеином H, он не присутствует в заметных количествах во фракциях липопротеинов, поэтому термин ApoH считается неправильным. [9]
Тормозная деятельность
[ редактировать ]β2 - GP1, по-видимому, полностью ингибирует высвобождение серотонина тромбоцитами. [10] и предотвращает последующие волны агрегации, вызванной АДФ. Активность β 2 -GP1, по-видимому, включает связывание агглютинирующих отрицательно заряженных соединений и ингибирует агглютинацию за счет контактной активации внутреннего пути свертывания крови. [11] β 2 -GP1 вызывает уменьшение мест связывания протромбиназы на тромбоцитах и снижает активацию, вызванную коллагеном, когда тромбин присутствует при физиологических концентрациях β 2 -GP1 в сыворотке, что указывает на регуляторную роль β 2 -GP1 в коагуляции. [12]
β 2 -GP1 также ингибирует выработку фактора Ха в присутствии тромбоцитов. [13] β 2 -GP1 также ингибирует активацию фактора XIIa . [14]
Кроме того, β2 - GP1 ингибирует активацию белка С, блокируя его активность в отношении везикул фосфатидилсерин:фосфатидилхолин. [15] однако как только протеин C активируется, Apo-H не может ингибировать активность. Поскольку белок C участвует в деградации фактора Va, Apo-H косвенно ингибирует деградацию фактора Va. [16] Эта ингибирующая активность уменьшается при добавлении фосфолипидов, что позволяет предположить, что ингибирование Apo-H белка C является конкурентным для фосфолипидов. [17] Это указывает на то, что при определенных условиях Апо-Н приобретает прокоагулянтные свойства.
Патология
[ редактировать ]Антитела анти-β2 - GP1 обнаруживаются как при инфекционных, так и при некоторых системных аутоиммунных заболеваниях (например, системной красной волчанке (СКВ) ). [18] Положительный результат на антитела к кардиолипину в диагностических тестах на аутоиммунный антифосфолипидный синдром требует присутствия β 2 -GP1 в экстракте кардиолипина. [19] [20] Антитела против β 2 -GP1 тесно связаны с тромботическими формами волчанки .
Белковый домен суши 2
[ редактировать ]| Суши_2 | |||
|---|---|---|---|
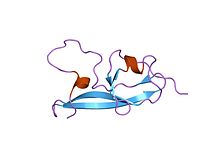 ЯМР-структура пятого домена гликопротеина бета-2 человека 1 | |||
| Идентификаторы | |||
| Символ | Суши_2 | ||
| Пфам | PF09014 | ||
| ИнтерПро | ИПР015104 | ||
| |||
В молекулярной биологии белковый домен Суши 2 также известен как пятый белковый домен бета-2-гликопротеина 1 (β 2 -GP1). Этот белковый домен встречается только у эукариот . Первые четыре домена, обнаруженные в аполипопротеине H, похожи друг на друга, однако пятый кажется другим. [21]
Структура
[ редактировать ]Этот белковый домен состоит из четырех четко выраженных антипараллельных бета-цепей и двух коротких альфа-спиралей, а также длинной очень гибкой петли . [22] Кроме того, пятый белковый домен, по-видимому, похож на остальные четыре аполипопротеина, за исключением трех внутренних дисульфидных связей и дополнительной С-концевой петли. [21]
Функция
[ редактировать ]Его точная функция еще предстоит полностью выяснена; однако известно, что он играет важную роль в связывании β 2 против β 2 -GP1 -GP1 с отрицательно заряженными соединениями и последующем захвате для связывания антител . [22] Выработка антител против β 2 -GP1 может привести к антифосфолипидному синдрому , который часто приводит к осложнениям беременности. [21]
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000091583 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000000049 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «APOH - предшественник бета-2-гликопротеина 1 - Homo sapiens (человек) - ген и белок APOH» . ЮниПрот . Проверено 5 мая 2019 г.
- ^ Борхман Д., Харрис Э.Н., Пьеранджели С.С., Ламба ОП (1995). «Взаимодействие и молекулярная структура кардиолипина и бета-2-гликопротеина 1 (бета-2-GP1)» . Клин. Эксп. Иммунол . 102 (2): 373–8. дои : 10.1111/j.1365-2249.1995.tb03792.x . ПМЦ 1553418 . ПМИД 7586693 .
- ^ Шэн Ю., Сали А., Херцог Х., Ланштайн Дж., Крилис С.А. (1996). «Сайт-направленный мутагенез рекомбинантного бета-2-гликопротеина I человека идентифицирует кластер остатков лизина, которые имеют решающее значение для связывания фосфолипидов и активности антител против кардиолипина» . Дж. Иммунол . 157 (8): 3744–51. дои : 10.4049/jimmunol.157.8.3744 . ПМИД 8871678 . S2CID 12529388 .
- ^ Нимпф Дж., Вурм Х., Костнер Г.М. (1985). «Взаимодействие бета-2-гликопротеина-I с тромбоцитами крови человека: влияние на АДФ-индуцированную агрегацию». Тромб. Гемост . 54 (2): 397–401. дои : 10.1055/s-0038-1657748 . ПМИД 4082080 . S2CID 23669362 .
- ^ Агар С., де Гроот П.Г., Левелс Дж.Х., Маркварт Дж.А., Мейерс Дж.К. (январь 2009 г.). «Бета2-гликопротеин I неправильно назван аполипопротеином H» . Журнал тромбозов и гемостаза . 7 (1): 235–6. дои : 10.1111/j.1538-7836.2008.03223.x . ПМИД 19017258 . S2CID 43329586 .
- ^ Нимпф Дж., Вурм Х., Костнер Г.М. (1987). «Бета-2-гликопротеин-I (апо-H) ингибирует реакцию высвобождения тромбоцитов человека во время агрегации, индуцированной АДФ». Атеросклероз . 63 (2–3): 109–14. дои : 10.1016/0021-9150(87)90110-9 . ПМИД 3827975 .
- ^ Шусбо I (1985). «Бета-2-гликопротеин I: плазменный ингибитор контактной активации внутреннего пути свертывания крови» . Кровь . 66 (5): 1086–91. дои : 10.1182/blood.V66.5.1086.1086 . ПМИД 4052628 .
- ^ Нимпф Дж., Беверс Э.М., Боманс П.Х. и др. (1986). «Протромбиназная активность тромбоцитов человека ингибируется бета-2-гликопротеином-I». Биохим. Биофиз. Акта . 884 (1): 142–9. дои : 10.1016/0304-4165(86)90237-0 . ПМИД 3768409 .
- ^ Ши В., Чонг Б.Х., Хогг П.Дж., Честерман К.Н. (1993). «Антикардиолипиновые антитела блокируют ингибирование бета-2-гликопротеином I активности тромбоцитов, генерирующей фактор Ха». Тромб. Гемост . 70 (2): 342–5. дои : 10.1055/s-0038-1649577 . ПМИД 8236146 . S2CID 35371017 .
- ^ Шусбо I, Расмуссен М.С. (1995). «Синхронное ингибирование фосфолипид-опосредованной аутоактивации фактора XII в плазме бета-2-гликопротеином I и анти-бета-2-гликопротеином I». Тромб. Гемост . 73 (5): 798–804. дои : 10.1055/s-0038-1653871 . ПМИД 7482406 . S2CID 89295513 .
- ^ Килинг Д.М., Уилсон А.Дж., Маки И.Дж., Изенберг Д.А., Мачин С.Дж. (1993). «Роль бета-2-гликопротеина I и антифосфолипидных антител в активации протеина С in vitro» . Дж. Клин. Патол . 46 (10): 908–11. дои : 10.1136/jcp.46.10.908 . ПМК 501616 . ПМИД 8227406 .
- ^ Мацуда Дж., Гочи К., Кавасуги К., Гото М., Сайто Н., Цукамото М. (1995). «Ингибирующая активность антитела против бета-2-гликопротеина I в отношении деградации фактора Va активированным белком C и его кофактором белком S». Являюсь. Дж. Гематол . 49 (1): 89–91. дои : 10.1002/ajh.2830490116 . ПМИД 7741146 . S2CID 42539225 .
- ^ Мори Т., Такея Х., Нисиока Дж., Габацца Э.К., Сузуки К. (1996). «Бета-2-гликопротеин I модулирует антикоагулянтную активность активированного протеина С на поверхности фосфолипидов». Тромб. Гемост . 75 (1): 49–55. дои : 10.1055/s-0038-1650220 . ПМИД 8713779 . S2CID 34123144 .
- ^ Кумар К.С., Джиоти А., Пракаш М.С., Рани Х.С., Редди П.П. (2002). «Бета2-гликопротеин I-зависимые антикардиолипиновые антитела и волчаночный антикоагулянт у пациенток с привычным невынашиванием беременности». Журнал последипломной медицины . 48 (1): 5–10. ПМИД 12082318 .
- ^ Макнил Х.П., Симпсон Р.Дж., Честерман К.Н., Крилис С.А. (1990). «Антифосфолипидные антитела направлены против сложного антигена, включающего липидсвязывающий ингибитор коагуляции: бета-2-гликопротеин I (аполипопротеин Н)» . Учеб. Натл. акад. наук. США . 87 (11): 4120–4. Бибкод : 1990PNAS...87.4120M . дои : 10.1073/pnas.87.11.4120 . ПМК 54059 . ПМИД 2349221 .
- ^ Хант Дж.Э., Макнил Х.П., Морган Г.Дж., Крамери Р.М., Крилис С.А. (1992). «Комплекс фосфолипид-бета-2-гликопротеин I является антигеном для антител к кардиолипину, возникающих при аутоиммунных заболеваниях, но не при инфекции». Волчанка . 1 (2): 75–81. дои : 10.1177/096120339200100204 . ПМИД 1301967 . S2CID 35296154 .
- ^ Jump up to: а б с Ши Т., Яннакопулос Б., Айверсон Г.М., Кокерилл К.А., Линник М.Д., Крилис С.А. (2005). «Домен V бета2-гликопротеина I связывает фактор XI/XIa и расщепляется по Lys317-Thr318» . J Биол Хим . 280 (2): 907–12. дои : 10.1074/jbc.M410291200 . ПМИД 15522884 .
- ^ Jump up to: а б Хосино М., Хагихара Ю., Ниши И., Ямадзаки Т., Като Х., Гото Ю. (декабрь 2000 г.). «Идентификация сайта связывания фосфолипидов домена V бета (2)-гликопротеина I человека методом гетероядерного магнитного резонанса». Дж. Мол. Биол . 304 (5): 927–39. дои : 10.1006/jmbi.2000.4243 . ПМИД 11124037 .
Внешние ссылки
[ редактировать ]- Аполипопротеин + H в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Аполипопротеин H и прикладные исследования
- человека Местоположение генома APOH и страница сведений о гене APOH в браузере генома UCSC .
- PDBe-KB предоставляет обзор всей информации о структуре, доступной в PDB для аполипопротеина человека H (B2G1).