Перлекан
| HSPG2 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | HSPG2 , HSPG, PLC, PRCAN, SJA, SJS, SJS1, гепарансульфат, протеогликан 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 142461 ; МГИ : 96257 ; Гомологен : 68473 ; Генные карты : HSPG2 ; ОМА : HSPG2 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Перлекан [5] (PLC), также известный как специфичный для базальной мембраны гепарансульфат-протеогликана основной белок (HSPG) или гепарансульфат-протеогликан 2 ( HSPG2 ), представляет собой белок , который у людей кодируется HSPG2 геном . [6] [7] [8] [9] Ген HSPG2 кодирует белок, состоящий из 4391 аминокислоты и молекулярной массой 468829. Это один из крупнейших известных белков. Название перлекан происходит от его внешнего вида в виде «нитки жемчуга» на вращающихся затененных изображениях.
Перлекан был первоначально выделен из линии опухолевых клеток и, как было показано, присутствует во всех нативных базальных мембранах. [10] Perlecan — это большой мультидоменный домен (пять доменов, обозначенных IV). [5] протеогликан , который связывается и сшивает многие компоненты внеклеточного матрикса клеточной поверхности (ECM) и молекулы . [11] Перлекан синтезируется как эндотелиальными , так и гладкомышечными клетками сосудов и откладывается во внеклеточном матриксе парахоксозойных животных . [12] Перлекан высоко консервативен среди разных видов, и имеющиеся данные показывают, что он произошел от древних предков путем дупликации генов и перетасовки экзонов . [11]
Структура
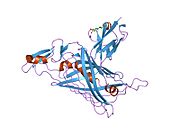
[ редактировать ]Перлекан состоит из основного белка с молекулярной массой 469 кДа три длинные цепи (каждая примерно по 70-100 кДа) гликозаминогликанов (часто гепарансульфата , HS, но может быть хондроитинсульфата , к которому присоединены , CS). Основной белок состоит из пяти различных структурных доменов . N -концевой домен I ( а.а. ~1-195) содержит сайты прикрепления цепей HS. [13] Хотя цепи HS не необходимы для правильного сворачивания и секреции белка, отсутствие HS или снижение сульфатирования могут снизить способность перлекана взаимодействовать с белками матрикса . Удаление цепей HS может повлиять на организацию матрикса и эндотелиального функцию барьера. Домен II содержит четыре повтора, гомологичных лиганд-связывающей части рецептора ЛПНП с шестью консервативными остатками цистеина и пентапептидом DGSDE, который опосредует связывание лиганда рецептором ЛПНП. Домен III гомологичен доменам IVa и IVb ламинина . Домен IV состоит из серии модулей IG . Структура только 3-го иммуноглобулинового (IG)-подобного повтора в домене IV показана на рисунке, обозначенном «HSPG2». С -концевой домен V, который гомологичен домену G длинного плеча ламинина , отвечает за самосборку и может быть важен для формирования базальной мембраны in vivo. Домен V также имеет сайты прикрепления цепей HS/CS. [14] Таким образом, коровый белок перлекана и цепи HS могут модулировать сборку матрикса, пролиферацию клеток , связывание липопротеинов и клеточную адгезию .
Функция
[ редактировать ]Перлекан является ключевым компонентом внеклеточного матрикса хряща. [15] где это важно для нормального развития пластинок роста и длинных трубчатых костей . роста [16] [17] Карликовость , перлеканом, проявляемая мышью с нулевым напоминает фенотип, возникающий в результате активации мутаций в гене FGFR3 . [18] рецептор факторов роста фибробластов . Перлекан связывается с факторами роста, участвующими в развитии пластинок роста. Было показано, что перлекан, выделенный из развивающихся пластинок роста, связывается с FGF-2 через боковые цепи гепарансульфата. [19] и к FGF-18 через домен III его корового белка [20] и опосредует их действие на рецепторы FGF. Перлекан, вероятно, играет решающую роль в секвестрации и/или доставке FGF-2 и FGF-18 во время эндохондрального окостенения .
Перлекан также является ключевым компонентом сосудистого внеклеточного матрикса, где он взаимодействует с множеством других компонентов матрикса и помогает поддерживать функцию эндотелиального барьера. Перлекан является мощным ингибитором пролиферации гладкомышечных клеток и, таким образом, считается, что помогает поддерживать сосудистый гомеостаз. Перлекан также может стимулировать активность факторов роста (например, FGF-2 ) и, таким образом, стимулировать рост и регенерацию эндотелия.
Модификация цепей гликозаминогликанов
[ редактировать ]Модификации цепей гепарансульфата на С- и N-концевых доменах являются наиболее изученными различиями в секреторном пути перлекана. Хондроитинсульфат можно заменить гепарансульфатом, при этом включение сульфата или сахарный состав цепей могут измениться. Потеря ферментов, участвующих в пути синтеза гепарансульфата, приводит к ряду состояний.
Дифференциальная модификация цепи гепарансульфата может происходить посредством ряда регуляторных сигналов. Перлекан в пластинке роста длинных костей мыши демонстрирует изменения гликозилирования при продвижении хондроцитов из зоны покоя в зону пролиферации. [21] Хотя первоначально считалось, что цепи гликозаминогликанов (ГАГ) перлекана состоят исключительно из гепарансульфата, [10] цепи хондроитинсульфата могут быть заменены [13] и это может зависеть от типа клеток. Экспрессируя рекомбинантную форму N-концевого домена I белка и демонстрируя, что расщепление пептида гепараназой или хондроитиназой не приводит к полной потере активности пептида, было показано, что цепи хондроитинсульфата могут быть добавлены к человеческому организму. перлекан. [22] Это согласуется с предыдущими данными, показывающими, что цепи хондроитинсульфата ГАГ прикреплены к бычьему перлекану, продуцируемому хондроцитами. [15] и что рекомбинантный белок человеческого домена I был гликозилирован как гепарановыми, так и хондроитинсульфатными цепями при экспрессии в клетках яичника китайского хомячка. [23] Предпочтительное добавление цепей гепарансульфата или хондроитинсульфата к доменам I и V может влиять на дифференцировку мезенхимальных тканей в хрящ, кость или любое количество тканей, но регуляторный механизм перехода от гепарансульфата к добавлению хондроитинсульфата не изучен. хорошо понял.
При изучении влияния состава протеогликана на нефритическую пермселективность было отмечено, что пуромицином обработка эндотелиальных клеток клубочков человека (HGEC) изменяла уровень сульфатирования цепей ГАГ на протеогликанах, таких как перлекан, что, в свою очередь, вызывало снижение стабильности ГАГ. цепи. Уровни мРНК коровых белков протеогликанов не были затронуты, таким образом, уменьшение цепей ГАГ произошло в результате действия какого-то другого фактора, которым в данном случае оказалось снижение экспрессии ферментов сульфаттрансферазы , играющих ключевую роль в ГАГ. биосинтез. [24] Кажется, что может быть некоторое совпадение заболеваний, связанных с потерей экспрессии протеогликана гепарансульфата и потерей ферментов, участвующих в биосинтезе гепарансульфата.
Деградация
[ редактировать ]Клетки могут модифицировать свой внеклеточный матрикс и базальные мембраны в ответ на сигналы или стресс. Специфические протеазы действуют на белок во внеклеточной среде, когда у клеток есть причина двигаться или менять свое окружение. Катепсин S представляет собой цистеиновую протеазу, которая умеренно ослабляет связывание FGF-положительных клеток с перлекан-положительным субстратом. Катепсин S представляет собой потенциальную протеазу, которая действует на основной белок перлекана в базальной мембране или строме. [25]
Цепи гепарансульфата перлекана связывают факторы роста в ЕСМ и служат колигандами или усилителями лигандов при связывании с рецепторами. Другое исследование показало, что высвобождение связанного с HS основного FGF в культуре может быть достигнуто путем обработки стромелизином, гепаритиназой I, крысиной коллагеназой и плазмином. [26] и эти сайты протеолиза проиллюстрированы на рисунке 1. Это был предложен как неисчерпывающий список протеаз, которые могут опосредовать высвобождение факторов роста из гепарансульфатных цепей перлекана. Хотя Уайтлок и др. предположили, что консенсусные последовательности расщепления тромбина существуют в коровом белке перлекана, они также постулируют, что любая активация перлекана тромбином на самом деле происходит в результате расщепления других компонентов ЕСМ. В этой статье утверждается, что гепараназа отвечает за расщепление гепарансульфатных цепей перлекана в матриксе. При этом высвобождаются факторы роста, связанные с гепарансульфатом, в частности FGF-10 . Добавление гепараназы к культуре клеток эпителия базальной мембраны вызывало увеличение пролиферации эпителиальных клеток за счет высвобождения FGF-10. [27]
В модели роста эксплантатов in vitro с использованием эпителия роговицы экспрессия матриксной металлопротеиназы (MMP) 2 коррелирует с начальной деградацией исходной базальной мембраны. Реформация базальной мембраны в культуре зависела от первоначальной активации с последующим снижением экспрессии MMP-9, в отличие от постоянной экспрессии MMP-2. Это не является доказательством того, что MMP-2 и MMP-9 напрямую расщепляют белок перлекан in vivo, но показывает, что эти белки явно модулируют некоторые факторы созревания базальной мембраны. [28] Другое семейство металлопротеаз, семейство костного морфогенетического белка 1/толлоид-подобного, высвобождает c-концевой эндорепеллиновый домен корового белка перлекана. Ламининоподобный глобулярный домен содержит активный мотив эндорепеллина и не способен расщепляться клетками, экспрессирующими мутантные и неактивные формы белков BMP-1. Более того, критический остаток, необходимый для этого расщепления, локализован в Asp4197. [29] Этот протеолитический процесс может иметь значение при заболевании, поскольку соответствующий фрагмент был обнаружен в моче пациентов, страдающих терминальной стадией почечной недостаточности. [30] и в околоплодных водах беременных женщин, перенесших преждевременный разрыв плодных оболочек. [31]
Выражение
[ редактировать ]Выражение во время разработки
[ редактировать ]Время экспрессии генов во время развития варьируется от ткани к ткани. Базальные мембраны часто являются движущей силой отделения эпителия от стромы и соединительной ткани. Перлекан имеет особое значение для развития сердечно-сосудистой, нервной и хрящевой тканей.
Преимплантационное развитие бластоцисты представляет собой контролируемый каскад регуляции генов и межклеточной передачи сигналов. Внеклеточный перлекан наблюдался на стадии бластоцисты эмбрионального развития мышей, его активность особенно повышалась в тот момент, когда эмбрион достиг «компетентности к прикреплению». [32] Этот вывод был подтвержден как на уровне мРНК, так и на уровне белка, как показали данные RT-PCR и иммуноокрашивания. Дальнейшее эмбриональное развитие регулируется так же точно, как и предимплантационное, и более сложное из-за дифференцировки всех тканей. Первое исследование экспрессии перлекана во время эмбрионального развития показало, что белок впервые экспрессируется во время развития сердечно-сосудистой системы, а затем коррелирует с созреванием большинства тканей организма, т.е. отделением эпителиальных слоев от эндотелия и стромы базальными мембранами. [33] Опять же, эта активация во время сердечно-сосудистого развития сочетается с ролью С-конца перлекана как эндорепеллина.
Пространственно-временная специфичность транс-активации гена перлекана во время развития является ключом к созреванию базальных мембран и, таким образом, к полному отделению эпителия от эндотелия и стромы. Тщательное изучение экспрессии перлекана во время развития куриных эмбрионов показало, что перлекан присутствует на стадии морулы и до конца развития, хотя экспрессия может быть временной и точно синхронизированной в определенных тканях-предшественниках. [34] Было показано, что у эмбрионов крыс экспрессия перлекана увеличивается в гладкомышечных клетках сосудов (VSMC) после e19 в развитии плода. Это прекрасно коррелирует с прекращением пролиферации СГМК на участке e18 и изменением их фенотипа. Теория, выдвинутая в этом исследовании, заключается в том, что перлекан играет антипролиферативную роль для СГМК после достижения определенной точки развития, во многом подобно зависимой от слияния экспрессии перлекана в культуре. [35] Эти результаты были подтверждены аналогичными результатами исследований легочной артерии и эпителия легких крыс. Также было обнаружено, что эти ткани начинают выработку перлекана после прекращения деления клеток, примерно на 19-й день плода. [36]
Развитие нервной системы и расширение аксонов точно направляются сигналами молекул внеклеточного матрикса. Рост обонятельных нейритов при развитии мышей управляется, по крайней мере частично, ECM, образуемым обонятельными эпителиальными клетками (OECs). Перлекан и ламинин-1, по-видимому, играют важную роль в этом пути управления, хотя индукция перлекана происходит несколько позже, чем ламинина-1. [37] Эти данные подтверждаются более ранними данными, показывающими, что OEC экспрессируют FGF-1 во время обонятельного развития и что перлекан может стимулировать рост обонятельных сенсорных нейритов в культуре в присутствии FGF-1. [38] Перлекан также продемонстрировал свойства адгезии к нервам в предыдущем исследовании, что также позволяет предположить, что в сочетании с ламинином он может действовать скорее притягивающе, чем отталкивающе. [39]
Доказано, что развитие хрящей и костей зависит от экспрессии перлекана. [16] Белок становится видимым при иммуноокрашивании на 15-й день развития мыши, независимо от других белков базальной мембраны, что позволяет предположить, что он просто является частью ЕСМ развивающихся хондроцитов в дополнение к коллагену II и другим хрящевым маркерам, которые экспрессируются, начиная с 12-го дня. . [40] Взятые с данными, [41] Поскольку мыши, лишенные гена pln, не могут поддерживать стабильность хряща, очевидно, что перлекан необходим для созревания и стабильности хрящевой структуры. Это подтверждается исследованием, показывающим, что нокдаун продукции перлекана ингибирует заключительные стадии хондрогенной дифференцировки фибробластов C3H10T1/2 в культуре. [42] Развитие костей, то есть минерализация хрящевой ткани, коррелирует с потерей перлекана и гепарансульфата в хондро-костном соединении (ХСО). [43] [44] Чтобы понять, как гепарансульфат и перлекан направляют мезенхимальные стволовые клетки на остеогенный путь, мезенхимальные стволовые клетки человека обрабатывали гепараназой и хондроитиназой в культуре. Это привело к увеличению минерализации и экспрессии маркеров остеоцитов, что подтверждает данные, показывающие, что потеря гепарансульфата в COJ является ключевым фактором остеогенеза. [45] Считается, что движущей силой активации остеогенеза гепараназой и хондроитиназой является высвобождение костного морфогенетического белка, связанного с цепями гепарансульфата.
Модели животных
[ редактировать ]Нокдаун перлекана у эмбриональных рыбок данио был достигнут за счет использования Morpholinos, нацеленного на транскрипт перлекана. Морфолино использовали для блокирования трансляции мРНК перлекана в эмбрионах рыбок данио в рамках исследования функции перлекана в развитии скелета и сосудов. Морфолино нацелено на пять основных нетранслируемых областей мРНК перлекана, блокируя таким образом трансляцию сообщения. [46] Потеря белка перлекана у этих рыб привела к серьезным миопатиям и проблемам кровообращения. Как было показано в более позднем исследовании, проведенном в той же лаборатории, этот фенотип можно спасти путем добавления экзогенного VEGF-A. [47]
Важность перлекана для развития млекопитающих продемонстрирована экспериментами по нокауту гена перлекана. [16] [41] Почти половина всех мышей, у которых ген перлекана был нокаут (мыши с нулевым уровнем перлекана), умирают на 10,5 день эмбрионального развития, когда ген перлекана обычно начинает экспрессироваться. [48] Другие умирают сразу после рождения с тяжелыми дефектами, такими как аномальное образование базальной мембраны , дефекты развития головной кости и длинных костей, а также ахондроплазия . [41] [16] Стратегия нокаута, использованная для одного из нокаутов перлекана. [41] [40] представляла собой флоксинг экзона 6 путем вставки кассеты неомицина и последующую экспрессию CRE для удаления экзона 6 из генома. Это привело к ранее обсуждавшемуся фенотипу нарушения хряща и потере целостности базальной мембраны в различных тканях. Уровень внутриутробной смертности высок, и выжившие мыши умирают вскоре после рождения. Отдельно разработанную модель мыши с нокаутом перлекана создавали путем вставки кассеты неомицина в экзон 7 гена перлекана. [16] Эти нокаутные мыши также были на 40% эмбрионально летальными, а остальные мыши умирали вскоре после рождения из-за серьезных скелетных аномалий. Фенотип нокаута перлекана в обоих исследованиях был идентичен и аналогичен фенотипу, полученному в результате активации мутаций в гене FGFR3. [18] рецептор факторов роста фибробластов.
В еще одной модели нокаута у мышей ген перлекана был мутирован путем гомологичной рекомбинации эндогенного гена перлекана с конструкцией, содержащей гомологичные плечи длиной 2 и 5 т.п.н., окружающие удаленный экзон 3. [49] который кодирует 2 из 3 сайтов прикрепления гепарансульфата в домене I [13] из перлекана. Однако перлекан, полученный из культивированных фибробластов мышей с нокаутом экзона 3, содержал 40% гепарансульфата и 60% хондроитинсульфата. [50] поскольку в дополнение к одному сайту прикрепления гепарансульфата, оставшемуся в домене I, сайт прикрепления в домене V [14] тоже все равно будет присутствовать. Исследование показало, что у мышей с нокаутом экзона 3 к 3-й неделе постнатального развития наблюдался коллапс целостности капсулы хрусталика, что указывает на роль аминокислот, удаленных из домена I перлекана, в поддержании целостности базальной мембраны капсулы хрусталика. [49] Однако, в отличие от мышей, нокаутных по перлекану, жизнеспособность и рост длинных костей у мышей, нокаутных по экзону 3, были нормальными. Это говорит о том, что при нокауте экзона 3 оставшиеся сайты прикрепления гепарансульфата в доменах I и V доступны для связывания FGF-2. [19] или сайт в домене 3 доступен для связывания FGF-18 [20] может быть достаточно для нормального роста трубчатых костей.
Изменения хрусталика у мышей с нокаутом экзона 3 несколько похожи на модель мышей с нокаутом TGF-β. [51] [52] Мыши с нокаутом экзона 3 также показали снижение способности к заживлению ран и ангиогенезу при воздействии либо эпидермального повреждения, либо добавления FGF-2 к роговице. [53] В исследовании эпидермального повреждения у мышей с отрицательным экзоном 3 и контрольных мышей образовалась рана, охватывающая всю глубину эпидермиса, а у нокаутных мышей ангиогенез и признаки заживления ран развивались медленно, возможно, из-за снижения секвестрации факторов роста гепарансульфат-негативный перлекан. Аналогичный результат был получен при анализе микрокарманов роговицы, где FGF-2 имплантируется в роговицу мышей и у нормальных мышей индуцируется ангиогенез. У нокаутных мышей этот ангиогенный эффект был нарушен, хотя и не полностью.
Полноразмерную конструкцию перлекана под контролем промотора коллагена типа II использовали для создания трансгенной мыши по перлекану. [54] Промотор коллагена типа II обеспечивает экспрессию перлекана только во внеклеточном матриксе, образованном хондроцитами, но не в базальных мембранах, образованных эндотелиальными, эпителиальными или мышечными клетками. Трансген перлекана у мышей с нулевым перлеканом устранял летальность и восстанавливал рост длинных трубчатых костей до нормального уровня. Это говорит о том, что перлекан играет решающую роль в развитии хряща. Однако у трансгенных мышей по перлекану наблюдалась мышечная гипертрофия, [55] что указывает на роль перлекана в развитии мышц, а также в пластинке роста хряща, опосредованной ростом длинных трубчатых костей.
Исследования на мышах с нокаутом генов и заболеваниях человека также выявили решающую роль перлекана in vivo в развитии хряща. [56] и активность нервно-мышечных соединений. [17]
Сигнальные пути и их влияние на экспрессию
[ редактировать ]Сигнальные пути повышают или снижают уровни транскрипции генов, что, в свою очередь, заставляет клетки изменять профиль экспрессии генов. Конечный эффект сигнальных путей оказывается на промоторе генов, который может включать элементы, расположенные выше или ниже места начала транскрипции, некоторые из которых могут существовать внутри самого транскрибируемого гена. Ряд сигнальных молекул может влиять на изменения экспрессии перлекана, включая семейства молекул трансформирующего фактора роста-бета (TGF-β), интерлейкина (IL) и фактора роста эндотелия сосудов (VEGF).
Транскрипционная активация
[ редактировать ]Вышестоящие 2,5 тыс. оснований промоторной области перлекана были изучены с помощью CAT-активации в клеточных линиях различного гистологического происхождения. [57] Это исследование пришло к выводу, что в промоторе существует элемент, чувствительный к TGF-β, всего в 285 парах оснований выше сайта начала транскрипции. Этот результат был подтвержден на таких тканях, как клетки карциномы толстой кишки человека. [58] и мышиный эпителий матки [59] путем добавления цитокина in vitro в среду для культивирования клеток. Исследования in vitro передачи сигналов TGF-β1 и его влияния на экспрессию перлекана могут иметь разные результаты в разных типах клеток. В клетках гладких мышц коронарных артерий человека в культуре передача сигналов TGF-β1 не оказала влияния на экспрессию перлекана, хотя она и активировала другие компоненты матрикса. [60] In vivo демонстрация динамической регуляции перлекана и его контроля с помощью внеклеточных сигнальных путей имеет решающее значение для нашего понимания роли белка в развитии. С этой целью была создана трансгенная линия мышей, экспрессирующая свиной TGF-β1 под линзоспецифичным промотором αA-кристаллина. [51] а затем была создана еще одна аналогичная линия, но с геном, управляемым промотором βb-кристаллина, соответствующим другому гену, специфичному для линз. [52] Эта динамично развивающаяся ткань продемонстрировала серьезную неправильную регуляцию компонентов внеклеточного матрикса, включая перлекан, с чрезмерной экспрессией TGF-β1. Помутнение роговицы произошло у обеих трансгенных линий на ранних стадиях развития из-за значительного увеличения экспрессии перлекана, фибронектина и тромбоспондина-1 в мезенхиме роговицы. Эффект был более выраженным в линии, управляемой промотором βB-1 Crystallin.
Семейство воспалительных цитокинов IL также активирует транскрипт pln. В мышиной модели образования бляшек при болезни Альцгеймера IL-1-альфа вызывает увеличение экспрессии перлекана в ответ на повреждение головного мозга. [61] Обработка IL-4 человеческих фибробластов десен в культуре привела к увеличению продукции различных протеогликанов гепарансульфата, включая перлекан. [62] Обработка фибробластов легких человека in vitro IL-1-бета не привела к значительному увеличению продукции перлекана. [63]
Другим сигнальным путем, который, как было показано, усиливает транскрипцию pln, является путь VEGF. Обработка VEGF165 микрососудистых эндотелиальных клеток головного мозга человека в культуре стимулирует усиление транскрипции pln. Эта молекула является лигандом рецептора VEGF-2 (VGFR2), и кажется, что этот ответ VEGF165 специфичен для усиления регуляции перлекана, что приводит к образованию петли положительной обратной связи с участием фактора роста фибробластов (FGF), рецептора FGF (FGFR) и VEGFR2 в ответ. к повреждению эндотелия. Эта микрососудистая регуляция с помощью VEGF165 повышает вероятность того, что антикоагулянтная функция перлекана является частью процесса контроля повреждений в эндотелии головного мозга. [64]
Передача сигналов протеинкиназы C предположительно ответственна за усиление транскрипции и трансляции некоторых протеогликанов, включая перлекан. Когда эндоцитарный путь клеток HeLa ингибируется сверхэкспрессией мутантного динамина, протеинкиназа C активируется, а сообщение перлекана и количество белка впоследствии увеличиваются. [65] Напротив, обычное подавление перлекана в ответ на гипергликемию теряется у мышей, отрицательных по PKC-α. [66]
Снижение транскрипции
[ редактировать ]Передача сигналов интерферона-γ опосредует репрессию транскрипции гена перлекана. [67] Впервые это было показано на клеточных линиях рака толстой кишки, а затем на клеточных линиях другого тканевого происхождения, но в каждом случае для того, чтобы сигнал подействовал, требовался интактный транскрипционный фактор STAT1. Это заставило исследователей поверить, что транскрипционный фактор STAT1 взаимодействует с промотором Pln в дистальной области, локализованной на 660 пар оснований выше сайта начала транскрипции. [67] Обработка интерфероном-γ мышиных эмбрионов на стадии бластоцисты приводит к потере экспрессии перлекана в трофэктодерме и, следовательно, к потере морфологии и фенотипа эмбриона в клеточной культуре, что позволяет предположить, что эти обработанные интерфероном-γ бластоцисты будут дефектными при имплантации. [68] Предположительно, потеря экспрессии перлекана происходит из-за подавления транскрипции посредством активности транскрипционного фактора STAT1, как было показано ранее. Эти результаты in vitro не обязательно отражают нормальные физиологические концентрации интерферона-γ, и цитокин обычно не экспрессируется широко, а в очень специфические моменты времени развития. Важно отметить, что экспрессия перлекана может быть снижена путем лечения экзогенным цитокином, таким как интерферон-γ, и если бы имело место физиологически аномальное увеличение экспрессии цитокина, это могло бы помешать имплантации.
Клеточные стрессоры и их влияние на экспрессию
[ редактировать ]Механический и химический стресс может повредить базальные мембраны или клетки, которые они поддерживают. Это может повлиять на профиль экспрессии генов в клетках, особенно в их внеклеточном матриксе, который часто обеспечивает физическую поддержку и химический барьер для клеток. Гипоксия, воспаление, механический и химический стресс были исследованы на предмет того, как они связаны с экспрессией перлекана.
Гипоксия — это состояние, возникающее при болезненных состояниях и во время травм, и часто приводит к отсутствию пролиферации эндотелиальных клеток. Эта роль, а также роль перлекана как эндорепеллина побудили к исследованию природы регуляции экспрессии перлекана эндотелиальными клетками во время гипоксических состояний. [69] В условиях гипоксии это исследование показало, что экспрессия перлекана эндотелиальными клетками микрососудистых сосудов сердца крыс снижается на шестьдесят один процент по сравнению с нормальным контролем. В этой статье утверждается, что подавление перлекана приводит к потере активации FAK и, следовательно, к уменьшению передачи сигналов ERK, что приводит к снижению пролиферации клеток. Кажется нелогичным, что эндотелиальные клетки будут пролиферировать медленнее из-за потери перлекана и его субъединицы эндорепеллина. Возможно, эти эндотелиальные клетки просто подавляют транскрипцию многих генов в ответ на гипоксические условия. В другом исследовании гипоксия привела к индукции генов, связанных с апоптозом и гибелью клеток, но репрессия генов не ограничивалась белками, связанными с определенным путем. [70] Когда эпителиальные клетки кишечника T84 подвергаются гипоксическим условиям в течение 24 часов, происходит значительное увеличение продукции мРНК перлекана и белка. [71] Они связывают это с тем фактом, что многие гены, уровень активности которых повышается в ответ на гипоксию, содержат в своем промоторе элемент ответа цАМФ (CRE), как и pln. Эта разница между эндотелиальными клетками из исследования 2007 года и эпителиальными клетками, изученными в этих экспериментах, свидетельствует о том, насколько различаются регуляторные механизмы перлекана в разных типах клеток.
Развитие бета-амилоидных бляшек в головном мозге связано с началом болезни Альцгеймера. Эти бляшки вызывают постоянное состояние воспаления в областях скопления, что приводит к экспрессии определенных генных продуктов, связанных с воспалением, некоторые из которых закрепляют воспаление в мозге. Как упоминалось ранее, для исследования влияния воспаления головного мозга на уровни экспрессии перлекана в мозгу мышей создавали колотые раны иглами, а после воспаления и различных периодов восстановления уровни мРНК и белка оценивали с помощью гибридизации in situ и иммуноокрашивания. Уровни перлекана повышались в гиппокампе, но не в полосатом теле, в течение периода заживления, наряду с экспрессией IL-1-альфа. [61] Экспрессия перлекана была прослежена в микроглиальных клетках гиппокампа и астроцитах. Эта роль перлекана в образовании бета-амилоидных бляшек подтверждается более ранним исследованием, показавшим, что лечение перлеканом и бета-амилоидом мозга крыс приводило к образованию старческих бляшек, тогда как лечение только бета-амилоидом не имело такого же эффекта. [72]
На уровне организма механический стресс оказывает глубокое влияние на целостность внеклеточного матрикса и, вероятно, вызывает индукцию ряда генов ЕСМ для восстановления и ремоделирования ЕСМ в тканевой строме и базальных мембранах. В одном исследовании изучалось влияние давления in vitro на глобальную транскрипцию генов с использованием подхода микрочипов и системы растяжения клеток, предназначенной для имитации внутриглазного давления в решетчатой пластинке (соединительной ткани) диска зрительного нерва. Их результаты заключались в том, что перлекан и некоторые другие протеогликаны активировались в ответ на стимул растяжения. Также были индуцированы TGF-β2 и VEGF, что, возможно, способствовало усилению регуляции транскрипта и белка перлекана. [73] Было показано, что аутокринная передача сигналов TGF-β является компенсаторным результатом механического стресса in vitro в эндотелиальных клетках. Используя аналогичный механизм растяжения клеток для имитации артериального давления, это исследование показало, что выработка перлекана увеличивается в ответ на механическое напряжение. Это зависит от аутокринной передачи сигналов TGF-β в петле положительной обратной связи с p38 и ERK. [74] Это увеличение выработки эндотелиальными клетками ингибиторов роста СГМК (т.е. гепарина) обратимо в СГМК, где механический стресс индуцирует пролиферацию. [75] Деформация клеток СГМК в культуре приводит к усилению регуляции перлекана со значительным увеличением сульфатирования цепей гепарансульфата. [76] Это не противоречит данным, показывающим, что экспрессия перлекана постоянна за пределами e19 в СГМК крысы, что позволяет предположить, что перлекан играет антипролиферативную роль для СГМК крыс. В этом случае кажется, что сигнальная функция молекулы является оперативным фактором активации, особенно из-за увеличения сульфатирования цепей гепарансульфата.
Химическое повреждение органов может повлиять не только на генетическую и механическую целостность клетки, но и на внеклеточный матрикс ткани. Чтобы изучить влияние химического повреждения на клетки печени, крыс Вистар обрабатывали четыреххлористым углеродом в течение 48 часов перед умерщвлением. До обработки CCl 4 окрашивание перлеканом ограничивалось желчными протоками и синусоидальными кровеносными сосудами печени. После обработки окрашивание перлеканом было интенсивным в участках некроза. Это могло быть связано с усилением капилляризации печени при попытке регенерации поврежденной ткани. [77] Аналогичные результаты были получены при лечении мышей ацетаменофином, где перлекан и другие компоненты матрикса были в значительной степени экспрессированы в некротических поражениях печени. [78]
Экспрессия в клеточной культуре
[ редактировать ]Одним из веских аргументов против достоверности результатов культивирования клеток in vitro на двумерных пластиковых пластинах является то, что окружающая среда неточно отражает среду клеток организма. Эта проблема решается путем разработки 3D-культур клеток с использованием широкого спектра субстратов в качестве каркасов или сред для клеток. В таких условиях экспрессия генов ЕСМ может быть более близкой к нативному профилю экспрессии. Трехмерные каркасы, структуры, на которых растут культивируемые клетки, могут состоять из других клеток, то есть совместных культур, синтетических полимеров, имитирующих естественную среду клеток, или очищенного ЕСМ, такого как матригель, и любой смеси этих трех компонентов.
Одна такая система была разработана для изучения развития кожи и образования базальной мембраны между кератиноцитами и стромой. [79] Эта система используется для определения границ развития базальной мембраны между фибробластами в строме (в данном случае фибробластами в коллагеновом геле типа I) и кератиноцитами, выращенными поверх геля. Экспрессия перлекана и, следовательно, созревание базальной мембраны зависят от сшивания нидогеном цепи коллагена IV и ламинина γ1 в этой системе. [80] Этот эффект также приводил к отсутствию гемидесмосом в развивающейся ткани. Другая система, использующая дезорганизованный гель гидратированного коллагена I, была использована для демонстрации того, что первичные фибробласты роговицы человека в конечном итоге проникают в гель и создают матрицу, состоящую из коллагена типа I и перлекана, а также нескольких других сульфатированных гликопротеинов матрикса. Это имитирует программу развития фибробластов роговицы in vivo и реакцию на травму. [81]
Одной из долгосрочных целей создания систем 3D-культуры клеток является создание тканей, которые можно будет использовать в качестве замены пациентам со многими типами заболеваний. В тканеинженерных сердечных клапанах, созданных путем посева миофибробластов на коллаген типа I с последующими эндотелиальными клетками, была подтверждена экспрессия протеогликана гепарансульфата, хотя в этих тканях не было сделано различие между синдеканом и перлеканом. [82] Еще одна процедура, которая может стать возможной с помощью тканевой инженерии, — это кератоэпителиопластика. Пересаженная ткань должна оставаться интактной, для чего требуется предварительно сформированная базальная мембрана. Коллагеновые гели способствуют образованию полной базальной мембраны эпителиальными клетками роговицы в культуре. [83]
Перлекан также обещает служить основой для посева клеток в культуру. Протоковые и ацинарные клетки слюнных желез человека были успешно выращены на биоактивном пептиде, содержащем последовательность, повторяющуюся в домене IV белка перлекана. Эти клетки воспроизводят ациноподобные структуры, подобные тем, которые обнаруживаются в нативной железе и плотных контактах, а также полные базальные мембраны в культуре. [84]
Ассоциация заболеваний
[ редактировать ]Рак
[ редактировать ]Хотя подавление перлекана вызывает существенное ингибирование роста опухоли и неоваскуляризации у нулевых мышей, напротив, когда перлекан-нулевые клетки инъецируют голым мышам, наблюдается усиленный рост опухоли по сравнению с контрольной группой.Прогрессирование и патогенез рака тесно связаны с составом внеклеточного матрикса, а роль перлекана и других молекул ЕСМ в развитии рака изучается большим количеством лабораторий. Поскольку базальная мембрана является первым препятствием на пути экстравазации клеток карциномы, функции перлекана в этом процессе множественны. Одной модельной системой, используемой для изучения экспрессии перлекана в клеточных линиях карциномы, является система клеток MeWo/70W с метастатической прогрессией меланомы. Клетки MeWo характерно менее инвазивны, чем их клональный вариант клеточной линии 70W. Одна лаборатория изучала экспрессию перлекана в 27 инвазивных меланомах, и 26 из 27 образцов показали значительное увеличение содержания перлекана по сравнению с нормальной тканью тех же пациентов. Затем они использовали клеточные линии MeWo и 70W, чтобы изучить, изменилась ли экспрессия перлекана во время лечения нейротрофинами, которые могут стимулировать инвазию клеток через матригель in vitro. Более инвазивные клетки 70W начали экспрессировать перлекановое сообщение через десять минут после стимуляции нейротрофинами, а клетки MeWo не производили никакого сообщения pln независимо от лечения. В этом исследовании особое внимание уделялось тому факту, что активация перлекана происходила даже раньше, чем гепараназы, важного белка, участвующего в процессе экстравазации. [85] [86]
При раке яичников, как и при других видах рака, экспрессия перлекана происходит по-разному в зависимости от прогрессирования заболевания. Окрашивание перлеканом теряется в базальной мембране яичника, поврежденной инвазивной аденокарциномой, в отличие от окрашивания перлеканом в базальных мембранах нормальных яичников и яичников с доброкачественными опухолями, где базальная мембрана однородна и очень похожа по составу на таковую в яичниках. другие нормальные ткани. [87] Это согласуется с другими результатами, показывающими потерю перлекана в базальных мембранах, пораженных инвазивным раком шейки матки, распространяющимся на лимфатические узлы таза, что неудивительно из-за корреляции повышенных уровней экспрессии мРНК гепараназы с инвазией аналогичной карциномы шейки матки. [88] Напротив, образование опухоли иммортализованной мышиной эпителиальной клеточной линии RT101, инъецированной крысам, зависело от экспрессии перлекана клетками мыши, а не от присутствия эндогенного крысиного перлекана. Клетки RT101 с перлеканом, ноктуированным антисмысловым действием, не показали образования опухоли в этой системе, однако клетки, экспрессирующие антисмысловой перлекан и рекомбинантную конструкцию, кодирующую домены I, II и III мышиного перлекана, действительно показали образование опухоли. Таким образом, оказывается, что в этой системе экспрессия перлекана опухолевыми клетками необходима для агрегации опухоли. [89] Дополнительные исследования модификации цепи GAG или основного белка инвазивными опухолевыми клетками по сравнению с доброкачественными опухолевыми клетками и нормальной тканью были бы информативными для лучшего понимания роли перлекана в миграции рака.
Несколько лабораторий изучали ангиогенез опухолевых клеток in vitro с использованием антисмысловых конструкций к сообщению перлекана. Полноразмерная кДНК обратного комплемента, управляемая сильным промотором, трансфицируется в различные типы клеток для устранения экспрессии перлекана. Антисмысловые клетки карциномы толстой кишки блокируют трансляцию перлекана, что приводит к снижению роста опухоли и ангиогенеза. [90] Аналогичное снижение пролиферации in vitro наблюдалось в клетках NIH 3T3 и линии клеток меланомы человека, экспрессирующей антисмысловую мРНК перлекана. [91] Результаты in vitro с клеточными линиями саркомы Капоши показали, что потеря перлекана в результате трансфекции антисмысловой конструкцией привела к снижению пролиферации и миграции этого высокометастатического типа клеток. [92] Эти результаты контрастируют с результатами in vivo с теми же линиями саркомы Капоши, которые показывают, что снижение перлекана приводит к усилению ангиогенеза, что облегчает миграцию и, таким образом, связано с увеличением степени злокачественности опухоли. [92] Антисмысловой нокдаун перлекана в клеточных линиях фибросаркомы приводил к усилению роста и миграции как in vitro, так и in vivo. [93] Эти данные о более значительном онкогенезе in vivo подтверждаются данными, показывающими, что С-конец белка перлекана действует как эндостатический модуль, теперь известный как эндорепеллин. [46] [47] [94]
Рибозимная конструкция была создана для использования в снижении уровней трансляции перлекана. Этот рибозим был нацелен на последовательность, кодирующую домен I белка перлекана. Он снизил экспрессию перлекана до 80% в линии клеток рака простаты C42B. [95] В отличие от ранее обсуждавшихся исследований, эти клетки производили опухоли меньшего размера, чем их родительские клетки, когда их вводили бестимусным мышам. Что означает это несоответствие результатов для инвазии, неизвестно, хотя это правда, что перлекан является частью внеклеточного матрикса в мезенхимальной ткани, и клетки, претерпевающие эпителиально-мезенхимальный переход (ЕМТ), могут усиливать экспрессию перлекана как часть своего программирования ЕМТ.
Диабет и сердечно-сосудистые заболевания
[ редактировать ]Уровни перлекана снижаются при многих болезненных состояниях, например, при диабете , атеросклерозе и артрите . Перлекан играет важную роль в поддержании барьера клубочковой фильтрации. [96] Снижение перлекана в базальной мембране клубочков играет центральную роль в развитии диабетической альбуминурии . Экспрессия перлекана подавляется многими атерогенными стимулами, и поэтому считается, что перлекан играет защитную роль при атеросклерозе. [97] [98] Диабет и атеросклероз часто являются ассоциированными синдромами. 80% смертей, связанных с диабетом, связаны с той или иной формой атеросклеротических осложнений, а базальная мембрана эндотелия вовлечена в атерогенный процесс. Показано снижение синтеза гепарансульфата в артериях диабетиков и артериях с атеросклеротическим поражением. [99]
Механизм снижения регуляции гепарансульфата при этих поражениях в течение некоторого времени оставался неизвестным. Одна теория утверждает, что высокий уровень глюкозы в кровообращении может привести к уменьшению прикрепления цепи ГАГ к перлекану, но не обязательно к изменению синтетического пути цепей ГАГ или основного белка. После обработки эндотелиальных клеток аорты человека средой с высоким содержанием глюкозы секретируемый перлекан содержал меньшее количество сульфатов, что сопровождалось меньшим общим включением цепи GAG. [100] Хотя не выявлено ни одного сигнального пути, приводящего к такому уменьшению включения цепи GAG, предполагается, что потеря 30% общего гликозилирования белка может означать потерю одной из трех цепей HS на перлекане в этой модели гипергликемии, связанной с диабетом. Также отмечено, что аналогичное снижение внеклеточного ГС без изменения окраски основных белковых цепей происходит в диабетических почках и в клетках почек в культуре, обработанной высоким содержанием глюкозы. [101] [102]
Атеросклероз чаще всего является виновником ишемической болезни сердца и других сердечно-сосудистых заболеваний, а большая агрегация белка перлекана является симптомом запущенных атеросклеротических бляшек. VSMCs являются производителями перлекана в этом состоянии, а это означает, что большое количество исследований было сосредоточено на понимании способов повышения регуляции перлекана в этом состоянии. В тесте влияния циркулирующих неэстерифицированных жирных кислот (симптомов диабета и атерогенеза) на экспрессию перлекана СГМК экспрессия не изменилась по сравнению с контрольными клетками. Это контрастировало с 2-10-кратным увеличением экспрессии других протеогликанов базальной мембраны. [103] Тромбин является еще одним маркером, связанным с атерогенезом и прокоагуляцией, и он избирательно усиливает выработку перлекана, но не других протеогликанов в СГМК человека в культуре. [104] Предполагается, что этот эффект наблюдается только тогда, когда СГМК достигают слияния, но не до слияния. Эта концепция аналогична ранее упомянутым исследованиям, показывающим, что перлекан производится СГМК только после того, как они прекратили распространение во время разработки. [35] [36] Другим маркером атеросклеротического пути является ангиотензин II, который также усиливает экспрессию перлекана в СГМК в культуре. [105] Учитывая выдающуюся роль экспрессии перлекана при атеросклерозе, существует потенциал для терапии, основанной на экспрессии перлекана, и исследования могут в конечном итоге продолжиться в этом направлении.
Генетическое заболевание
[ редактировать ]Мутации в гене HSPG2 , кодирующем перлекан, вызывают диссегментарную дисплазию. [6] Тип Сильвермана-Хендмейкера и синдром Шварца-Джампеля . [9]
Взаимодействия
[ редактировать ]Было показано, что перлекан взаимодействует с
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000142798 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000028763 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Jump up to: а б Нунан Д.М., Фулле А., Валенте П., Кай С., Хориган Э., Сасаки М. и др. (декабрь 1991 г.). «Полная последовательность перлекана, протеогликана гепарансульфата базальной мембраны, обнаруживает большое сходство с цепью ламинина А, рецептором липопротеина низкой плотности и молекулой адгезии нервных клеток» . Журнал биологической химии . 266 (34): 22939–47. дои : 10.1016/S0021-9258(18)54445-8 . ПМИД 1744087 .
- ^ Jump up to: а б Арикава-Хирасава Э., Уилкокс В.Р., Ле А.Х., Сильверман Н., Говиндрадж П., Хасселл Дж.Р., Ямада Ю. (апрель 2001 г.). «Диссегментарная дисплазия типа Сильвермана-Хендмейкера вызвана функциональными нулевыми мутациями гена перлекана». Природная генетика . 27 (4): 431–4. дои : 10.1038/86941 . ПМИД 11279527 . S2CID 22934192 .
- ^ «Ген Энтрез: гепарансульфат-протеогликан 2 HSPG2» .
- ^ Каллунки П., Эдди Р.Л., Байерс М.Г., Кестила М., Шоу ТБ, Трюггвасон К. (октябрь 1991 г.). «Клонирование корового белка протеогликана гепарансульфата человека, отнесение гена (HSPG2) к 1p36.1----p35 и идентификация полиморфизма длины рестрикционного фрагмента BamHI». Геномика . 11 (2): 389–96. дои : 10.1016/0888-7543(91)90147-7 . ПМИД 1685141 .
- ^ Jump up to: а б Арикава-Хирасава Э., Ле А.Х., Нишино И., Нонака И., Хо Н.К., Франкомано К.А. и др. (май 2002 г.). «Структурные и функциональные мутации гена перлекана вызывают синдром Шварца-Ямпеля с миотонической миопатией и хондродисплазией» . Американский журнал генетики человека . 70 (5): 1368–75. дои : 10.1086/340390 . ПМЦ 447613 . ПМИД 11941538 .
- ^ Jump up to: а б Хасселл-младший, Роби П.Г., Баррах Х.Дж., Вильчек Дж., Реннард С.И., Мартин Г.Р. (август 1980 г.). «Выделение гепарансульфатсодержащего протеогликана из базальной мембраны» . Труды Национальной академии наук Соединенных Штатов Америки . 77 (8): 4494–8. Бибкод : 1980PNAS...77.4494H . дои : 10.1073/pnas.77.8.4494 . ПМЦ 349870 . ПМИД 6449008 .
- ^ Jump up to: а б Иоццо Р.В. (апрель 1994 г.). «Перлекан: жемчужина протеогликана». Матричная биология . 14 (3): 203–8. дои : 10.1016/0945-053X(94)90183-X . ПМИД 7921536 .
- ^ Аарон Л. Фидлер, Карл Э. Дэррис, Сергей В. Четыркин, Вадим К. Педченко, Сергей П. Будко, Кайл Л. Браун, В. Грей Джером, Джули К. Хадсон, Антонис Рокас, Билли Г. Хадсон (2017) Коллаген IV и базальная мембрана на этапе эволюции рассвет тканей многоклеточных животных eLife 6:e24176 https://doi.org/10.7554/eLife.24176
- ^ Jump up to: а б с Долан М., Хорчар Т., Ригатти Б., Хасселл-младший (февраль 1997 г.). «Идентификация сайтов в домене I перлекана, которые регулируют синтез гепарансульфата» . Журнал биологической химии . 272 (7): 4316–22. дои : 10.1074/jbc.272.7.4316 . ПМИД 9020150 .
- ^ Jump up to: а б Тапанадехопон П., Хасселл-младший, Ригатти Б., Коучман-младший (ноябрь 1999 г.). «Локализация сайтов замены гликозаминогликанов в домене V мышиного перлекана». Связь с биохимическими и биофизическими исследованиями . 265 (3): 680–90. дои : 10.1006/bbrc.1999.1714 . ПМИД 10600481 .
- ^ Jump up to: а б СундарРадж Н., Файт Д., Ледбеттер С., Чакраварти С., Хасселл-младший (июль 1995 г.). «Перлекан является компонентом хрящевого матрикса и способствует прикреплению хондроцитов» . Дж. Клеточная наука . 108 (Часть 7) (7): 2663–72. дои : 10.1242/jcs.108.7.2663 . ПМИД 7593307 .
- ^ Jump up to: а б с д и Арикава-Хирасава Э., Ватанабэ Х., Таками Х., Хасселл-младший, Ямада Ю. (1999). «Перлекан необходим для развития хрящей и головного мозга». Нат. Жене . 23 (3): 354–8. дои : 10.1038/15537 . ПМИД 10545953 . S2CID 20871336 .
- ^ Jump up to: а б Хассел Дж., Ямада Ю., Арикава-Хирасава Э. (2002). «Роль перлекана в развитии скелета и заболеваниях». Гликокондж. Дж . 19 (4–5): 263–7. дои : 10.1023/А:1025340215261 . ПМИД 12975604 . S2CID 6832133 .
- ^ Jump up to: а б Тавормина П.Л., Шианг Р., Томпсон Л.М., Чжу Ю.З., Уилкин Д.Д., Лахман Р.С. и др. (март 1995 г.). «Танатофорная дисплазия (типы I и II), вызванная различными мутациями рецептора 3 фактора роста фибробластов». Природная генетика . 9 (3): 321–8. дои : 10.1038/ng0395-321 . ПМИД 7773297 . S2CID 10050610 .
- ^ Jump up to: а б с Смит С.М., Вест-Л.А., Говиндрадж П., Чжан X, Орниц Д.М., Хасселл-младший (апрель 2007 г.). «Гепаран и хондроитинсульфат на перлекане пластинки роста опосредуют связывание и доставку FGF-2 к рецепторам FGF». Матричная биология . 26 (3): 175–84. дои : 10.1016/j.matbio.2006.10.012 . ПМИД 17169545 .
- ^ Jump up to: а б с Смит С.М., Западный Лос-Анджелес, Хасселл-младший (декабрь 2007 г.). «Основной белок перлекана пластинки роста связывает FGF-18 и изменяет его митогенное действие на хондроциты» . Архив биохимии и биофизики . 468 (2): 244–51. дои : 10.1016/j.abb.2007.10.006 . ПМК 2696159 . ПМИД 17971291 .
- ^ Уэст Л., Говиндрадж П., Кооб Т.Дж., Хасселл-младший (июнь 2006 г.). «Изменения перлекана во время дифференцировки хондроцитов в пластинке роста ребер плода крупного рогатого скота» . Дж. Ортоп. Рез . 24 (6): 1317–26. дои : 10.1002/jor.20160 . ПМИД 16705694 . S2CID 2487979 .
- ^ Французский ММ, Гомес Р.Р., Тимпл Р., Хёк М., Чиммек К., Фарах-Карсон М.К. , Карсон Д.Д. (январь 2002 г.). «Хондрогенная активность протеогликана гепарансульфата перлекана отображается на N-концевом домене I» . Дж. Боун Майнер. Рез . 17 (1): 48–55. дои : 10.1359/jbmr.2002.17.1.48 . ПМК 1774590 . ПМИД 11771669 .
- ^ Кокеньеси Р., Зильберт Дж.Э. (июнь 1995 г.). «Образование гепарансульфата или хондроитина/дерматансульфата на рекомбинантном домене I мышиного перлекана, экспрессируемом в клетках яичника китайского хомячка». Биохим. Биофиз. Рез. Коммун . 211 (1): 262–7. дои : 10.1006/bbrc.1995.1805 . ПМИД 7779094 .
- ^ Бьорнсон А., Мозес Дж., Ингеманссон А., Харальдссон Б., Соренссон Дж. (апрель 2005 г.). «Первичные эндотелиальные клетки клубочка человека продуцируют протеогликаны, а пуромицин влияет на их посттрансляционную модификацию». Являюсь. Дж. Физиол. Почечная физиол . 288 (4): F748–56. дои : 10.1152/ajprenal.00202.2004 . ПМИД 15585670 . S2CID 13731498 .
- ^ Люццо Дж.П., Петанческа С.С., Москателли Д., Деви Л.А. (май 1999 г.). «Медиаторы воспаления регулируют катепсин S в макрофагах и микроглии: роль в ослаблении взаимодействия гепарансульфата» . Мол. Мед . 5 (5): 320–33. дои : 10.1007/BF03402068 . ПМК 2230418 . ПМИД 10390548 .
- ^ Уайтлок Дж. М., Мердок А. Д., Иоззо Р. В., Андервуд, Пенсильвания (апрель 1996 г.). «Разрушение перлекана, полученного из эндотелиальных клеток человека, и высвобождение связанного основного фактора роста фибробластов под действием стромелизина, коллагеназы, плазмина и гепараназ» . Ж. Биол. Хим . 271 (17): 10079–86. дои : 10.1074/jbc.271.17.10079 . ПМИД 8626565 . S2CID 8872716 .
- ^ Патель В.Н., Нокс С.М., Ликар К.М., Латроп К.А., Хоссейн Р., Эфтехари С., Уайтлок Дж.М., Элкин М., Влодавский И., Хоффман М.П. (декабрь 2007 г.). «Расщепление гепараназой перлекана гепарансульфата модулирует активность FGF10 во время морфогенеза ветвления подчелюстной железы ex vivo» . Разработка . 134 (23): 4177–86. дои : 10.1242/dev.011171 . ПМИД 17959718 . S2CID 25819221 .
- ^ Ли В, Хэ Х, Куо CL, Гао Й, Кавакита Т, Ценг С.С. (июнь 2006 г.). «Растворение и повторная сборка базальной мембраны лимбальными эпителиальными клетками роговицы, разросшимися на амниотической мембране» . Инвестируйте. Офтальмол. Вис. Наука . 47 (6): 2381–9. дои : 10.1167/iovs.05-1491 . ПМЦ 1569675 . ПМИД 16723447 .
- ^ Гонсалес Э.М., Рид CC, Бикс Дж., Фу Дж., Чжан Ю., Гопалакришнан Б., Гринспен Д.С., Иоззо Р.В. (февраль 2005 г.). «BMP-1/толлоидоподобные металлопротеазы перерабатывают эндорепеллин, ангиостатический С-концевой фрагмент перлекана» . Ж. Биол. Хим . 280 (8): 7080–7. дои : 10.1074/jbc.M409841200 . ПМИД 15591058 . S2CID 35841044 .
- ^ Ода О, Синдзато Т, Обаяси К, Такаи И, Кунимацу М, Маэда К, Яманака Н (ноябрь 1996 г.). «Очистка и характеристика фрагмента перлекана в моче пациентов с терминальной стадией почечной недостаточности». Клин. Хим. Акта . 255 (2): 119–32. дои : 10.1016/0009-8981(96)06395-4 . ПМИД 8937755 .
- ^ Вуаденс Ф., Бене С., Кретас Д., Галло Д., Сапен В., Шнайдер П., Бьенвеню В.В., Лемери Д., Квадрони М., Дастюг Б., Тиссо Дж.Д. (август 2003 г.). «Идентификация биологических маркеров преждевременного разрыва плодных оболочек: протеомный подход». Протеомика . 3 (8): 1521–5. дои : 10.1002/pmic.200300455 . ПМИД 12923777 . S2CID 5868882 .
- ^ Смит С.Э., французский ММ, Джулиан Дж., Пария БК, Дей С.К., Карсон Д.Д. (апрель 1997 г.). «Экспрессия протеогликана гепарансульфата (перлекана) в бластоцистах мышей регулируется во время нормальной и отсроченной имплантации» . Дев. Биол . 184 (1): 38–47. дои : 10.1006/dbio.1997.8521 . ПМИД 9142982 .
- ^ Хэндлер М., Юрченко П.Д., Иоццо Р.В. (октябрь 1997 г.). «Эволюционная экспрессия перлекана во время мышиного эмбриогенеза» . Дев. Дин . 210 (2): 130–45. doi : 10.1002/(SICI)1097-0177(199710)210:2<130::AID-AJA6>3.0.CO;2-H . ПМИД 9337134 .
- ^ Сулинци Н., Загрис Н. (2007). «Пространственное и временное выражение перлекана в раннем курином эмбрионе». Клетки Ткани Органы (Печать) . 186 (4): 243–56. дои : 10.1159/000107948 . ПМИД 17785960 . S2CID 41008675 .
- ^ Jump up to: а б Вайзер М.К., Белкнап Дж.К., Гришабер С.С., Кинселла М.Г., Маджак Р.А. (ноябрь 1996 г.). «Регуляция развития экспрессии гена перлекана в гладкомышечных клетках аорты». Матрица Биол . 15 (5): 331–40. дои : 10.1016/S0945-053X(96)90136-5 . ПМИД 8981329 .
- ^ Jump up to: а б Белнап Дж.К., Вайзер-Эванс М.К., Гришабер С.С., Маджак Р.А., Стенмарк К.Р. (январь 1999 г.). «Связь между экспрессией генов перлекана и тропоэластина и репликацией клеток в развивающейся легочной сосудистой сети крыс». Являюсь. Дж. Респир. Клетка Мол. Биол . 20 (1): 24–34. CiteSeerX 10.1.1.327.6391 . дои : 10.1165/ajrcmb.20.1.3321 . ПМИД 9870914 .
- ^ Шей Э.Л., Грир Калифорния, Трелоар Х.Б. (июль 2008 г.). «Схемы динамической экспрессии молекул ЕСМ в развивающемся обонятельном пути мыши» . Дев. Дин . 237 (7): 1837–50. дои : 10.1002/dvdy.21595 . ПМК 2787191 . ПМИД 18570250 .
- ^ Ки Б, Трелоар Х.Б., Вангерек Л., Форд, доктор медицинских наук, Нуркомб В. (март 1996 г.). «Экспрессия и локализация FGF-1 в развивающейся обонятельной системе крыс». Дж. Комп. Нейрол . 366 (2): 197–206. doi : 10.1002/(SICI)1096-9861(19960304)366:2<197::AID-CNE1>3.0.CO;2-0 . ПМИД 8698881 . S2CID 38919059 .
- ^ Браунуэлл К.Х., Пешева П., Маккарти Дж.Б., Фурхт Л.Т., Шмитц Б., Шахнер М. (апрель 1995 г.). «Функциональное участие версикан- и декорин-подобных молекул, полученных из седалищного нерва, и других протеогликанов хондроитинсульфата в клеточной адгезии, опосредованной ЕСМ, и росте нейритов». Евро. Дж. Нейроски . 7 (4): 805–14. дои : 10.1111/j.1460-9568.1995.tb00683.x . ПМИД 7620627 . S2CID 21088798 .
- ^ Jump up to: а б Французский ММ, Смит С.Э., Аканби К., Сэнфорд Т., Хехт Дж., Фарах-Карсон М.К. , Карсон Д.Д. (май 1999 г.). «Экспрессия протеогликана гепарансульфата, перлекана, во время эмбриогенеза мышей и хондрогенная активность перлекана in vitro» . Дж. Клеточная Биол . 145 (5): 1103–15. дои : 10.1083/jcb.145.5.1103 . ПМК 2133131 . ПМИД 10352025 .
- ^ Jump up to: а б с д Костелл М., Густафссон Э., Ассоди А., Мёргелин М., Блох В., Хунцикер Э., Аддикс К., Тимпл Р., Фесслер Р. (ноябрь 1999 г.). «Перлекан сохраняет целостность хрящей и некоторых базальных мембран» . Дж. Клеточная Биол . 147 (5): 1109–22. дои : 10.1083/jcb.147.5.1109 . ПМК 2169352 . ПМИД 10579729 .
- ^ Гомес Р.Р., Джоши С.С., Фарах-Карсон MC, Карсон Д.Д. (февраль 2006 г.). «Опосредованный рибозимом нокдаун перлекана нарушает хондрогенную дифференцировку фибробластов C3H10T1/2» . Дифференциация . 74 (1): 53–63. дои : 10.1111/j.1432-0436.2005.00055.x . ПМЦ 1403289 . ПМИД 16466400 .
- ^ Браун Эй.Дж., Аликнавич М., Д'Суза СС, Дайкоку Т., Кирн-Сафран CB, Маркетти Д., Карсон Д.Д., Фарах-Карсон MC (октябрь 2008 г.). «Экспрессия и активность гепараназы влияют на хондрогенные и остеогенные процессы во время формирования эндохондральной кости» . Кость . 43 (4): 689–99. дои : 10.1016/j.bone.2008.05.022 . ПМК 2621444 . ПМИД 18589009 .
- ^ Гомес Р.Р., Ван Куппевельт Т.Х., Фарах-Карсон М.К., Карсон Д.Д. (декабрь 2006 г.). «Пространственно-временное распределение эпитопов гепарансульфата во время развития пластинки роста мышиного хряща». Гистохим. Клеточная Биол . 126 (6): 713–22. дои : 10.1007/s00418-006-0203-4 . ПМИД 16835755 . S2CID 13223192 .
- ^ Мэнтон К.Дж., Леонг Д.Ф., Кул С.М., Нуркомб В. (ноябрь 2007 г.). «Нарушение передачи сигналов гепарана и хондроитинсульфата усиливает остеогенную дифференцировку, происходящую из мезенхимальных стволовых клеток, через сигнальные пути костных морфогенетических белков» . Стволовые клетки . 25 (11): 2845–54. doi : 10.1634/stemcells.2007-0065 . ПМИД 17702986 . S2CID 24843235 .
- ^ Jump up to: а б Золлер Дж.Дж., Маккуиллан А., Уайтлок Дж., Хо С.И., Иоззо Р.В. (апрель 2008 г.). «Центральная функция перлекана в развитии скелетных мышц и сердечно-сосудистой системы» . Дж. Клеточная Биол . 181 (2): 381–94. дои : 10.1083/jcb.200708022 . ПМК 2315682 . ПМИД 18426981 .
- ^ Jump up to: а б Золлер Дж. Дж., Уайтлок Дж. М., Иоззо Р. В. (май 2009 г.). «Перлекан регулирует ангиогенез развития, модулируя ось VEGF-VEGFR2» . Матрица Биол . 28 (5): 284–91. дои : 10.1016/j.matbio.2009.04.010 . ПМК 2705690 . ПМИД 19422911 .
- ^ Хирос А., Моранте Дж., Хиль-Санс С., Файрен А., Костелл М. (2007). «Перлекан контролирует нейрогенез в развивающемся конечном мозге» . Разработчик BMC. Биол . 7:29 . дои : 10.1186/1471-213X-7-29 . ПМК 1852307 . ПМИД 17411441 .
- ^ Jump up to: а б Росси М., Морита Х., Сормунен Р., Айренн С., Крейви М., Ван Л., Фукай Н., Олсен Б.Р., Трюггвасон К., Сойнинен Р. (январь 2003 г.). «Цепи гепарансульфата перлекана незаменимы в капсуле хрусталика, но не в почках» . ЭМБО Дж . 22 (2): 236–45. дои : 10.1093/emboj/cdg019 . ПМК 140094 . ПМИД 12514129 .
- ^ Морита Х., Ёсимура А., Инуи К., Идеура Т., Ватанабэ Х., Ван Л., Сойнинен Р., Трюггвасон К. (июнь 2005 г.). «Гепарансульфат перлекана участвует в клубочковой фильтрации» . Журнал Американского общества нефрологов . 16 (6): 1703–1710. дои : 10.1681/ASN.2004050387 . ISSN 1046-6673 . ПМИД 15872080 . S2CID 29638221 .
- ^ Jump up to: а б Шринивасан Ю., Ловику Ф.Дж., Овербек П.А. (февраль 1998 г.). «Хрусталикоспецифическая экспрессия трансформирующего фактора роста бета1 у трансгенных мышей вызывает переднюю субкапсулярную катаракту» . Дж. Клин. Инвестируйте . 101 (3): 625–34. дои : 10.1172/JCI1360 . ПМК 508606 . ПМИД 9449696 .
- ^ Jump up to: а б Флюгель-Кох С., Ольманн А., Пятигорский Дж., Тамм Э.Р. (октябрь 2002 г.). «Нарушение развития переднего сегмента из-за сверхэкспрессии TGF-бета1 в глазах трансгенных мышей» . Дев. Дин . 225 (2): 111–25. дои : 10.1002/dvdy.10144 . ПМИД 12242711 . S2CID 8607827 .
- ^ Чжоу З, Ван Дж, Цао Р, Морита Х, Сойнинен Р, Чан КМ, Лю Б, Цао Ю, Трюггвасон К (июль 2004 г.). «Нарушение ангиогенеза, замедленное заживление ран и замедленный рост опухоли у мышей с дефицитом перлекана гепарансульфата» . Рак Рез . 64 (14): 4699–702. дои : 10.1158/0008-5472.CAN-04-0810 . ПМИД 15256433 . S2CID 2295597 .
- ^ Исиджима М., Сузуки Н., Ходзуми К., Мацунобу Т., Косаки К., Канеко Х., Хасселл-младший, Арикава-Хирасава Э., Ямада Ю. (май 2012 г.). «Перлекан модулирует передачу сигналов VEGF и необходим для васкуляризации при формировании эндохондральной кости» . Матричная биология . 31 (4): 234–245. дои : 10.1016/j.matbio.2012.02.006 . ISSN 0945-053X . ПМЦ 3340529 . ПМИД 22421594 .
- ^ Сюй З, Итикава Н, Косаки К, Ямада Ю, Сасаки Т, Сакаи Л.Ю, Куросава Х, Хаттори Н, Арикава-Хирасава Е (июль 2010 г.). «Дефицит перлекана вызывает мышечную гипертрофию, снижение экспрессии миостатина и изменения в составе мышечных волокон» . Матричная биология . 29 (6): 461–470. дои : 10.1016/j.matbio.2010.06.001 . ISSN 0945-053X . ПМЦ 2939214 . ПМИД 20541011 .
- ^ Гомес Р.Р., Фарах-Карсон MC, Карсон Д.Д. (2004). «Функции перлекана в хондрогенезе: данные моделей in vitro и in vivo». Клетки Ткани Органы (Печать) . 176 (1–3): 79–86. дои : 10.1159/000075029 . ПМИД 14745237 . S2CID 35356003 .
- ^ Иоззо Р.В., Пилларисетти Дж., Шарма Б., Мердок А.Д., Дэниэлсон К.Г., Уитто Дж., Мовиель А. (февраль 1997 г.). «Структурная и функциональная характеристика промотора гена перлекана человека. Активация транскрипции путем трансформации фактора роста-бета через элемент, связывающий ядерный фактор 1» . Ж. Биол. Хим . 272 (8): 5219–28. дои : 10.1074/jbc.272.8.5219 . ПМИД 9030592 . S2CID 23851324 .
- ^ Додж ГР, Ковальски I, Хасселл-младший, Иоззо Р.В. (октябрь 1990 г.). «Трансформирующий фактор роста бета изменяет экспрессию протеогликана гепарансульфата в клетках карциномы толстой кишки человека» . Ж. Биол. Хим . 265 (29): 18023–9. дои : 10.1016/S0021-9258(18)38265-6 . ПМИД 1698783 .
- ^ Моррис Дж. Э., Газа Г., Поттер С.В. (февраль 1994 г.). «Специфическая стимуляция протеогликана гепарансульфата базальной пластинки в эпителии матки мышей с помощью Matrigel и трансформирующего фактора роста-бета 1». Клетка in vitro. Дев. Биол. Аним . 30А (2): 120–8. дои : 10.1007/BF02631404 . ПМИД 8012654 . S2CID 6254328 .
- ^ Шмидт А., Лорковски С., Зайдлер Д., Брейтхардт Г., Буддеке Э. (июль 2006 г.). «TGF-beta1 генерирует специфический многокомпонентный внеклеточный матрикс в коронарной ГМК человека». Евро. Дж. Клин. Инвестируйте . 36 (7): 473–82. дои : 10.1111/j.1365-2362.2006.01658.x . ПМИД 16796604 . S2CID 8803052 .
- ^ Jump up to: а б Гарсия де Йебенес Э, Хо А, Дамани Т, Филлит Х, Блюм М (август 1999 г.). «Регуляция протеогликана гепарансульфата, перлекана путем повреждения и интерлейкина-1альфа» . Дж. Нейрохем . 73 (2): 812–20. дои : 10.1046/j.1471-4159.1999.0730812.x . ПМИД 10428080 . S2CID 14191496 .
- ^ Хасимото-Уошима М., Ногучи К., Сузуки М., Мурата А., Янагисита М., Исикава И. (февраль 2002 г.). «Влияние интерлейкина-4 на накопление протеогликана в фибробластах десен человека». Дж. Пародонт. Рез . 37 (1): 42–9. дои : 10.1034/j.1600-0765.2002.00642.x . ПМИД 11842937 .
- ^ Тафвессон Э., Вестергрен-Торссон Г. (март 2000 г.). «Изменение синтеза протеогликана в фибробластах легких человека, индуцированное интерлейкином-1бета и фактором некроза опухоли-альфа». Дж. Селл. Биохим . 77 (2): 298–309. doi : 10.1002/(SICI)1097-4644(20000501)77:2<298::AID-JCB12>3.0.CO;2-D . ПМИД 10723095 . S2CID 40207474 .
- ^ Кадзи Т., Ямамото С., О-и М., Фудзивара Ю., Ямадзаки Ю., Морита Т., Плаас А.Х., Уайт Т.Н. (сентябрь 2006 г.). «Фактор роста эндотелия сосудов VEGF165 индуцирует синтез перлекана через рецептор VEGF-2 в культивируемых микрососудистых эндотелиальных клетках головного мозга человека». Биохим. Биофиз. Акта . 1760 (9): 1465–74. дои : 10.1016/j.bbagen.2006.06.010 . ПМИД 16914267 .
- ^ Льоренте А., Придз К., Спрангерс М., Скреттинг Г., Колсет С.О., Сандвиг К. (январь 2001 г.). «Синтез протеогликана увеличивается в клетках с нарушенным клатрин-зависимым эндоцитозом». Дж. Клеточная наука . 114 (Часть 2): 335–43. дои : 10.1242/jcs.114.2.335 . ПМИД 11148135 .
- ^ Менне Дж., Парк Дж.К., Боне М., Элгер М., Линдшау С., Кирш Т., Мейер М., Гелер Ф., Фибелер А., Бахльманн Ф.Х., Лейтгес М., Халлер Х. (август 2004 г.). «Уменьшенная потеря протеогликанов и отсутствие альбуминурии у диабетических мышей с дефицитом протеинкиназы С-альфа» . Диабет . 53 (8): 2101–9. дои : 10.2337/диабет.53.8.2101 . ПМИД 15277392 .
- ^ Jump up to: а б Шарма Б., Иоццо Р.В. (февраль 1998 г.). «Транскрипционное подавление экспрессии гена перлекана гамма-интерфероном» . Ж. Биол. Хим . 273 (8): 4642–6. дои : 10.1074/jbc.273.8.4642 . ПМИД 9468523 . S2CID 24591048 .
- ^ Фонтана В., Чорен В., Воте Л., Кальво Дж.К., Кальво Л., Камео М. (декабрь 2004 г.). «Экзогенный гамма-интерферон изменяет внутреннюю клеточную массу мышей и развитие трофобласта. Влияние на экспрессию ErbB1, ErbB4 и протеогликана гепарансульфата (перлекана)» . Размножение . 128 (6): 717–25. дои : 10.1530/rep.1.00335 . ПМИД 15579589 .
- ^ Ли Ю.З., Лю С.Х., Цай Л.Р. (апрель 2007 г.). «Понижение экспрессии перлекана способствует ингибированию пролиферации эндотелиальных клеток микрососудистых сосудов сердца крыс, индуцированной гипоксией». Шэн Ли Сюэ Бао . 59 (2): 221–6. ПМИД 17437047 .
- ^ Джин К., Мао С.О., Эшу М.В., дель Рио Г., Рао Р., Чен Д., Саймон Р.П., Гринберг Д.А. (октябрь 2002 г.). «Микрочиповый анализ кДНК изменений в экспрессии генов, вызванных гипоксией нейронов in vitro». Нейрохим. Рез . 27 (10): 1105–12. дои : 10.1023/A:1020913123054 . ПМИД 12462408 . S2CID 7688503 .
- ^ Фурута Г.Т., Дзус А.Л., Тейлор К.Т., Колган С.П. (август 2000 г.). «Параллельная индукция хемокина и протеогликана, связанных с эпителиальной поверхностью, посредством клеточной гипоксии: последствия для активации нейтрофилов» . Дж. Леукок. Биол . 68 (2): 251–9. дои : 10.1189/jlb.68.2.251 . ПМИД 10947070 . S2CID 17526437 .
- ^ Сноу А.Д., Секигути Р., Ноклин Д., Фрейзер П., Кимата К., Мизутани А., Араи М., Шрайер В.А., Морган Д.Г. (январь 1994 г.). «Важная роль протеогликана гепарансульфата (Перлекана) в модельной системе отложения и сохранения фибриллярного бета-амилоида А в мозге крыс». Нейрон . 12 (1): 219–34. дои : 10.1016/0896-6273(94)90165-1 . ПМИД 8292358 . S2CID 39006966 .
- ^ Кирван Р.П., Фенерти CH, Крин Дж., Уордингер Р.Дж., Кларк А.Ф., О'Брайен СиДжей (2005). «Влияние циклического механического напряжения на экспрессию генов внеклеточного матрикса в клетках lamina cribrosa человека in vitro». Мол. Вис . 11 : 798–810. ПМИД 16205625 .
- ^ Бейкер А.Б., Эттенсон Д.С., Джонас М., Ньюджент М.А., Иоззо Р.В., Эдельман Э.Р. (август 2008 г.). «Эндотелиальные клетки обеспечивают контроль по принципу обратной связи для ремоделирования сосудов посредством механочувствительного аутокринного сигнального пути TGF-бета» . Цирк. Рез . 103 (3): 289–97. дои : 10.1161/CIRCRESAHA.108.179465 . ПМК 2766078 . ПМИД 18583708 .
- ^ Морита Н., Иизука К., Мураками Т., Кавагути Х. (июль 2004 г.). «N-концевая киназа и c-Src активируются в гладкомышечных клетках аорты человека под действием давления». Мол. Клетка. Биохим . 262 (1–2): 71–8. дои : 10.1023/B:MCBI.0000038218.09259.1c . ПМИД 15532711 . S2CID 23799480 .
- ^ Ли Р.Т., Ямамото С., Фенг Ю., Поттер-Периго С., Бриггс В.Х., Ландшульц К.Т., Тури Т.Г., Томпсон Дж.Ф., Либби П., Уайт Т.Н. (апрель 2001 г.). «Механическое напряжение вызывает специфические изменения в синтезе и организации протеогликанов гладкомышечными клетками сосудов» . Ж. Биол. Хим . 276 (17): 13847–51. дои : 10.1074/jbc.M010556200 . ПМИД 11278699 . S2CID 46310253 .
- ^ Галлай М., Ковальски И., Книттель Т., Нойбауэр К., Армбруст Т., Рамадори Г. (май 1996 г.). «Экспрессия протеогликанов внеклеточного матрикса перлекана и декорина в печени крыс, поврежденной тетрахлорметаном, и в изолированных клетках печени» . Являюсь. Дж. Патол . 148 (5): 1463–71. ПМЦ 1861584 . ПМИД 8623917 .
- ^ Козма Л.Г., Алекса И.Д., Добреску Г. (2004). «[Транскрипционный и электронно-микроскопический анализ протеогликанов внеклеточного матрикса при острой интоксикации ацетаминофеном]». Преподобный Med Chir Soc Med Nat Iasi (на румынском языке). 108 (2): 452–7. ПМИД 15688831 .
- ^ Старк Х.Дж., Баур М., Брейткройц Д., Миранча Н., Фюзениг Н.Е. (май 1999 г.). «Органотипические совместные культуры кератиноцитов в определенной среде с регулярным эпидермальным морфогенезом и дифференцировкой» . Дж. Инвест. Дерматол . 112 (5): 681–91. дои : 10.1046/j.1523-1747.1999.00573.x . ПМИД 10233757 .
- ^ Брейткройц Д., Миранча Н., Шмидт С., Бек Р., Вернер У., Старк Х.Дж., Герл М., Фюзениг Н.Е. (май 2004 г.). «Ингибирование образования базальной мембраны нидоген-связывающим фрагментом гамма1-цепи ламинина в совместных культурах кожи и органотипа человека» . Дж. Клеточная наука . 117 (Часть 12): 2611–22. дои : 10.1242/jcs.01127 . ПМИД 15159456 . S2CID 1421123 .
- ^ Рен Р., Хатчон А.Е., Го XQ, Саиди Н., Мелотти С.А., Руберти Дж.В., Зиеске Дж.Д., Тринкаус-Рэндалл В. (октябрь 2008 г.). «Первичные фибробласты роговицы человека синтезируют и откладывают протеогликаны в долговременных трехмерных культурах» . Дев. Дин . 237 (10): 2705–15. дои : 10.1002/dvdy.21606 . ПМК 3760227 . ПМИД 18624285 .
- ^ Ротенбургер М., Фёлькер В., Вишер П., Гласмахер Б., Шельд Х.Х., Дейвик М. (декабрь 2002 г.). «Ультраструктура протеогликанов в тканеинженерных сердечно-сосудистых структурах». Тканевый англ . 8 (6): 1049–56. дои : 10.1089/107632702320934146 . ПМИД 12542950 .
- ^ Оджи М., СундарРадж Н., Хасселл-младший, Тофт Р.А. (февраль 1994 г.). «Синтез базальной мембраны эпителиальными клетками роговицы человека in vitro». Инвестируйте. Офтальмол. Вис. Наука . 35 (2): 479–85. ПМИД 8112997 .
- ^ Прадхан С., Чжан С., Цзя X, Карсон Д.Д., Витт Р., Фарах-Карсон MC (апрель 2009 г.). «Пептид домена IV перлекана стимулирует сборку клеток слюнных желез in vitro» . Ткань Eng Часть A. 15 (11): 3309–20. дои : 10.1089/ten.TEA.2008.0669 . ПМК 2792055 . ПМИД 19382872 .
- ^ Коэн И.Р., Мердок А.Д., Насо М.Ф., Маркетти Д., Берд Д., Иоззо Р.В. (ноябрь 1994 г.). «Аномальная экспрессия протеогликана перлекана при метастатических меланомах». Рак Рез . 54 (22): 5771–4. ПМИД 7954396 .
- ^ Маркетти Д., Ментер Д., Джин Л., Накадзима М., Николсон Г.Л. (октябрь 1993 г.). «Влияние фактора роста нервов на инвазию клеток меланомы человека и мыши и выработку гепараназы». Межд. Дж. Рак . 55 (4): 692–9. дои : 10.1002/ijc.2910550430 . ПМИД 8407001 . S2CID 25459596 .
- ^ Дэвис Э.Дж., Блэкхолл Ф.Х., Шанкс Дж.Х., Дэвид Дж., Макгоун А.Т., Суинделл Р., Слейд Р.Дж., Мартин-Хирш П., Галлахер Дж.Т., Джейсон Дж.К. (август 2004 г.). «Распределение и клиническое значение протеогликанов гепарансульфата при раке яичников» . Клин. Рак Рез . 10 (15): 5178–86. дои : 10.1158/1078-0432.CCR-03-0103 . ПМИД 15297422 . S2CID 396257 .
- ^ Кодама Дж., Шиньо Ю., Кусумото Т., Секи Н., Накамура К., Хонго А., Хирамацу Ю. (июль 2005 г.). «Потеря экспрессии гепарансульфата в базальной мембране связана с метастазами в тазовые лимфатические узлы при инвазивном раке шейки матки». Онкол. Представитель . 14 (1): 89–92. doi : 10.3892/or.14.1.89 (неактивен 31 января 2024 г.). ПМИД 15944773 .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на январь 2024 г. ( ссылка ) - ^ Цзян X, Мультаупт Х., Чан Э, Шефер Л., Шефер Р.М., Коучман Дж.Р. (декабрь 2004 г.). «Существенный вклад перлекана, полученного из опухолей, в рост эпидермальных опухолей и ангиогенез» . Дж. Гистохим. Цитохим . 52 (12): 1575–90. дои : 10.1369/jhc.4A6353.2004 . ПМИД 15557212 . S2CID 30223615 .
- ^ Шарма Б., Хэндлер М., Эйхстеттер И., Уайтлок Дж.М., Ньюджент М.А., Иоззо Р.В. (октябрь 1998 г.). «Антисмысловое воздействие перлекана блокирует рост опухоли и ангиогенез in vivo» . Дж. Клин. Инвестируйте . 102 (8): 1599–608. дои : 10.1172/JCI3793 . ПМК 509011 . ПМИД 9788974 .
- ^ Авиезер Д., Иоззо Р.В., Нунан Д.М., Яйон А. (апрель 1997 г.). «Подавление аутокринных и паракринных функций основного фактора роста фибробластов за счет стабильной экспрессии антисмысловой кДНК перлекана» . Мол. Клетка. Биол . 17 (4): 1938–46. дои : 10.1128/MCB.17.4.1938 . ПМК 232040 . ПМИД 9121441 .
- ^ Jump up to: а б Маркизоне С., Дель Гроссо Ф., Масиелло Л., Прат М., Санти Л., Нунан Д.М. (2000). «Фенотипические изменения в клетках саркомы Капоши за счет антисмыслового восстановления перлекана». Патол. Онкол. Рез . 6 (1): 10–7. дои : 10.1007/BF03032652 . ПМИД 10749582 . S2CID 10863998 .
- ^ Матиак М., Енисей С., Грант Д.С., Шарма Б., Иоззо Р.В. (июнь 1997 г.). «Роль перлекана в подавлении роста и инвазии клеток фибросаркомы». Рак Рез . 57 (11): 2130–6. ПМИД 9187109 .
- ^ Монгиат М., Суини С.М., Сан-Антонио Дж.Д., Фу Дж., Иоззо Р.В. (февраль 2003 г.). «Эндорепеллин, новый ингибитор ангиогенеза, полученный из С-конца перлекана» . Ж. Биол. Хим . 278 (6): 4238–49. дои : 10.1074/jbc.M210445200 . ПМИД 12435733 . S2CID 21890366 .
- ^ Саворе С., Чжан С., Мьюир С., Лю Р., Вырва Дж., Шу Дж., Чжау Х.Э., Чунг Л.В., Карсон Д.Д., Фарах-Карсон MC (2005). «Нокдаун перлекана в метастатических клетках рака простаты снижает реакцию гепарин-связывающего фактора роста in vitro и рост опухоли in vivo». Клин. Эксп. Метастазирование . 22 (5): 377–90. дои : 10.1007/s10585-005-2339-3 . ПМИД 16283481 . S2CID 25142396 .
- ^ Конде-Кнапе К (2001). «Гепарансульфатпротеогликаны в экспериментальных моделях диабета: роль перлекана в осложнениях диабета». Метаб. диабета. Рез. Преподобный . 17 (6): 412–21. дои : 10.1002/dmrr.236 . ПМИД 11757076 . S2CID 24443158 .
- ^ Пилларисетти С (2000). «Липопротеиновая модуляция субэндотелиальных гепарансульфатных протеогликанов (перлекан) и атерогенность». Тенденции Кардиоваск. Мед . 10 (2): 60–5. дои : 10.1016/S1050-1738(00)00048-7 . ПМИД 11150731 .
- ^ Сегев А., Нили Н., Штраус Б.Х. (2004). «Роль перлекана в артериальном повреждении и ангиогенезе» . Кардиоваск. Рез . 63 (4): 603–10. doi : 10.1016/j.cardiores.2004.03.028 . ПМИД 15306215 .
- ^ Васти Ф., Алави М.З., Мур С. (апрель 1993 г.). «Распределение гликозаминогликанов в интиме аорты человека: изменения при атеросклерозе и сахарном диабете». Диабетология . 36 (4): 316–22. дои : 10.1007/BF00400234 . ПМИД 8477876 . S2CID 22550300 .
- ^ Фогль-Уиллис, Калифорния, Эдвардс И.Дж. (апрель 2004 г.). «Вызванные высоким содержанием глюкозы структурные изменения в протеогликане гепарансульфата, перлекане, культивируемых эндотелиальных клеток аорты человека». Биохим. Биофиз. Акта . 1672 (1): 36–45. дои : 10.1016/j.bbagen.2004.02.005 . ПМИД 15056491 .
- ^ Тамсма Дж.Т., ван ден Борн Дж., Брюйн Дж.А., Ассманн К.Дж., Венинг Дж.Дж., Берден Дж.Х., Вислендер Дж., Шрама Э., Херманс Дж., Веркамп Дж.Х. (март 1994 г.). «Экспрессия компонентов клубочкового внеклеточного матрикса при диабетической нефропатии человека: снижение содержания гепарансульфата в клубочковой базальной мембране» . Диабетология . 37 (3): 313–20. дои : 10.1007/BF00398060 . ПМИД 8174847 . S2CID 21069219 .
- ^ ван Дет Н.Ф., ван ден Борн Дж., Тамсма Дж.Т., Верхаген Н.А., Берден Дж.Х., Брёйн Дж.А., Даха М.Р., ван дер Вауде Ф.Дж. (апрель 1996 г.). «Влияние высокого уровня глюкозы на выработку гепарансульфат-протеогликана мезангиальными и эпителиальными клетками» . Почки Int . 49 (4): 1079–89. дои : 10.1038/ki.1996.157 . ПМИД 8691728 .
- ^ Олссон У., Бонджерс Г., Камехо Дж. (март 1999 г.). «Жирные кислоты модулируют состав внеклеточного матрикса в культивируемых артериальных гладкомышечных клетках человека путем изменения экспрессии генов ядерных белков протеогликана». Диабет . 48 (3): 616–22. дои : 10.2337/диабет.48.3.616 . ПМИД 10078565 .
- ^ Ямамото С., Ваката Т., Фудзивара Ю., Кадзи Т. (февраль 2005 г.). «Индукция синтеза большого протеогликана гепарансульфата, перлекана, тромбином в культивируемых клетках коронарных гладких мышц человека». Биохим. Биофиз. Акта . 1722 (1): 92–102. дои : 10.1016/j.bbagen.2004.11.017 . ПМИД 15716125 .
- ^ Симидзу-Хирота Р., Сасамура Х., Мифунэ М., Накая Х., Курода М., Хаяси М., Сарута Т. (декабрь 2001 г.). «Регуляция синтеза сосудистых протеогликанов рецепторами ангиотензина II типа 1 и типа 2» . Дж. Ам. Соц. Нефрол . 12 (12): 2609–15. дои : 10.1681/ASN.V12122609 . ПМИД 11729229 .
- ^ Хопф М., Геринг В., Манн К., Тимпл Р. (август 2001 г.). «Картирование сайтов связывания нидогенов, фибулина-2, фибронектина и гепарина с различными модулями IG перлекана». Дж. Мол. Биол . 311 (3): 529–41. дои : 10.1006/jmbi.2001.4878 . ПМИД 11493006 .
- ^ Сасаки Т., Геринг В., Пан Т.К., Чу М.Л., Тимпл Р. (декабрь 1995 г.). «Связывание мышиного и человеческого фибулина-2 с лигандами внеклеточного матрикса». Дж. Мол. Биол . 254 (5): 892–9. дои : 10.1006/jmbi.1995.0664 . ПМИД 7500359 .
- ^ Монгиат М., Тейлор К., Отто Дж., Ахо С., Уитто Дж., Уайтлок Дж. М., Иоззо Р. В. (март 2000 г.). «Белковое ядро протеогликана перлекана специфически связывается с фактором роста фибробластов-7» . Ж. Биол. Хим . 275 (10): 7095–100. дои : 10.1074/jbc.275.10.7095 . ПМИД 10702276 . S2CID 9078105 .
- ^ Монгиат М., Отто Дж., Олдершоу Р., Феррер Ф., Сато Дж.Д., Иоззо Р.В. (март 2001 г.). «Белок, связывающий фактор роста фибробластов, является новым партнером для белкового ядра перлекана» . Ж. Биол. Хим . 276 (13): 10263–71. дои : 10.1074/jbc.M011493200 . ПМИД 11148217 . S2CID 22631858 .
- ^ Смеланд С., Колсет С.О., Лион М., Норум К.Р., Бломхофф Р. (сентябрь 1997 г.). «Связывание перлекана с транстиретином in vitro» . Биохим. Дж . 326 (Часть 3) (3): 829–36. дои : 10.1042/bj3260829 . ПМЦ 1218739 . ПМИД 9307034 .
Внешние ссылки
[ редактировать ]- перлекан в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)