Морфолино

Морфолино олиго , также известный как олигомер морфолино и фосфордиамидатный олигомер морфолино ( PMO ), представляет собой тип олигомера молекулы (в просторечии ) , используемый в молекулярной биологии для модификации экспрессии генов . Его молекулярная структура содержит основания ДНК, прикрепленные к основной цепи метиленморфолиновых колец, связанных фосфордиамидатными группами. Морфолинозы блокируют доступ других молекул к небольшим (~ 25 оснований) специфическим последовательностям поверхностей спаривания оснований рибонуклеиновой кислоты (РНК). Морфолино используются в качестве исследовательских инструментов для обратной генетики путем нарушения функции генов.
В этой статье обсуждаются только антисмысловые олигомеры морфолино, которые являются аналогами нуклеиновых кислот . Слово «Морфолино» может встречаться и в других химических названиях, относящихся к химическим веществам, содержащим шестичленное морфолиновое кольцо. Чтобы избежать путаницы с другими морфолинсодержащими молекулами, при описании олигонуклеотидов «Морфолино» часто пишется как торговое название с заглавной буквы , но такое использование не является единообразным в научной литературе. Морфолиноолигомеры иногда называют PMO (от фосфородиамидатного морфолиноолигомера), особенно в медицинской литературе. Vivo-Morpholinos и PPMO представляют собой модифицированные формы Morpholinos с химическими группами, ковалентно присоединенными для облегчения проникновения в клетки.
Нокдаун гена достигается за счет снижения экспрессии определенного гена в клетке. В случае генов, кодирующих белок, это обычно приводит к уменьшению количества соответствующего белка в клетке. Снижение экспрессии генов — это метод изучения функции определенного белка; Аналогичным образом, сплайсинг определенного экзона из транскрипта РНК, кодирующего белок, может помочь определить функцию фрагмента белка, кодируемого этим экзоном, или иногда может полностью снизить активность белка. Эти молекулы были применены в исследованиях на нескольких модельных организмах , включая мышей , рыбок данио , лягушек и морских ежей . [1] Морфолинозы также могут модифицировать сплайсинг . пре-мРНК [2] или ингибировать созревание и активность микроРНК. [3] Методы нацеливания морфолинов на РНК и доставки морфолинов в клетки недавно были рассмотрены в журнальной статье. [4] и в книжном виде. [5]
Морфолины разрабатываются как фармацевтические препараты, направленные против патогенных организмов, таких как бактерии. [6] или вирусы [7] и генетические заболевания . [8] Препарат на основе морфолиноэтеплирсен от компании Sarepta Therapeutics получил ускоренное одобрение Управления по контролю за продуктами и лекарствами США в сентябре 2016 года для лечения некоторых мутаций, вызывающих мышечную дистрофию Дюшенна . [9] хотя процесс утверждения погряз в разногласиях. Другие препараты на основе морфолино — голодирсен , вилтоларсен и казимерсен (также для лечения мышечной дистрофии Дюшенна) были одобрены FDA в 2019–2021 годах. [10] [11] [12]
История
[ редактировать ]Морфолиноолигонуклеотиды были задуманы Саммертоном ( Gene Tools ) из AntiVirals Inc. (ныне Sarepta Therapeutics) и первоначально разработаны в сотрудничестве с Веллером. [13]
Структура
[ редактировать ]Морфолино — это синтетические молекулы , которые являются продуктом изменения структуры естественной нуклеиновой кислоты . [14] Обычно длиной 25 оснований, они связываются с комплементарными последовательностями РНК или одноцепочечной ДНК посредством стандартного спаривания оснований нуклеиновой кислоты . С точки зрения структуры разница между морфолино и ДНК заключается в том, что, хотя морфолино имеют стандартные основания нуклеиновой кислоты, эти основания связаны с метиленморфолиновыми кольцами , связанными через фосфордиамидатные группы, а не с фосфатами . [14] На рисунке сравниваются структуры двух изображенных там нитей: одной РНК, а другой морфолино. Замена анионных фосфатов незаряженными фосфородиамидатными группами устраняет ионизацию в обычном физиологическом диапазоне pH , поэтому морфолино в организмах или клетках представляют собой незаряженные молекулы. Весь костяк морфолино состоит из этих модифицированных субъединиц.
Функция
[ редактировать ]Морфолинозы не вызывают деградацию молекул РНК-мишени, в отличие от многих антисмысловых структурных типов (например, фосфоротиоатов , миРНК ). Вместо этого морфолино действуют путем «стерического блокирования», связываясь с целевой последовательностью внутри РНК, ингибируя молекулы, которые в противном случае могли бы взаимодействовать с РНК. [15] Морфолиноолигонуклеотиды часто используются для изучения роли специфического транскрипта мРНК в эмбрионе . Биологи, специализирующиеся на развитии, вводят морфолиноолигонуклеотиды в яйца или эмбрионы рыбок данио . [16] Африканская шпорцевая лягушка ( Xenopus ), [17] морской еж [18] и киллифиш ( F. гетероклитус ), производящие морфантные эмбрионы, или электропорация морфолиносов в цыплят. [19] эмбрионы на более поздних стадиях развития. При наличии соответствующих цитозольных систем доставки морфолино эффективны в культуре клеток . [20] [21] Vivo-Morpholinos, в которых олигонуклеотид ковалентно связан с дендримером доставки , проникает в клетки при системном введении взрослым животным или в тканевых культурах. [22]
Нормальная экспрессия генов у эукариот
[ редактировать ]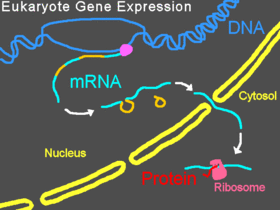
У эукариотических организмов пре-мРНК транскрибируется в ядре, интроны подвергаются сплайсингу , затем зрелая мРНК экспортируется из ядра в цитоплазму . Небольшая субъединица рибосомы обычно начинается со связывания на 5'-конце мРНК и присоединяется там к различным другим эукариотическим факторам инициации , образуя комплекс инициации. Комплекс инициации сканирует цепь мРНК до тех пор, пока не достигнет стартового кодона большая субъединица рибосомы присоединяется к малой субъединице и начинается трансляция белка , а затем . Весь этот процесс называется экспрессией генов; это процесс, посредством которого информация в гене , закодированная как последовательность оснований ДНК , преобразуется в структуру белка. Морфолино может модифицировать сплайсинг, блокировать трансляцию или блокировать другие функциональные сайты РНК в зависимости от последовательности оснований Морфолино.
Блокировка перевода
[ редактировать ]
Связанные с 5'-нетранслируемой областью информационной РНК (мРНК), морфолиносы могут препятствовать продвижению рибосомального инициационного комплекса от 5'-кэпа к стартовому кодону. Это предотвращает трансляцию кодирующей области целевого транскрипта (так называемое « нокдаун » экспрессии гена ). Это полезно экспериментально, когда исследователь хочет узнать функцию определенного белка; Морфолино представляют собой удобный способ снижения экспрессии белка и изучения того, как этот нокдаун меняет клетки или организм. Некоторые морфолино подавляют экспрессию настолько эффективно, что после деградации ранее существовавших белков целевые белки становятся необнаружимыми с помощью вестерн-блоттинга .
В 2016 году было обнаружено, что синтетический пептид-конъюгированный PMO (PPMO) ингибирует экспрессию металло-бета-лактамазы Нью-Дели , фермента, который многие устойчивые к лекарствам бактерии используют для разрушения карбапенемов. [23] [24]
Модификация сплайсинга пре-мРНК
[ редактировать ]
Морфолинозы могут вмешиваться в этапы процессинга пре-мРНК , либо предотвращая связывание комплексов малых ядерных рибонуклеопротеинов ( мяРНП ), направляющих сплайсинг, с их мишенями на границах интронов на цепи пре-мРНК, либо блокируя нуклеофильное адениновое основание и предотвращая его от формирования лариатной структуры сплайсинга или путем вмешательства в связывание регуляторных белков сплайсинга, таких как сайленсеры сплайсинга [25] и усилители сплайсинга . [26] Предотвращение связывания мяРНП U1 (в донорном сайте) или U2 / U5 (в полипиримидиновом фрагменте и акцепторном сайте) может вызвать модифицированный сплайсинг , обычно исключающий экзоны из зрелой мРНК. Нацеливание на некоторые мишени сплайсинга приводит к включениям интронов, тогда как активация загадочных сайтов сплайсинга может привести к частичным включениям или исключениям. [27] Цели мяРНП U11 / U12 также могут быть заблокированы. [28] Модификацию сплайсинга можно удобно анализировать с помощью полимеразной цепной реакции с обратной транскриптазой ( ОТ-ПЦР ) и рассматривать как сдвиг полосы после гель-электрофореза продуктов ОТ-ПЦР. [2]
Другие применения: блокировка других сайтов мРНК и использование в качестве зондов.
[ редактировать ]Морфолины использовались для блокирования микроРНК. активности [29] [30] и созревание. [3] Меченные флуоресцеином морфолино в сочетании со специфичными к флуоресцеину антителами можно использовать в качестве зондов для гибридизации in-situ с микроРНК. [31] Морфолинозы могут блокировать активность рибозимов . [32] Функции мяРНП U2 и U12 ингибируются морфолиносами. [33] Морфолиноиды, нацеленные на «скользкие» последовательности мРНК внутри кодирующих белков областей, могут вызывать сдвиги рамки трансляции . [34] Морфолинозы могут блокировать редактирование РНК, [35] хвостохранилище поли-А [36] и транслокационные последовательности. [37] Активность морфолино против этого множества мишеней позволяет предположить, что морфолино можно использовать в качестве универсального инструмента для блокирования взаимодействий белков или нуклеиновых кислот с мРНК.
Специфичность, стабильность и неантисмысловые эффекты
[ редактировать ]Морфолинозы стали стандартным инструментом нокдауна в эмбриональных системах животных, которые имеют более широкий диапазон экспрессии генов, чем взрослые клетки , и на которые могут сильно влиять нецелевые взаимодействия. После первоначальных инъекций в эмбрионы лягушек или рыб на одноклеточной или малоклеточной стадии эффекты Морфолино можно измерить спустя пять дней. [38] после того, как большая часть процессов органогенеза и дифференцировки прошла, с наблюдаемыми фенотипами, соответствующими нокдауну гена-мишени. Контрольные олигонуклеотиды с нерелевантными последовательностями обычно не вызывают изменений в эмбриональном фенотипе, что свидетельствует о специфичности последовательностей морфолиноолигонуклеотидов и отсутствии неантисмысловых эффектов. Доза, необходимая для нокдауна, может быть уменьшена путем совместной инъекции нескольких олигонуклеотидов морфолино, нацеленных на одну и ту же мРНК, что является эффективной стратегией уменьшения или устранения дозозависимых взаимодействий нецелевых РНК. [39]
Эксперименты по спасению мРНК иногда могут восстановить фенотип дикого типа эмбрионам и предоставить доказательства специфичности морфолино. При спасении мРНК морфолино вводят совместно с мРНК, которая кодирует белок морфино. Однако спасательная мРНК имеет модифицированную 5'-UTR (нетранслируемую область), так что спасательная мРНК не содержит мишени для морфолино. спасательной мРНК Кодирующая область кодирует интересующий белок. Трансляция спасательной мРНК заменяет продукцию белка, разрушенного морфолином. Поскольку спасательная мРНК не будет влиять на фенотипические изменения из-за модуляции экспрессии нецелевых генов Morpholino, этот возврат к фенотипу дикого типа является дополнительным доказательством специфичности Morpholino. [38] В некоторых случаях эктопическая экспрессия спасательной РНК делает невозможным восстановление фенотипа дикого типа.
У эмбрионов Morpholinos можно протестировать на нулевых мутантах для проверки неожиданных взаимодействий РНК, а затем использовать на эмбрионах дикого типа для выявления фенотипа острого нокдауна. Нокдаун-фенотип часто бывает более радикальным, чем мутантный фенотип; у мутанта последствия потери нулевого гена могут быть скрыты за счет генетической компенсации. [40]
Из-за совершенно неестественного скелета морфолино не распознаются клеточными белками. Нуклеазы не разрушают морфолино. [41] они также не разлагаются в сыворотке или клетках. [42]
До 18% Morpholinos, по-видимому, индуцируют нецелевые фенотипы, включая гибель клеток в центральной нервной системе и сомитных тканях эмбрионов рыбок данио. [43] Большинство этих эффектов обусловлено активацией p53 -опосредованного апоптоза и может быть подавлено путем совместной инъекции морфолино против p53 вместе с экспериментальным морфолином. Более того, p53-опосредованный апоптозный эффект нокдауна морфолино был фенокопирован с использованием другого антисмыслового структурного типа, показывая, что p53-опосредованный апоптоз является следствием потери целевого белка, а не следствием нокдауна олиготипа. [44] Похоже, что эти эффекты специфичны для последовательности; как и в большинстве случаев, если Морфолино связано с нецелевыми эффектами, Морфолино с несоответствием в 4 основания не вызовет эти эффекты.
Поводом для беспокойства при использовании морфолиносов является возможность возникновения «нецелевых» эффектов. Является ли наблюдаемый фенотип морфанта следствием предполагаемого нокдауна или взаимодействия с нецелевой РНК, часто можно выяснить на эмбрионах, проведя еще один эксперимент, чтобы подтвердить, что наблюдаемый морфантный фенотип является результатом нокдауна ожидаемой мишени. Это можно сделать путем повторения фенотипа морфанта с помощью второго, неперекрывающегося морфолино, нацеленного на ту же мРНК. [38] путем подтверждения наблюдаемых фенотипов путем сравнения с мутантным штаммом (хотя компенсация будет скрывать фенотип у некоторых мутантов), путем тестирования морфолино на нулевом мутантном фоне для обнаружения дополнительных фенотипических изменений или с помощью доминантно-негативных методов. Как упоминалось выше, спасение наблюдаемых фенотипов путем совместной инъекции спасательной мРНК является, когда это возможно, надежным тестом специфичности морфолино. [38] [40]
Доставка
[ редактировать ]Чтобы морфолино было эффективным, оно должно пройти через клеточную мембрану в цитозоль клетки. Оказавшись в цитозоле, морфолино свободно диффундируют между цитозолем и ядром, о чем свидетельствует активность морфолино по модификации ядерного сплайсинга, наблюдаемая после микроинъекции в цитозоль клеток. Для доставки в эмбрионы, в культивируемые клетки или взрослым животным используются разные методы. Для доставки в эмбрион обычно используется аппарат для микроинъекций , при этом инъекции чаще всего выполняются на одноклеточной или малоклеточной стадии; [45] альтернативным методом доставки эмбрионов является электропорация , которая может доставлять олигонуклеотиды в ткани более поздних эмбриональных стадий. [46] Общие методы доставки в культивируемые клетки включают пептид Endo-Porter (который вызывает высвобождение морфолино из эндосом ), [21] система специальной доставки (больше не имеется в продаже, использовался гетеродуплекс морфолино-ДНК и реагент для доставки этоксилированного полиэтиленимина ), [20] электропорация, [47] или скребковая загрузка. [48]
Доставка во взрослые ткани обычно затруднена, хотя существует несколько систем, позволяющих эффективно поглощать немодифицированные морфолиноолигонуклеотиды (включая поглощение в мышечные клетки при мышечной дистрофии Дюшенна). [49] или эндотелиальные клетки сосудов, подвергшиеся стрессу во время баллонной ангиопластики [50] ). Хотя они эффективно проникают через межклеточные пространства в тканях, неконъюгированные ПМО имеют ограниченное распространение в цитозоле и ядерном пространстве здоровых тканей после внутривенного введения. Системную доставку во многие клетки взрослых организмов можно осуществить с помощью ковалентных конъюгатов морфолиноолигонуклеотидов с проникающими в клетку пептидами , и, хотя токсичность связана с умеренными дозами пептидных конъюгатов, [51] [52] их использовали in vivo для эффективной доставки олигонуклеотидов в дозах ниже тех, которые вызывают наблюдаемую токсичность. [7] [53] Окта-гуанидиновый дендример, прикрепленный к концу морфолино, может доставлять модифицированный олигонуклеотид (называемый виво-морфолино) из крови в цитозоль. [22] [54] Морфолиноиды с возможностью доставки, такие как пептидные конъюгаты и Vivo-морфолино, перспективны в качестве средств лечения вирусных и генетических заболеваний. [55]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Хисман Дж. (март 2002 г.). «Морфолиноолиго: в чем смысл антисмысла?» . Биология развития . 243 (2): 209–14. дои : 10.1006/dbio.2001.0565 . ПМИД 11884031 .
- ^ Перейти обратно: а б Дрейпер Б.В., Моркос, Пенсильвания, Киммел CB (июль 2001 г.). «Ингибирование сплайсинга пре-мРНК рыбки данио fgf8 с морфолиноолигонуклеотидами: количественный метод нокдауна гена» . Бытие . 30 (3): 154–6. дои : 10.1002/gen.1053 . ПМИД 11477696 .
- ^ Перейти обратно: а б Клоостерман В.П., Лагендейк А.К., Кеттинг Р.Ф., Моултон Дж.Д., Пластерк Р.Х. (август 2007 г.). «Направленное ингибирование созревания миРНК с помощью морфолино раскрывает роль миР-375 в развитии островков поджелудочной железы» . ПЛОС Биология . 5 (8): е203. doi : 10.1371/journal.pbio.0050203 . ЧВК 1925136 . ПМИД 17676975 . (В настоящее время в этом документе выражается обеспокоенность , см. дои : 10.1371/journal.pbio.3001631 , ПМИД 35486652 )
- ^ Моултон Джей Ди (2016). «Руководство для пользователей морфолино: на пути к терапии» (PDF) . J Drug Discov Develop and Deliv . 3 (2): 1023.
- ^ Моултон Х.М., Моултон Дж.Д., ред. (2017). Морфолиноолигомеры . Методы молекулярной биологии. Том. 1565. Humana Press (Спрингер). п. 284. дои : 10.1007/978-1-4939-6817-6 . ISBN 978-1-4939-6815-2 . S2CID 28338321 .
- ^ Геллер Б.Л. (апрель 2005 г.). «Антибактериальный антисмысл». Современное мнение о молекулярной терапии . 7 (2): 109–13. ПМИД 15844617 .
- ^ Перейти обратно: а б Деас Т.С., Беннетт С.Дж., Джонс С.А., Тилгнер М., Рен П., Бер М.Дж., Штейн Д.А., Иверсен П.Л., Крамер Л.Д., Бернард К.А., Ши П.Ю. (июль 2007 г.). «Отбор устойчивости in vitro и эффективность морфолиноолигомеров in vivo против вируса Западного Нила» . Антимикробные средства и химиотерапия . 51 (7): 2470–82. дои : 10.1128/AAC.00069-07 . ЧВК 1913242 . ПМИД 17485503 .
- ^ МакКлори Дж., Фолл А.М., Моултон Х.М., Иверсен П.Л., Раско Дж.Е., Райан М., Флетчер С., Уилтон С.Д. (октябрь 2006 г.). «Индуцированный пропуск экзонов дистрофина в мышечных эксплантатах человека». Нервно-мышечные расстройства . 16 (9–10): 583–90. дои : 10.1016/j.nmd.2006.05.017 . ПМИД 16919955 . S2CID 21338534 .
- ^ «Сообщения для прессы – FDA предоставляет ускоренное одобрение первому препарату для лечения мышечной дистрофии Дюшенна» . Управление по контролю за продуктами и лекарствами . 2019-09-10.
- ^ Комиссар Управления (12 декабря 2019 г.). «FDA предоставляет ускоренное одобрение первому таргетному лечению редкой мутации мышечной дистрофии Дюшенна» . FDA . Проверено 14 декабря 2019 г.
- ^ Рошми, Р.Р.; Ёкота, Т. (октябрь 2019 г.). «Вилтоларсен для лечения мышечной дистрофии Дюшенна» . Наркотики сегодня . 55 (10): 627–639. дои : 10.1358/точка.2019.55.10.3045038 . ISSN 1699-3993 . ПМИД 31720560 . S2CID 207935659 .
- ^ Ширли, Мэтт (май 2021 г.). «Казимерсен: Первое одобрение» . Наркотики . 81 (7): 875–879. дои : 10.1007/s40265-021-01512-2 . ISSN 1179-1950 . ПМИД 33861387 . S2CID 233248050 .
- ^ Саммертон Дж. Э. (2017). «Изобретение и ранняя история морфолино: от несбыточной мечты к практическим продуктам». Морфолиноолигомеры . Методы молекулярной биологии. Том. 1565. Humana Press (Спрингер). стр. 1–15. дои : 10.1007/978-1-4939-6817-6_1 . ISBN 978-1-4939-6817-6 . ПМИД 28364229 .
- ^ Перейти обратно: а б Саммертон Дж., Веллер Д. (июнь 1997 г.). «Морфолиновые антисмысловые олигомеры: дизайн, получение и свойства». Разработка лекарств на основе антисмысловых и нуклеиновых кислот . 7 (3): 187–95. дои : 10.1089/oli.1.1997.7.187 . ПМИД 9212909 . S2CID 19372403 .
- ^ Саммертон Дж (декабрь 1999 г.). «Морфолино-антисмысловые олигомеры: случай структурного типа, независимого от РНКазы H». Biochimica et Biophysical Acta (BBA) – Структура и экспрессия генов . 1489 (1): 141–58. дои : 10.1016/S0167-4781(99)00150-5 . ПМИД 10807004 .
- ^ Назявичюс А., Эккер С.С. (октябрь 2000 г.). «Эффективный целевой «нокдаун» гена у рыбок данио». Природная генетика . 26 (2): 216–20. дои : 10.1038/79951 . ПМИД 11017081 . S2CID 21451111 .
- ^ Хисман Дж., Кофрон М., Уайли С. (июнь 2000 г.). «Сигнальная активность бета-катенина, анализируемая у ранних эмбрионов Xenopus: новый антисмысловой подход» . Биология развития . 222 (1): 124–34. дои : 10.1006/dbio.2000.9720 . ПМИД 10885751 .
- ^ Ховард Э.В., Ньюман Л.А., Олексин Д.В., Ангерер Р.К., Ангерер Л.М. (февраль 2001 г.). «SpKrl: прямая мишень регуляции бета-катенина, необходимая для дифференцировки эндодермы у эмбрионов морских ежей». Разработка . 128 (3): 365–75. дои : 10.1242/dev.128.3.365 . ПМИД 11152635 .
- ^ Кос Р., Риди М.В., Джонсон Р.Л., Эриксон Калифорния (апрель 2001 г.). «Фактор транскрипции крылатой спирали FoxD3 важен для установления линии нервного гребня и подавления меланогенеза у птичьих эмбрионов». Разработка . 128 (8): 1467–79. дои : 10.1242/dev.128.8.1467 . ПМИД 11262245 .
- ^ Перейти обратно: а б Моркос, Пенсильвания (июль 2001 г.). «Достижение эффективной доставки морфолиноолигонуклеотидов в культивируемые клетки». Бытие . 30 (3): 94–102. дои : 10.1002/gen.1039 . ПМИД 11477682 .
- ^ Перейти обратно: а б Саммертон Дж. Э. (ноябрь 2005 г.). «Эндо-Портер: новый реагент для безопасной и эффективной доставки веществ в клетки». Анналы Нью-Йоркской академии наук . 1058 (1): 62–75. Бибкод : 2005NYASA1058...62S . дои : 10.1196/анналы.1359.012 . ПМИД 16394126 . S2CID 28590429 .
- ^ Перейти обратно: а б Моркос П.А., Ли Ю, Цзян С. (декабрь 2008 г.). «Vivo-Morpholinos: непептидный переносчик доставляет морфолино в широкий спектр тканей мыши» . БиоТехники . 45 (6): 613–4, 616, 618 пассим. дои : 10.2144/000113005 . ПМИД 19238792 .
- ^ «Новая молекула убивает иммунитет супербактерий к антибиотикам» . newatlas.com . 20 января 2017 г. Проверено 25 января 2017 г.
- ^ Салли Э.К., Геллер Б.Л., Ли Л., Муди СМ, Бейли С.М., Мур А.Л., Вонг М., Нордманн П., Дейли С.М., Стердж Ч.Р., Гринберг Д.Э. (март 2017 г.). «Пептид-конъюгированный фосфородиамидат-морфолиноолигомер (PPMO) восстанавливает чувствительность к карбапенемам к NDM-1-положительным патогенам in vitro и in vivo» . Журнал антимикробной химиотерапии . 72 (3): 782–790. дои : 10.1093/jac/dkw476 . ПМК 5890718 . ПМИД 27999041 .
- ^ Бруно И.Г., Джин В., Кот Дж.Дж. (октябрь 2004 г.). «Коррекция аберрантного сплайсинга альтернативной РНК FGFR1 путем нацеливания на интронные регуляторные элементы» . Молекулярная генетика человека . 13 (20): 2409–20. дои : 10.1093/hmg/ddh272 . ПМИД 15333583 .
- ^ Ветрини Ф, Таммаро Р, Бонданса С, Сурасе Э.М., Ауриккио А, Де Лука М, Баллабио А, Мариго В (май 2006 г.). «Аберрантный сплайсинг в гене глазного альбинизма типа 1 (OA1/GPR143) корректируется in vitro с помощью морфолино-антисмысловых олигонуклеотидов» . Человеческая мутация . 27 (5): 420–6. дои : 10.1002/humu.20303 . ПМИД 16550551 . S2CID 21092974 .
- ^ Моркос, Пенсильвания (июнь 2007 г.). «Достижение целевого и поддающегося количественной оценке изменения сплайсинга мРНК с олигонуклеотидами морфолино». Связь с биохимическими и биофизическими исследованиями . 358 (2): 521–7. дои : 10.1016/j.bbrc.2007.04.172 . ПМИД 17493584 .
- ^ Кениг Х., Маттер Н., Бадер Р., Тиле В., Мюллер Ф. (ноябрь 2007 г.). «Сегрегация сплайсинга: второстепенная сплайсосома действует вне ядра и контролирует пролиферацию клеток» . Клетка . 131 (4): 718–29. дои : 10.1016/j.cell.2007.09.043 . ПМИД 18022366 .
- ^ Клоостерман В.П., Винхольдс Э., Кеттинг Р.Ф., Пластерк Р.Х. (2004). «Требования к субстрату для функционирования let-7 в развивающемся эмбрионе рыбки данио» . Исследования нуклеиновых кислот . 32 (21): 6284–91. дои : 10.1093/nar/gkh968 . ПМК 535676 . ПМИД 15585662 .
- ^ Флинт А.С., Ли Н., Тэтчер Э.Дж., Солника-Крезель Л., Паттон Дж.Г. (февраль 2007 г.). «МиР-214 рыбки данио модулирует передачу сигналов Hedgehog, чтобы определить судьбу мышечных клеток» . Природная генетика . 39 (2): 259–63. дои : 10.1038/ng1953 . ПМЦ 3982799 . ПМИД 17220889 .
- ^ Лагендейк А.К., Моултон Дж.Д., Баккерс Дж. (июнь 2012 г.). «Показательные подробности: протокол гибридизации in situ микроРНК целиком для эмбрионов и взрослых тканей рыбок данио» . Биология Открытая . 1 (6): 566–9. дои : 10.1242/bio.2012810 . ПМК 3509442 . ПМИД 23213449 .
- ^ Йен Л., Свендсен Дж., Ли Дж.С., Грей Дж.Т., Магнье М., Баба Т., Д'Амато Р.Дж., Маллиган Р.К. (сентябрь 2004 г.). «Экзогенный контроль экспрессии генов млекопитающих посредством модуляции саморасщепления РНК». Природа . 431 (7007): 471–6. Бибкод : 2004Natur.431..471Y . дои : 10.1038/nature02844 . ПМИД 15386015 . S2CID 4425795 .
- ^ Материя Н, Кениг Х (февраль 2005 г.). «Направленное «нокдаун» функции сплайсосом в клетках млекопитающих» . Исследования нуклеиновых кислот . 33 (4): е41. дои : 10.1093/nar/gni041 . ПМК 549580 . ПМИД 15731334 .
- ^ Ховард М.Т., Гестеланд РФ, Аткинс Дж.Ф. (октябрь 2004 г.). «Эффективная стимуляция сайт-специфического сдвига рамки рибосомы антисмысловыми олигонуклеотидами» . РНК . 10 (10): 1653–61. дои : 10.1261/rna.7810204 . ПМК 1370650 . ПМИД 15383681 .
- ^ Пенн А.С., Балик А., Грегер И.Х. (январь 2013 г.). «Стерическое антисмысловое ингибирование редактирования Q/R рецептора AMPA обнаруживает тесную связь с сайтами редактирования интронов и сплайсингом» . Исследования нуклеиновых кислот . 41 (2): 1113–23. дои : 10.1093/nar/gks1044 . ПМЦ 3553965 . ПМИД 23172291 .
- ^ Ворлова С., Рокко Г., Лефав К.В., Йоделка Ф.М., Хесс К., Гастингс М.Л., Хенке Э., Картени Л. (сентябрь 2011 г.). «Индукция тирозинкиназ антагонистических растворимых рецепторов-ловушек путем активации интронной полиА» . Молекулярная клетка . 43 (6): 927–39. doi : 10.1016/j.molcel.2011.08.009 . ПМК 3781938 . ПМИД 21925381 .
- ^ Артур П.К., Клауссен М., Кох С., Тарбашевич К., Ян О., Пилер Т. (июль 2009 г.). «Участие белков типа Xenopus Elr в локализации вегетативной мРНК во время оогенеза» . Журнал биологической химии . 284 (30): 19982–92. дои : 10.1074/jbc.M109.009928 . ПМК 2740424 . ПМИД 19458392 .
- ^ Перейти обратно: а б с д Билл Б.Р., Петцольд А.М., Кларк К.Дж., Шимменти Л.А., Эккер С.С. (март 2009 г.). «Праймер для использования морфолино у рыбок данио» . Рыбка данио . 6 (1): 69–77. дои : 10.1089/zeb.2008.0555 . ПМК 2776066 . ПМИД 19374550 .
- ^ Камачи Ю., Окуда Ю., Кондо Х. (январь 2008 г.). «Количественная оценка эффективности нокдауна морфолино-антисмысловых олигонуклеотидов в эмбрионах рыбок данио с использованием анализа люциферазы». Бытие . 46 (1): 1–7. дои : 10.1002/dvg.20361 . ПМИД 18196596 .
- ^ Перейти обратно: а б Стейнер Д.Ю., Раз Э., Лоусон Н.Д., Эккер С.С., Бурдин Р.Д., Эйзен Дж.С., Ингхэм П.В., Шульте-Меркер С., Йелон Д., Вайнштейн Б.М., Маллинз М.С., Уилсон С.В., Рамакришнан Л., Амахер С.Л., Нойхаусс С.С., Менг А., Мотидзуки Н., Панула П., Моенс CB (октябрь 2017 г.). «Руководство по использованию морфолино у рыбок данио» . ПЛОС Генетика . 13 (10): е1007000. дои : 10.1371/journal.pgen.1007000 . ПМК 5648102 . ПМИД 29049395 .
- ^ Худзяк Р.М., Барофски Э., Барофски Д.Ф., Веллер Д.Л., Хуанг С.Б., Веллер Д.Д. (1996). «Устойчивость морфолинофосфородиамидатных олигомеров к ферментативному расщеплению». Разработка лекарств на основе антисмысловых и нуклеиновых кислот . 6 (4): 267–72. дои : 10.1089/oli.1.1996.6.267 . ПМИД 9012862 .
- ^ Янгблад Д.С., Хатлевиг С.А., Хассингер Дж.Н., Иверсен П.Л., Моултон Х.М. (2007). «Стабильность проникающих в клетку конъюгатов пептид-морфолиноолигомер в сыворотке человека и в клетках». Биоконъюгатная химия . 18 (1): 50–60. дои : 10.1021/bc060138s . ПМИД 17226957 .
- ^ Эккер С.С., Ларсон Дж.Д. (июль 2001 г.). «Морфантная технология в системах разработки моделей» . Бытие . 30 (3): 89–93. дои : 10.1002/gen.1038 . ПМИД 11477681 .
- ^ Робу М.Э., Ларсон Дж.Д., Назевичиус А., Бейраги С., Бреннер С., Фарбер С.А., Эккер С.С. (май 2007 г.). «Активация р53 нокдаун-технологиями» . ПЛОС Генетика . 3 (5): е78. дои : 10.1371/journal.pgen.0030078 . ПМЦ 1877875 . ПМИД 17530925 .
- ^ Розен Дж. Н., Суини М. Ф., Мабли Дж. Д. (март 2009 г.). «Микроинъекция эмбрионов рыбок данио для анализа функции генов» . Журнал визуализированных экспериментов . 9 (25). дои : 10.3791/1115 . ПМЦ 2762901 . ПМИД 19274045 .
- ^ Серда Г.А., Томас Дж.Э., Альенде М.Л., Карлстрем Р.О., Пальма В. (июль 2006 г.). «Электропорация ДНК, РНК и морфолино в эмбрионы рыбок данио». Методы . 39 (3): 207–11. дои : 10.1016/j.ymeth.2005.12.009 . hdl : 10533/178089 . ПМИД 16837210 .
- ^ Джубин Р. (2004). «Оптимизация условий электропорации для внутриклеточной доставки морфолино-антисмысловых олигонуклеотидов, направленных против внутреннего места входа в рибосому вируса гепатита С». Антисмысловая терапия . Том. 106. С. 309–22. дои : 10.1385/1-59259-854-4:309 . ISBN 978-1-59259-854-0 . PMID 15375324 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Партридж М., Винсент А., Мэтьюз П., Пума Дж., Стейн Д., Саммертон Дж. (1996). «Простой метод доставки морфолино-антсмысловых олигонуклеотидов в цитоплазму клеток». Разработка лекарств на основе антисмысловых и нуклеиновых кислот . 6 (3): 169–75. дои : 10.1089/oli.1.1996.6.169 . ПМИД 8915501 . S2CID 8161222 .
- ^ Флетчер С., Ханиман К., Фолл А.М., Хардинг П.Л., Джонсен Р.Д., Уилтон С.Д. (февраль 2006 г.). «Экспрессия дистрофина у мышей mdx после локализованного и системного введения морфолино-антисмыслового олигонуклеотида». Журнал генной медицины . 8 (2): 207–16. дои : 10.1002/jgm.838 . ПМИД 16285002 . S2CID 42463260 .
- ^ Кипшидзе Н.Н., Ким Х.С., Иверсен П., Язди Х.А., Бхаргава Б., Нью Дж., Мехран Р., Тио Ф., Хауденшильд С., Дангас Г., Стоун Г.В., Айер С., Рубин Г.С., Леон М.Б., Мозес Дж.В. (май 2002 г.). «Интрамуральная коронарная доставка современных антисмысловых олигонуклеотидов снижает образование неоинтимы в модели рестеноза свиного стента» . Журнал Американского колледжа кардиологов . 39 (10): 1686–91. дои : 10.1016/S0735-1097(02)01830-2 . ПМИД 12020498 .
- ^ Абс С., Моултон Х.М., Клер П., Превот П., Янгблад Д.С., Ву Р.П., Иверсен П.Л., Лебле Б. (декабрь 2006 г.). «Векторизация олигомеров морфолино с помощью пептида (R-Ahx-R)4 позволяет эффективно корректировать сплайсинг в отсутствие эндосомолитических агентов». Журнал контролируемого выпуска . 116 (3): 304–13. дои : 10.1016/j.jconrel.2006.09.011 . ПМИД 17097177 .
- ^ Беррер Р., Нойман Б.В., Тинг Дж.П., Штейн Д.А., Моултон Х.М., Иверсен П.Л., Кун П., Бухмайер М.Дж. (июнь 2007 г.). «Противовирусные эффекты антисмысловых морфолиноолигомеров на моделях мышиной коронавирусной инфекции» . Журнал вирусологии . 81 (11): 5637–48. дои : 10.1128/JVI.02360-06 . ПМК 1900280 . ПМИД 17344287 .
- ^ Амантана А., Моултон Х.М., Кейт М.Л., Редди М.Т., Уайтхед Т., Хассингер Дж.Н., Янгблад Д.С., Иверсен П.Л. (2007). «Фармакокинетика, биораспределение, стабильность и токсичность конъюгата проникающего в клетку пептида и морфолиноолигомера». Биоконъюгатная химия . 18 (4): 1325–31. дои : 10.1021/bc070060v . ПМИД 17583927 .
- ^ Ли Ю.Ф., Моркос, Пенсильвания (июль 2008 г.). «Разработка и синтез дендритного молекулярного переносчика, обеспечивающего эффективную доставку антисмысловых олигоморфолино in vivo». Биоконъюгатная химия . 19 (7): 1464–70. дои : 10.1021/bc8001437 . ПМИД 18564870 .
- ^ Моултон Дж. Д., Цзян С. (март 2009 г.). «Нокдауны генов у взрослых животных: PPMO и vivo-морфолино» . Молекулы . 14 (3): 1304–23. дои : 10.3390/molecules14031304 . ПМК 6253989 . ПМИД 19325525 .
Дальнейшее чтение
[ редактировать ]- Специальный выпуск Wiley-Liss, Inc.: Нокдауны генов морфолино в генезисе, том 30, выпуск 3, страницы 89–200 (июль 2001 г.) . Это специальный выпуск журнала Genesis , который состоит из серии рецензируемых коротких статей, использующих морфолино-нокдаун функции генов в различных системах культур животных и тканей.
- «Пептидные нуклеиновые кислоты, морфолины и родственные антисмысловые биомолекулы». ред. Янсон и Во время (Спрингер, 2007)
- Моултон Дж (2007). «Использование морфолиносов для контроля экспрессии генов (раздел 4.30)». В Бокаже С. (ред.). Современные протоколы химии нуклеиновых кислот . John Wiley & Sons, Inc. Нью-Джерси: ISBN 978-0-471-24662-6 .