Этеплирсен
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Экзондис 51 |
| Другие имена | АВИ-4658 |
| Данные лицензии |
|
| Маршруты администрация | Внутривенная инфузия |
| Класс препарата | Антисмысловой олигонуклеотид |
| код АТС | |
| Юридический статус | |
| Юридический статус |
|
| Идентификаторы | |
| Номер CAS | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ХЭМБЛ | |
| Химические и физические данные | |
| Формула | С 364 Ч 569 Н 177 О 122 П 30 |
| Молярная масса | 10 305 .886 g·mol −1 |
Этеплирсен (торговая марка Exondys 51 ) представляет собой препарат для лечения, но не лечения некоторых типов мышечной дистрофии Дюшенна (МДД), вызванной специфической мутацией. Этеплирсен воздействует только на определенные мутации и может использоваться для лечения около 14% случаев МДД. [1] [2] Этеплирсен представляет собой форму антисмысловой терапии .
Этеплирсен был разработан Стивом Уилтоном, Сью Флетчер и их коллегами из Университета Западной Австралии и коммерциализирован компанией Sarepta Therapeutics . [3] После спорных дебатов вокруг эффективности препарата, в ходе которых два члена экспертной комиссии FDA подали в отставку в знак протеста, в конце 2016 года этеплирсен получил ускоренное одобрение Управления по контролю за продуктами и лекарствами США. [4] [5] Комитет по лекарственным препаратам для использования человеком (CHMP) Европейского агентства по лекарственным средствам (EMA) отказался разрешить использование этеплирсена. [6]
Побочные эффекты
[ редактировать ]Следующие нежелательные явления наблюдались как минимум у 10% людей, получавших этеплирсен в исследованиях: рвота , ушиб , раздражение , артралгия , сыпь , боль в месте катетера и инфекция верхних дыхательных путей . [7]
Механизм действия
[ редактировать ]Мышечная дистрофия Дюшенна возникает, когда мутация в DMD гене DMD изменяет мРНК так, что она больше не кодирует функциональный дистрофин белок , обычно из-за нонсенс-мутации преждевременный стоп-кодон . , которая вводит в мРНК [ нужна ссылка ] Если экзон с соответствующим количеством оснований находится рядом с мутацией, путем удаления дефектного экзона можно исправить нижнюю рамку считывания и восстановить выработку частично функционального дистрофина. [ нужна ссылка ] Это общая стратегия, используемая для создания с пропуском экзонов олигонуклеотидов для МДД; транскрипта дистрофина транскрибируется 79 экзонов поскольку в самой длинной форме сплайсинга , необходимо множество различных олигонуклеотидов для устранения диапазона мутаций, присутствующих в популяции людей с МДД. [ нужна ссылка ]
Этеплирсен представляет собой олигомер морфолино антисмысловой , который запускает удаление экзона 51 во время сплайсинга пре-мРНК транскрипта РНК дистрофина. Пропуск экзона 51 изменяет нижнюю рамку считывания дистрофина; [8] введение этеплирсена здоровому человеку приведет к выработке мРНК дистрофина, которая не кодирует функциональный белок дистрофина, но для пациентов с МДД с особыми нонсенс-мутациями введение этеплирсена может восстановить рамку считывания мРНК дистрофина и привести к выработке функционального (хотя модифицирован за счет внутренней делеции, состоящей как из исходного дефекта пациента, так и из терапевтически пропущенного экзона дистрофина. [9] Этеплирсен вводится внутривенно для системного лечения МДД.
Пропуск экзона индуцируется этеплирсеном, фосфородиамидатным морфолиноолигомером с нейтральным зарядом (PMO), который избирательно связывается с экзоном 51 пре-мРНК дистрофина, восстанавливая фазу рамки считывания и позволяя производить функциональный, но внутренне отредактированный дистрофин. [10] Незаряженная природа PMO помогает сделать его устойчивым к биологическому разложению. [11] Этот модифицированный белок дистрофин, продуцируемый этеплирсеном, может вызывать менее тяжелую форму дистрофинопатии, очень похожую на мышечную дистрофию Беккера. Предложенный Этеплирсеном механизм действия заключается в связывании пре-мРНК дистрофина и изменении сплайсинга экзонов РНК так, что образуется более почти полноразмерный дистрофин. Целью увеличения количества аномального, но потенциально функционального белка дистрофина является замедление или предотвращение прогрессирования МДД. [10] [12]
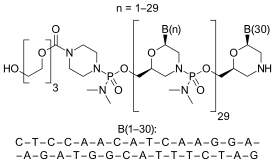
Природа и последовательность олигонуклеотида и мишени
[ редактировать ]Этеплирсен представляет собой антисмысловой олигомер морфолино-фосфородиамидата.
CTCCAACATCAAGGAAGATGGCATTTCTAG (источник последовательности: FDA США ETEPLIRSEN BRIEFING DOCUMENT NDA 206488) [10] ),
30+,
20% Г,
43% компьютерной графики,
Прогнозируемая Tm: 88,9 °C при 10 мкМ олиго.
ОлигодополнениеCTAGAAATGCCATCTTCCTTGATGTTGGAG
DMD-001 Экзон 51, ENST00000357033.8 на Ensembl.org, отмечен целевой сайт РНК. Учитывая, что целевой сайт находится внутри экзона, это, вероятно, блокирует связывание экзонного белка-энхансера сплайсинга и, таким образом, изменяет сплайсинг, препятствуя регуляции сплайсинга.CTCCTACTCAGACTGTTACTCTGGTGACACAACCTGTGGTTACTAAGGAAACTGCCATCTCCAAA[ CTAGAAATGCCATCTTCCTTGATGTTGGAG ]GTACCTGCTCTGGCAGATTTCAACCGGGCTTGGACAGAACTTACCGACTGGCTTTCTCTGCTTGATCAAGTTATAAAATCACAGAGGGTGATGGTGGGTGACCTTGAGGATATCAACGAGATGATCATCAAGCAGAAG
Фармакокинетика
[ редактировать ]После однократного или многократного внутривенного введения большая часть выведения препарата происходила в течение 24 часов после внутривенного введения. Период полувыведения этеплирсена составлял 3–4 часа. [7]
История
[ редактировать ]Новые заявки на лекарства (NDA) на этеплирсен и аналогичный препарат дрисаперсен были поданы в Управление по контролю за продуктами и лекарствами США (FDA) в августе 2015 года. [13] В соответствии с Законом о сборах за лекарства, отпускаемые по рецепту (PDUFA), целевыми датами для них были 27 декабря 2015 г. для дрисаперсена и 26 февраля 2016 г. для этеплирсена. После отклонения FDA дрисаперсена агентство объявило о продлении на три месяца срока рассмотрения этеплирсена. Решение комиссии FDA было спорным, поскольку сотрудники FDA и комиссия использовали более строгие стандарты доказательств, чем Сарепта и группы пациентов. Комиссия FDA заявила, что по закону требуется применять стандарт «существенных доказательств» эффективности. Для этого потребовались рандомизированные контролируемые исследования, показавшие эффективность значимых клинических результатов, таких как способность функционировать в повседневной жизни. Сарепта и группы пациентов хотели использовать стандарт исторического контроля, личные свидетельства и наличие измененного дистрофина в организме. 25 апреля 2016 г. Группа Консультативного комитета проголосовала против одобрения. [14] Однако в июне 2016 года FDA запросило у Сарепты дополнительные данные для подтверждения результатов выработки дистрофина этеплирсеном. Джанет Вудкок , директор Центра оценки и исследования лекарств FDA, отклонила решение комиссии, а комиссар FDA Роберт Калифф подчинился ее решению. Этерплирсен получил ускоренное одобрение 19 сентября 2016 г. [15]
Европейское агентство лекарственных средств рассмотрело молекулу в 2018 году и отказалось одобрить ее. [6] [16]
После одобрения этеплирсена два других препарата аналогичного типа, голодирсен и вилтоларсен, получили предварительное одобрение FDA для лечения людей с подтвержденной мутацией гена дистрофина , поддающейся пропуску экзона 53. [17] [18] а также казимерсен для пропуска экзона 45. [19]
Общество и культура
[ редактировать ]Экономика
[ редактировать ]Прейскурантная цена этеплирсена в США составляет 300 000 долларов США за год лечения. необходима ссылка . Институт клинической и экономической экспертизы обнаружил, что препарат нерентабелен по прейскурантной цене, когда стоимость одного года жизни с поправкой на качество (QALY) равнялась 150 000 долларов США . [20]
Ссылки
[ редактировать ]- ^ Ското М., Финкель Р., Меркури Э., Мунтони Ф. (август 2018 г.). «Генетическая терапия наследственных нервно-мышечных заболеваний» . «Ланцет». Здоровье детей и подростков . 2 (8): 600–609. дои : 10.1016/S2352-4642(18)30140-8 . ПМИД 30119719 . S2CID 52032568 .
- ^ Лим КР, Маруяма Р, Ёкота Т (2017). «Этеплирсен в лечении мышечной дистрофии Дюшенна» . Дизайн, разработка и терапия лекарств . 11 : 533–545. дои : 10.2147/DDDT.S97635 . ПМЦ 5338848 . ПМИД 28280301 .
Этеплирсен применим примерно у 14% пациентов с мутациями МДД.
- ^ «Перрон и UWA получат непредвиденную прибыль в размере 70 миллионов долларов» . 3 июня 2021 г. Проверено 16 ноября 2021 г.
- ^ «FDA выдает ускоренное одобрение первому препарату для лечения мышечной дистрофии Дюшенна» . Пресс-объявления . Управление по контролю за продуктами и лекарствами США. 19 сентября 2016 года . Проверено 19 сентября 2016 г.
- ^ «Железнодорожное сообщение в FDA» . Природная биотехнология . 34 (11): 1078. Ноябрь 2016 г. doi : 10.1038/nbt.3733 . ПМИД 27824847 .
- ^ Jump up to: а б «Эксондис ЭПАР» . Европейское агентство лекарственных средств (EMA) . 17 сентября 2018 года . Проверено 13 августа 2020 г. .
- ^ Jump up to: а б «Этеплирсен – инструкция по применению» (PDF) . FDA . Сентябрь 2016.
- ^ Энтони К., Фенг Л., Аречавала-Гомеза В., Гульери М., Штрауб В., Бушби К. и др. (октябрь 2012 г.). «Количественная оценка пропуска экзонов с помощью количественной полимеразной цепной реакции с обратной транскрипцией у пациентов с мышечной дистрофией Дюшенна, получавших антисмысловой олигомер этеплирсен». Методы генной терапии человека . 23 (5): 336–45. дои : 10.1089/hgtb.2012.117 . ПМИД 23075107 .
- ^ Моултон Х.М., Моултон Дж.Д. (декабрь 2010 г.). «Морфолиноиды и их пептидные конъюгаты: перспективы и проблемы лечения мышечной дистрофии Дюшенна» . Biochimica et Biophysical Acta (BBA) – Биомембраны . 1798 (12): 2296–303. дои : 10.1016/j.bbamem.2010.02.012 . ПМИД 20170628 .
- ^ Jump up to: а б с «Этеплирсен» (PDF) . Информационный документ FDA . 25 апреля 2016 г.
- ^ Коле Р., Лепперт Б.Дж. (июль 2012 г.). «Нацеленный на сплайсинг мРНК как потенциальное лечение мышечной дистрофии Дюшенна» . Медицина открытий . 14 (74): 59–69. ПМИД 22846203 .
- ^ Менделл Дж.Р., Родино-Клапак Л.Р., Сахенк З., Руш К., Бёрд Л., Лоуз Л.П. и др. (ноябрь 2013 г.). «Этеплирсен для лечения мышечной дистрофии Дюшенна» . Анналы неврологии . 74 (5): 637–47. дои : 10.1002/ana.23982 . ПМИД 23907995 . S2CID 24359589 .
- ^ «FDA принимает соглашение о неразглашении Сарепты в отношении Этеплирсена» . Отчет о редких заболеваниях. Архивировано из оригинала 28 августа 2015 г. Проверено 28 августа 2015 г.
- ^ Поллак, Эндрю (25 апреля 2016 г.). «Консультанты FDA голосуют против препарата от мышечной дистрофии Дюшенна» . Нью-Йорк Таймс .
- ^ Колонка: Чтобы успокоить лобби пациентов, одобрило ли FDA неэффективный препарат стоимостью 300 000 долларов? Майкл Хилцик, Los Angeles Times, 28 октября 2016 г.
- ^ «Идя своим путем, европейские регулирующие органы отвергли Exondys 51 Сарепты из-за МДД» . Биокосмос . Проверено 14 декабря 2019 г.
- ^ Анвар С., Йокота Т. (август 2020 г.). «Голодирсен при мышечной дистрофии Дюшенна». Наркотики сегодня . 56 (8): 491–504. дои : 10.1358/точка.2020.56.8.3159186 . ПМИД 33025945 . S2CID 222183389 .
- ^ Диллон С. (июль 2020 г.). «Вилтоларсен: первое одобрение». Наркотики . 80 (10): 1027–1031. дои : 10.1007/s40265-020-01339-3 . ПМИД 32519222 . S2CID 219542850 .
- ^ «FDA одобрило таргетное лечение редкой мутации мышечной дистрофии Дюшенна» . Управление по контролю за продуктами и лекарствами . 25 февраля 2021 г.
- ^ «ICER считает, что нынешние методы лечения МДД слишком дороги, но отмечает ограниченность данных» . Биофарма Дайв . Проверено 14 декабря 2019 г.
Внешние ссылки
[ редактировать ]- «Этеплирсен» . Информационный портал о наркотиках . Национальная медицинская библиотека США.