Генная терапия
| Часть серии о |
| Генная инженерия |
|---|
 |
| Генетически модифицированные организмы |
| История и регулирование |
| Процесс |
| Приложения |
| Споры |
Генная терапия — это медицинская технология , целью которой является достижение терапевтического эффекта посредством манипулирования экспрессией генов или изменения биологических свойств живых клеток. [1] [2] [3]
Первая попытка модификации человеческой ДНК была предпринята в 1980 году Мартином Клайном , но первый успешный перенос ядерных генов у человека, одобренный Национальными институтами здравоохранения , был осуществлен в мае 1989 года. [4] Первое терапевтическое использование переноса генов, а также первое прямое встраивание ДНК человека в ядерный геном было осуществлено Френчем Андерсоном в ходе исследования, начавшегося в сентябре 1990 года. В период с 1989 по декабрь 2018 года было проведено более 2900 клинических испытаний, в которых участвовало более половина из них в фазе I. [5] В 2003 году Гендицин стал первой генной терапией, получившей одобрение регулирующих органов. С этого времени были одобрены и другие препараты генной терапии, такие как Glybera (2012), Стримвелис (2016), Kymriah (2017), Luxturna (2017), Onpattro (2018), Zolgensma (2019), Abecma (2021), Адстиладрин , Роктавиан и Хемгеникс (весь 2022 год). Большинство этих подходов используют аденоассоциированные вирусы (AAV) и лентивирусы для выполнения вставок генов in vivo и ex vivo соответственно. AAV характеризуются стабилизацией вирусного капсида , более низкой иммуногенностью, способностью трансдуцировать как делящиеся, так и неделящиеся клетки, способностью специфически интегрировать сайт и достигать долгосрочной экспрессии при лечении in vivo. [6] Подходы ASO / siRNA , подобные тем, которые применяются Alnylam и Ionis Pharmaceuticals , требуют невирусных систем доставки и используют альтернативные механизмы доставки в клетки печени посредством транспортеров GalNAc .
Не все медицинские процедуры, которые вносят изменения в генетический состав пациента, можно считать генной терапией. трансплантация костного мозга и трансплантация органов в целом приводят к введению чужеродной ДНК пациентам. Было обнаружено, что [7]
Предыстория [ править ]
возможность добавления новых генетических функций к млекопитающих клеткам Генная терапия впервые была задумана в 1960-х годах, когда начали исследовать . Было опробовано несколько способов сделать это, включая инъекцию генов с помощью микропипетки непосредственно в живую клетку млекопитающего и воздействие на клетки осадка ДНК , содержащего нужные гены. Ученые предположили, что вирус также можно использовать в качестве носителя или вектора для доставки новых генов в клетки.
Одним из первых ученых, сообщивших об успешном прямом включении функциональной ДНК в клетку млекопитающего, была биохимик доктор Лоррейн Марквардт Краус (6 сентября 1922 г. - 1 июля 2016 г.). [8] в Университете Теннесси в Теннесси , США . В 1961 году ей удалось генетически изменить гемоглобин клеток взятых костного мозга, у больного серповидноклеточной анемией . пациента Она сделала это, инкубировав клетки в культуре ткани с ДНК , полученной от донора с нормальным гемоглобином . В 1968 году исследователи Теодор Фридман , Джей Сигмиллер и Джон Субак-Шарп из Национального института здравоохранения (NIH), Бетесда, США, успешно исправили генетические дефекты, связанные с синдромом Леша-Нихана , изнурительным неврологическим заболеванием , путем добавления чужеродных ДНК культивируемых клеток, собранных у пациентов, страдающих этим заболеванием. [9]
Первую, безуспешную попытку генной терапии (а также первый случай медицинского переноса чужеродных генов человеку, не считая трансплантации органов ) осуществил генетик Мартин Клайн из Калифорнийского университета в Лос-Анджелесе, штат Калифорния , США. 10 июля 1980 года. [10] [11] Клайн утверждал, что один из генов у его пациентов был активен шесть месяцев спустя, хотя он никогда не публиковал эти данные и не проверял их. [12]
После обширных исследований на животных в течение 1980-х годов и испытания бактериального генного мечения на людях в 1989 году первая генная терапия, получившая широкое признание как успешная, была продемонстрирована в исследовании, которое началось 14 сентября 1990 года, когда Ашанти ДеСильва лечилась от ADA - SCID . [13]
Первое соматическое лечение, которое привело к постоянным генетическим изменениям, было начато в 1993 году. [14] Цель состояла в том, чтобы вылечить злокачественные опухоли головного мозга с помощью рекомбинантной ДНК для переноса гена, делающего опухолевые клетки чувствительными к лекарству, которое, в свою очередь, приведет к гибели опухолевых клеток. [15]
Полимеры либо транслируются в белки , либо мешают экспрессии целевых генов , либо, возможно, корректируют генетические мутации . Наиболее распространенная форма использует ДНК , которая кодирует функциональный терапевтический ген для замены мутировавшего гена. Молекула полимера упакована в « вектор », который переносит молекулу внутрь клеток. [ нужна медицинская ссылка ]
Ранние клинические неудачи привели к отказу от генной терапии. Клинические успехи с 2006 г. вновь привлекли внимание исследователей, хотя по состоянию на 2014 г. [update], это все еще была в основном экспериментальная методика. [16] К ним относится лечение заболеваний сетчатки, врожденного амавроза Лебера. [17] [18] [19] [20] и хороидеремия , [21] Х-сцепленный SCID , [22] АДА-СКИД, [23] [24] адренолейкодистрофия , [25] хронический лимфоцитарный лейкоз (ХЛЛ), [26] острый лимфоцитарный лейкоз (ОЛЛ), [27] множественная миелома , [28] гемофилия , [24] и болезнь Паркинсона . [29] С 2013 по апрель 2014 года американские компании инвестировали в эту область более 600 миллионов долларов. [30]
Первая коммерческая генная терапия Gendicine была одобрена в Китае в 2003 году для лечения некоторых видов рака. [31] В 2011 году Неоваскулген был зарегистрирован в России как первый в своем классе генотерапевтический препарат для лечения заболеваний периферических артерий , в том числе критической ишемии конечностей . [32] В 2012 году Glybera , препарат для лечения редкого наследственного заболевания , дефицита липопротеинлипазы , стал первым препаратом, одобренным для клинического применения в Европе или США после его одобрения Европейской комиссией . [16] [33]
После первых достижений в области генной инженерии бактерий, клеток и мелких животных ученые начали думать о том, как применить ее в медицине. Были рассмотрены два основных подхода – замена или разрушение дефектных генов. [34] Ученые сосредоточились на заболеваниях, вызванных дефектами одного гена, таких как муковисцидоз , гемофилия, мышечная дистрофия , талассемия и серповидноклеточная анемия . Глибера лечит одно из таких заболеваний, вызванное дефектом липопротеинлипазы . [33]
ДНК необходимо ввести, достичь поврежденных клеток, проникнуть в клетку и либо экспрессировать, либо разрушить белок. [35] Были изучены различные методы доставки. Первоначальный подход заключался в включении ДНК в сконструированный вирус для доставки ДНК в хромосому . [36] [37] «голой ДНК» Также изучались подходы к использованию , особенно в контексте разработки вакцин . [38]
Как правило, усилия были сосредоточены на введении гена, который вызывает экспрессию необходимого белка. Совсем недавно более глубокое понимание функции нуклеаз привело к более прямому редактированию ДНК с использованием таких методов, как нуклеазы с цинковыми пальцами и CRISPR . Вектор включает гены в хромосомы. Экспрессированные нуклеазы затем нокаутируют и заменяют гены в хромосоме. По состоянию на 2014 год [update] эти подходы включают удаление клеток у пациентов, редактирование хромосомы и возвращение трансформированных клеток пациентам. [39]
Редактирование генов — это потенциальный подход к изменению генома человека для лечения генетических заболеваний. [40] вирусные заболевания, [41] и рак. [42] [43] По состоянию на 2020 год [update] эти подходы изучаются в клинических испытаниях. [44] [45]
Классификация [ править ]
Широта определения [ править ]
В 1986 году на заседании Медицинского института генная терапия определялась как добавление или замена гена в определенном типе клеток. В том же году FDA объявило, что оно обладает юрисдикцией по разрешению «генной терапии» без определения этого термина. В 1993 году FDA добавило очень широкое определение любого лечения, которое «модифицирует или манипулирует экспрессией генетического материала или изменяет биологические свойства живых клеток». В 2018 году это понятие было сужено до «продуктов, которые опосредуют свое действие путем транскрипции или трансляции переданного генетического материала или путем специфического изменения генетических последовательностей хозяина (человека)». [46]
В статье в 2018 году в Журнале права и биологических наук Шерков и др. выступал за более узкое определение генной терапии, чем определение FDA, в свете новой технологии, которая будет включать любое лечение, которое намеренно и навсегда изменяет геном клетки, при этом определение генома включает эписомы вне ядра, но исключает изменения, вызванные утратой эписом. через некоторое время. Это определение также исключает введение клеток, которые не были получены от пациента сами по себе, но включает подходы ex vivo и не будет зависеть от используемого вектора. [46]
Во время пандемии COVID-19 некоторые ученые настаивали на том, что мРНК-вакцины от COVID не являются генной терапией, чтобы предотвратить распространение неверной информации о том, что вакцина может изменить ДНК. Другие ученые утверждали, что вакцины были генной терапией, поскольку они вводили генетический материал в клетка. [47] Фактчекеры , такие как Full Fact , [48] Рейтер , [49] ПолитиФакт , [50] и FactCheck.org [51] сказал, что называть вакцины генной терапией неправильно. Ведущий подкаста Джо Роган подвергся критике за то, что назвал мРНК-вакцины генной терапией, как и британский политик Эндрю Бриджен , а служба проверки фактов Full Fact призвала исключить Бриджена из консервативной партии за это и другие заявления. [52] [53]
Гены присутствуют или добавляются [ править ]
Генная терапия инкапсулирует множество форм добавления различных нуклеиновых кислот в клетку . Генная аугментация добавляет в клетку новый ген, кодирующий белок. Одной из форм увеличения генов является заместительная генная терапия , лечение моногенных рецессивных заболеваний, при которых один ген не функционирует, а добавляется дополнительный функциональный ген. Для заболеваний, вызванных множественными генами или доминантным геном, более подходящими являются методы подавления генов или редактирования генов генов , но добавление (форма увеличения генов, при которой добавляется новый ген) может улучшить функцию клеток без изменения генов, вызывающих заболевание. [54] : 117
Типы ячеек [ править ]
Генную терапию можно разделить на два типа в зависимости от типа клеток, на которые она воздействует: генная терапия соматических клеток и генная терапия зародышевой линии.
При генной терапии соматических клеток (SCGT) терапевтические гены переносятся в любую клетку, кроме гаметы , зародышевой клетки , гаметоцита или недифференцированной стволовой клетки . Любые такие модификации затрагивают только отдельного пациента и не наследуются потомством . Соматическая генная терапия представляет собой основное направление фундаментальных и клинических исследований, в которых терапевтическая ДНК (либо интегрированная в геном , либо в виде внешней эписомы или плазмиды ) используется для лечения заболеваний. [55] В настоящее время проводится более 600 клинических испытаний с использованием SCGT. [ когда? ] в США. Большинство из них сосредоточены на тяжелых генетических нарушениях, включая иммунодефициты , гемофилию , талассемию и муковисцидоз . Такие единичные генные нарушения являются хорошими кандидатами на терапию соматическими клетками. Полная коррекция генетического нарушения или замена нескольких генов пока невозможна. Лишь немногие из испытаний находятся на продвинутой стадии. [56] [ нужно обновить ]
При генной терапии зародышевой линии (GGT) зародышевые клетки ( сперматозоиды или яйцеклетки ) модифицируются путем введения функциональных генов в их геномы. Модификация зародышевой клетки приводит к тому, что все клетки организма содержат модифицированный ген. Таким образом, изменения передаются по наследству и последующим поколениям. Австралия, Канада, Германия, Израиль, Швейцария и Нидерланды. [57] запретить применение ГГТ у людей по техническим и этическим причинам, включая недостаточные знания о возможных рисках для будущих поколений. [57] и более высокие риски по сравнению с SCGT. [58] В США нет федерального контроля, конкретно касающегося генетической модификации человека (кроме правил FDA для терапии в целом). [57] [59] [60] [61]
Терапия in vivo vivo ex и

При генной терапии in vivo пациенту вводят вектор (обычно вирус), который затем достигает желаемого биологического эффекта путем передачи генетического материала (например, недостающего белка) в клетки пациента. При генной терапии ex vivo , такой как терапия CAR-T , собственные клетки пациента (аутологичные) или здоровые донорские клетки (аллогенные) модифицируются вне организма (следовательно, ex vivo ) с использованием вектора для экспрессии определенного белка, такого как химерный антигенный рецептор. [62]
Генная терапия in vivo считается более простой, поскольку не требует сбора митотических клеток. Однако генная терапия ex vivo лучше переносится и менее связана с тяжелыми иммунными реакциями. [63] Смерть Джесси Гелсингера в ходе исследования аденовирусного лечения дефицита орнитинтранскарбамилазы из-за системной воспалительной реакции привела к временной остановке испытаний генной терапии в Соединенных Штатах. [64] По состоянию на 2021 год [update] , терапия как in vivo так и ex vivo считается безопасной. [65]
Редактирование генов [ править ]

Концепция генной терапии заключается в устранении генетической проблемы в ее источнике. Если, например, мутация в определенном гене вызывает выработку дисфункционального белка, что приводит (обычно рецессивно) к наследственному заболеванию, генную терапию можно использовать для доставки копии этого гена, которая не содержит вредной мутации и, таким образом, производит функциональный белок. Эта стратегия называется генной заместительной терапией и может быть использована для лечения наследственных заболеваний сетчатки. [17] [66]
Хотя концепция заместительной генной терапии в основном подходит для рецессивных заболеваний, были предложены новые стратегии, которые способны также лечить состояния с доминантным типом наследования.
- Внедрение редактирования генов CRISPR открыло новые возможности для его применения и использования в генной терапии, поскольку вместо чистой замены гена оно позволяет исправить конкретный генетический дефект. [40] В будущем в качестве терапевтического варианта могут появиться решения медицинских проблем, такие как уничтожение латентных резервуаров вируса иммунодефицита человека ( ВИЧ ) и коррекция мутации, вызывающей серповидно-клеточную анемию. [67] [68] [69]
- Цель протезной генной терапии — дать возможность клеткам организма взять на себя функции, которые они физиологически не выполняют. Одним из примеров является так называемая генная терапия восстановления зрения, целью которой является восстановление зрения у пациентов с терминальной стадией заболеваний сетчатки. [70] [71] При терминальных стадиях заболеваний сетчатки фоторецепторы как первичные светочувствительные клетки сетчатки необратимо утрачиваются. С помощью протезной генной терапии светочувствительные белки доставляются в оставшиеся клетки сетчатки, чтобы сделать их светочувствительными и тем самым дать им возможность передавать визуальную информацию в мозг.
In vivo системы редактирования генов с использованием CRISPR использовались в исследованиях на мышах для лечения рака и оказались эффективными в уменьшении опухолей. [72] : 18 In vitro система CRISPR использовалась для лечения раковых опухолей, вызванных ВПЧ. Аденоассоциированный вирус и векторы на основе лентивируса должны были внедрить геном в систему CRISPR. [72] : 6
Векторы [ править ]
Доставка ДНК в клетки может осуществляться несколькими методами . Двумя основными классами являются рекомбинантные вирусы (иногда называемые биологическими наночастицами или вирусными векторами) и голая ДНК или комплексы ДНК (невирусные методы). [73]
Вирусы [ править ]

Чтобы размножиться , вирусы вводят свой генетический материал в клетку-хозяина, обманывая клеточный механизм хозяина, заставляя его использовать его в качестве чертежей для вирусных белков. [54] : 39 Ретровирусы идут еще дальше, копируя свой генетический материал в ядерный геном клетки-хозяина. Ученые используют это, заменяя часть генетического материала вируса терапевтической ДНК или РНК. [54] : 40 [74] Подобно генетическому материалу (ДНК или РНК) в вирусах, терапевтический генетический материал может быть спроектирован так, чтобы просто служить временным образцом, который естественным образом разлагается, как в случае с неинтегрирующими векторами , или проникать в ядро хозяина, становясь постоянной частью его организма. ядерная ДНК в инфицированных клетках. [54] : 50
Для генной терапии человека использовался ряд вирусов, включая такие вирусы, как лентивирус , аденовирусы , простой герпес , коровья коровка и аденоассоциированный вирус . [5]
Аденовирусные вирусные векторы (Ad) временно изменяют генетическую экспрессию клетки с помощью генетического материала, который не интегрирован в ДНК клетки-хозяина. [75] : 5 По состоянию на 2017 год такие векторы использовались в 20% исследований генной терапии. [74] : 10 Аденовирусные векторы в основном используются при лечении рака и новых генетических вакцинах, таких как вакцина против Эболы , вакцинах, используемых в клинических испытаниях против ВИЧ и SARS-CoV-2 , или вакцинах против рака . [75] : 5
Лентивирусные векторы, основанные на лентивирусе , ретровирусе клетки , могут модифицировать ядерный геном для постоянной экспрессии гена, хотя векторы можно модифицировать, чтобы предотвратить интеграцию. [54] : 40,50 До 2018 года ретровирусы использовались в 18% исследований. [74] : 10 Libmeldy — это метод лечения метахроматической лейкодистрофии стволовыми клетками ex vivo , в котором используется лентивирусный вектор и который был одобрен Европейским медицинским агентством в 2020 году. [76]
Аденоассоциированный вирус (ААВ) — это вирус, который не способен передаваться между клетками, если клетка не инфицирована другим вирусом, вирусом-помощником. Аденовирус и вирусы герпеса действуют как вирусы-помощники для AAV. AAV сохраняется внутри клетки за пределами ядерного генома клетки в течение длительного периода времени посредством образования конкатемеров, в основном организованных в виде эписом . [77] : 4 Генетический материал из векторов AAV интегрируется в ядерный геном клетки-хозяина с низкой частотой и, вероятно, опосредован модифицирующими ДНК ферментами клетки-хозяина. [78] : 2647 Модели на животных предполагают, что интеграция генетического материала AAV в ядерный геном клетки-хозяина может вызвать гепатоцеллюлярную карциному , форму рака печени . [78] Несколько экспериментальных агентов AAV были изучены для лечения влажной возрастной дегенерации желтого пятна как интравитреальным , так и субретинальным подходами в качестве потенциального применения генной терапии AAV для лечения заболеваний человека. [79] [80]
Невирусный [ править ]
Этот раздел нуждается в дополнительных цитатах для проверки . ( Апрель 2021 г. ) |
Невирусные векторы для генной терапии [81] представляют определенные преимущества перед вирусными методами, такие как крупномасштабное производство и низкая иммуногенность хозяина . Однако невирусные методы первоначально приводили к более низким уровням трансфекции и экспрессии генов и, следовательно, к более низкой терапевтической эффективности. Новые технологии обещают решить эти проблемы с появлением более точного нацеливания на клетки и контроля над внутриклеточным трафиком.
Методы невирусной генной терапии включают инъекцию обнаженной ДНК, электропорацию , генную пушку , сонопорацию , магнитофекцию , использование олигонуклеотидов , липоплексов, дендримеров и неорганических наночастиц. Эти терапевтические средства можно вводить непосредственно или посредством обогащения каркаса . [82] [83]
Более поздние подходы, например, применяемые такими компаниями, как Ligandal , открывают возможность создания технологий нацеливания на клетки для различных методов генной терапии, включая инструменты редактирования РНК, ДНК и генов, такие как CRISPR. Другие компании, такие как Arbutus Biopharma и Arcturus Therapeutics , предлагают невирусные, не нацеленные на клетки подходы, которые в основном демонстрируют трофику печени. В последние годы такие стартапы, как Sixfold Bio , GenEdit и Spotlight Therapeutics, начали решать проблему доставки невирусных генов. Невирусные методы открывают возможность повторного введения доз и большую адаптируемость генетической нагрузки, которая в будущем с большей вероятностью заменит системы доставки на основе вирусов.
Такие компании, как Editas Medicine , Intellia Therapeutics , CRISPR Therapeutics , Casebia , Cellectis , Precision Biosciences , bluebird bio , Excision BioTherapeutics и Sangamo , разработали невирусные методы редактирования генов, однако часто до сих пор используют вирусы для доставки материала для вставки гена после расщепления генома с помощью управляемые нуклеазы . Эти компании сосредоточены на редактировании генов, но до сих пор сталкиваются с серьезными трудностями при доставке.
BioNTech , Moderna Therapeutics и CureVac сосредоточены на доставке полезной нагрузки мРНК , которая обязательно связана с невирусными проблемами доставки.
Alnylam , Dicerna Pharmaceuticals и Ionis Pharmaceuticals сосредоточены на доставке миРНК (антисмысловых олигонуклеотидов) для подавления генов, что также требует невирусных систем доставки.
В академическом контексте ряд лабораторий работают над доставкой ПЭГилированных частиц, которые образуют короны сывороточных белков и в основном демонстрируют опосредованное рецептором ЛПНП поглощение в клетках in vivo . [84]
Лечение [ править ]
Рак [ править ]
Были попытки лечить рак с помощью генной терапии. По состоянию на 2017 год 65% исследований генной терапии были направлены на лечение рака. [74] : 7
Аденовирусные векторы полезны для некоторых видов генной терапии рака, поскольку аденовирус может временно вставлять генетический материал в клетку без постоянного изменения ядерного генома клетки. Эти векторы можно использовать для того, чтобы вызвать антигенов добавление к раковым образованиям, вызывающим иммунный ответ, или препятствовать ангиогенезу за счет экспрессии определенных белков. [85] : 5 Аденовирусный вектор используется в коммерческих продуктах Gendicine и Oncorine . [85] : 10 Другой коммерческий продукт, Rexin G , использует вектор на основе ретровируса и избирательно связывается с рецепторами, которые более экспрессируются в опухолях. [85] : 10
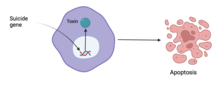
Один из подходов — суицидальная генная терапия — работает путем введения генов, кодирующих ферменты, вызывающие гибель раковых клеток. Другой подход – использование онколитических вирусов , таких как Онкорин, [86] : 165 Это вирусы, которые избирательно размножаются в раковых клетках, не затрагивая другие клетки. [87] : 6 [88] : 280
мРНК была предложена в качестве невирусного вектора для генной терапии рака, который может временно изменить функцию раковой клетки, создавая антигены или убивая раковые клетки, и было проведено несколько испытаний. [89]
Генетические заболевания [ править ]
Подходы генной терапии для замены дефектного гена здоровым геном были предложены и изучаются для лечения некоторых генетических заболеваний. По состоянию на 2017 год 11,1% клинических исследований генной терапии были нацелены на моногенные заболевания. [74] : 9
Такие заболевания, как серповидно-клеточная анемия , вызванные аутосомно-рецессивными заболеваниями или функция клеток человека , при которых нормальный фенотип могут быть восстановлены в клетках, страдающих этим заболеванием, с помощью нормальной копии мутировавшего гена, могут быть хорошим кандидатом на генную терапию. уход. [90] [91] Риски и преимущества, связанные с генной терапией серповидноклеточной анемии, неизвестны. [91]
Генная терапия была использована в глазу . Глаз особенно подходит для аденоассоциированных вирусных векторов. Luxturna — одобренный генный препарат для лечения наследственной оптической невропатии Лебера . [92] : 1354 Glybera , средство для лечения панкреатита, вызванного генетическим заболеванием, и Zolgensma для лечения спинальной мышечной атрофии используют аденоассоциированный вирусный вектор. [78] : 2647
Инфекционные болезни [ править ]
По состоянию на 2017 год 7% исследований генной терапии были нацелены на инфекционные заболевания. 69,2% исследований были нацелены на ВИЧ , 11% — на гепатит B или C и 7,1% — на малярию . [74]
лечения заболеваний терапии для Список генной
Некоторые генетические методы лечения были одобрены Управлением по контролю за продуктами и лекарствами США (FDA), Европейским агентством по лекарственным средствам (EMA) и предназначены для использования в России и Китае.
| В | Название бренда | Тип | Производитель | Цель | США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило | Разрешение Европейского агентства по лекарственным средствам (EMA) |
|---|---|---|---|---|---|---|
| алопеген типарвовек | Глибера | В естественных условиях | Кьези Фармацевтичи | дефицит липопротеинлипазы | Нет | снято |
| открыть автотемсел | Либмелди, Ленмелди ( Ген арилсульфатазы А, кодирующий аутологичные клетки CD34+ ) | Экс-витро | Садовая терапия | метахроматическая лейкодистрофия | 18 марта 2024 г. [93] | 17 декабря 2020 г. [94] |
| аутологичный CD34+ | Стримвелл | дефицит аденозиндезаминазы (ADA-SCID) | 26 мая 2016 г. | |||
| аксикабтаген цилолеуцел | Йескарта | Экс-витро | Кайт фарма | крупноклеточная В-клеточная лимфома | 18 октября 2017 г. | 23 августа 2018 г. |
| Беремаген геперпавец | Уйювек | В естественных условиях | Кристалл Биотех | Дистрофический буллезный эпидермолиз (БЭБ) | 19 мая 2023 г. [95] | Нет |
| бетабеглоген аутотемцел | Зинтегло | бета-талассемия | 17 августа 2022 г. [96] | 29 мая 2019 г. | ||
| брексукабтаген автолейцел | Текарт | Экс-витро | Кайт Фарма | лимфома мантийных клеток и острый лимфобластный лейкоз | 24 июля 2020 г. [97] [98] | 14 декабря 2020 г. [99] |
| камбиогенплазмида | Неоваскулген | фактор роста эндотелия сосудов, заболевание периферических артерий | ||||
| деландистроген моксепарвовек | Элевидис | В естественных условиях | Каталент | мышечная дистрофия Дюшенна | 22 июня 2023 г. [100] | Нет |
| эливальдоген автотемцел | Скайсон | церебральная адренолейкодистрофия | 16 июля 2021 г. | |||
| эксагамглоген автотемцел | Касжеви | Экс-живой | Вертекс Фармасьютикалс | серповидно-клеточная анемия | декабрь 2023 г. [101] | |
| гендицина | плоскоклеточный рак головы и шеи | |||||
| идекабтаген виклеуцел | Абекма | Экс-живой | Селджен | множественная миелома | 26 марта 2021 г. [102] | Нет |
| лизокабтаген маралеуцел | Бреянзи | Экс-живой | Юнона Терапевтикс | В-клеточная лимфома | 5 февраля 2021 г. [103] | Нет |
| ловотибеглоген автотемцел | Лифгения | Экс-живой | Синяя птица Био | серповидно-клеточная анемия | декабрь 2023 г. [104] | |
| надофаген фираденовек | Астиладрин | Ферринг Фармасьютикалс | нерезистентный к мышечно-инвазивному раку мочевого пузыря (НМИРМ) с карциномой in situ (СНГ) высокого риска, вызванный бациллой Кальметта-Герена (БЦЖ) | Да [105] | Нет | |
| онасемноген абепарвовек | Золгенсма | В естественных условиях | Генная терапия Новартис | Спинальная мышечная атрофия I типа. | 24 мая 2019 г. [106] | 26 марта 2020 г. [107] |
| талимоген лагерпарепвек | Имлигический | В естественных условиях | Амген | меланома | 27 октября 2015 г. [108] | 16 декабря 2015 г. [109] |
| тисагенлеклейцел | Кимрия | В-клеточный лимфобластный лейкоз | 22 августа 2018 г. | |||
| валоктокоген роксапарвовек | Роктавиан | БиоМарин Интернэшнл Лимитед | гемофилия А | август 2022 г. [110] [111] [112] | ||
| воретигене непарвовец | Люкстурна | В естественных условиях | Искра Терапевтика | биаллельная RPE65, мутация связанная с врожденным амаврозом Лебера | 18 декабря 2017 г. [113] | 22 ноября 2018 г. [114] |
Побочные эффекты, противопоказания и использованию к препятствия
К числу нерешенных проблем относятся:
- Нецелевые эффекты. Возможность нежелательных, возможно, вредных изменений в геноме представляет собой серьезное препятствие для широкого внедрения этой технологии. [115] Улучшение специфичности гРНК и ферментов Cas представляет собой жизнеспособное решение этой проблемы, а также усовершенствование метода доставки CRISPR. [116] Вполне вероятно, что разные методы доставки принесут пользу при различных заболеваниях.
- Кратковременность действия. Прежде чем генная терапия сможет стать постоянным средством лечения заболевания, терапевтическая ДНК, введенная в клетки-мишени, должна оставаться функциональной, а клетки, содержащие терапевтическую ДНК, должны быть стабильными. Проблемы с интеграцией терапевтической ДНК в ядерный геном и быстрое деление многих клеток не позволяют достичь долгосрочных преимуществ. Пациентам требуется несколько курсов лечения.
- Иммунный ответ. Каждый раз, когда инородный объект попадает в ткани человека, иммунная система стимулируется атаковать захватчика. Возможна стимуляция иммунной системы таким образом, чтобы снизить эффективность генной терапии. Усиленная реакция иммунной системы на вирусы, с которой она сталкивалась раньше, снижает эффективность повторных курсов лечения.
- Проблемы с вирусными векторами. Вирусные векторы несут в себе риски токсичности, воспалительных реакций, а также проблем с генным контролем и нацеливанием.
- Мультигенные расстройства. На некоторые часто встречающиеся заболевания, такие как болезни сердца , высокое кровяное давление , болезнь Альцгеймера , артрит и диабет , влияют вариации нескольких генов, что усложняет генную терапию.
- Некоторые методы лечения могут нарушить барьер Вейсмана (между сомой и зародышевой линией), защищая яички, потенциально модифицируя зародышевую линию, что противоречит правилам стран, которые запрещают последнюю практику. [117]
- Инсерционный мутагенез . Если ДНК интегрируется в чувствительное место генома, например, в ген-супрессор опухоли , терапия может вызвать опухоль . Это произошло в клинических исследованиях у пациентов с Х-сцепленным тяжелым комбинированным иммунодефицитом (X-SCID), в которых гемопоэтические стволовые клетки трансдуцировались корректирующим трансгеном с использованием ретровируса , и это привело к развитию Т-клеточного лейкоза у 3 из 20 пациентов. . [118] [119] Одним из возможных решений является добавление функционального гена-супрессора опухоли к интегрируемой ДНК. Это может быть проблематично, поскольку чем длиннее ДНК, тем труднее ее интегрировать в клеточные геномы. [120] Технология CRISPR позволяет исследователям производить гораздо более точные изменения генома в конкретных местах. [121]
- Стоимость. Например, в 2013 году сообщалось, что Alipogene typarvovec или Glybera, стоимость которого составляет 1,6 миллиона долларов на пациента, является самым дорогим препаратом в мире. [122] [123]
Смерти [ править ]
В ходе испытаний генной терапии были зарегистрированы случаи смерти трех пациентов, что поставило эту область под пристальное внимание. Первым был Джесси Гелсингер , который умер в 1999 году из-за реакции иммунного отторжения. [124] [125] Один пациент X-SCID умер от лейкемии в 2003 году. [13] В 2007 году пациент с ревматоидным артритом умер от инфекции; последующее расследование пришло к выводу, что смерть не была связана с генной терапией. [126]
Регламент [ править ]
Правила, регулирующие генетическую модификацию, являются частью общих руководящих принципов биомедицинских исследований с участием человека. [ нужна ссылка ] В этой области не существует международных договоров, имеющих обязательную юридическую силу, но существуют рекомендации по национальным законам от различных органов. [ нужна ссылка ]
В Хельсинкскую декларацию (Этические принципы медицинских исследований с участием людей) были внесены поправки Генеральной ассамблеей Всемирной медицинской ассоциации в 2008 году. В этом документе изложены принципы, которые врачи и исследователи должны учитывать при привлечении людей в качестве объектов исследований. Заявление об исследованиях в области генной терапии, инициированное Организацией генома человека (HUGO) в 2001 году, обеспечивает правовую основу для всех стран. В документе Хьюго подчеркивается свобода человека и соблюдение прав человека, а также предлагаются рекомендации по соматической генной терапии, включая важность признания обеспокоенности общественности по поводу таких исследований. [127]
США [ править ]
Ни одно федеральное законодательство не устанавливает протоколов или ограничений в отношении генной инженерии человека. Этот вопрос регулируется дублирующими правилами местных и федеральных агентств, включая Министерство здравоохранения и социальных служб , FDA и Консультативный комитет НИЗ по рекомбинантной ДНК. Исследователи, ищущие федеральные средства для исследования новых лекарственных средств (обычно это касается соматической генной инженерии человека), должны соблюдать международные и федеральные рекомендации по защите людей. [128]
НИЗ служит основным регулятором генной терапии для исследований, финансируемых из федерального бюджета. В исследованиях, финансируемых из частных источников, рекомендуется следовать этим правилам. НИЗ предоставляет финансирование для исследований, которые развивают или совершенствуют методы генной инженерии, а также для оценки этики и качества текущих исследований. НИЗ ведет обязательный реестр протоколов исследований в области генной инженерии человека, который включает все проекты, финансируемые из федерального бюджета. [129]
Консультативный комитет НИЗ опубликовал ряд рекомендаций по манипуляциям с генами. [130] В рекомендациях обсуждается безопасность лабораторий, а также участие в экспериментах на людях и различные типы экспериментов, включающие генетические изменения. Несколько разделов конкретно относятся к генной инженерии человека, включая раздел III-C-1. В этом разделе описаны необходимые процессы проверки и другие аспекты при получении разрешения на начало клинических исследований, связанных с переносом генетического материала пациенту-человеку. [131] Протокол клинического исследования генной терапии должен быть одобрен Консультативным комитетом Национального института здравоохранения по рекомбинантной ДНК до начала любого клинического исследования; это отличается от любого другого вида клинических испытаний. [130]
Как и в случае с другими видами лекарств, FDA регулирует качество и безопасность продуктов генной терапии и контролирует клиническое использование этих продуктов. Терапевтическое изменение генома человека подпадает под те же нормативные требования, что и любое другое медицинское лечение. Исследования с участием людей, такие как клинические испытания , должны быть рассмотрены и одобрены FDA и Институциональным наблюдательным советом . [132] [133]
Генный допинг [ править ]
Спортсмены могут использовать технологии генной терапии для улучшения своих результатов. [134] Генный допинг не известен, но множественная генная терапия может иметь такой эффект. Кайзер и др. утверждают, что генный допинг может уравнять правила игры , если все спортсмены получат равный доступ. Критики утверждают, что любое терапевтическое вмешательство в нетерапевтических целях ставит под угрозу этические основы медицины и спорта. [135]
Генетическое улучшение
Генную инженерию можно использовать для лечения болезней, а также для изменения внешнего вида, обмена веществ и даже улучшения физических и умственных способностей, таких как память и интеллект . Этические претензии к инженерии зародышевой линии включают убеждения, что каждый плод имеет право оставаться генетически неизмененным, что родители имеют право генетически модифицировать свое потомство и что каждый ребенок имеет право рождаться без болезней, которые можно предотвратить. [136] [137] [138] Для родителей генная инженерия может рассматриваться как еще один метод улучшения ребенка, добавляемый к диете, физическим упражнениям, образованию, тренировкам, косметике и пластической хирургии. [139] [140] Другой теоретик утверждает, что моральные соображения ограничивают, но не запрещают инженерию зародышевой линии. [141]
Выпуск журнала «Биоэтика» за 2020 год был посвящен моральным проблемам, связанным с генной инженерией зародышевой линии у людей. [142]
Возможные схемы регулирования включают полный запрет, предоставление всем или профессиональное саморегулирование. Совет Американской медицинской ассоциации по этическим и юридическим вопросам заявил, что «генетические вмешательства для улучшения признаков следует считать допустимыми только в строго ограниченных ситуациях: (1) явная и значимая польза для плода или ребенка; (2) отсутствие компромиссов». с другими характеристиками или чертами и (3) равный доступ к генетическим технологиям, независимо от дохода или других социально-экономических характеристик». [143]
Еще в истории биотехнологии , в 1990 году, были ученые, выступавшие против попыток изменить зародышевую линию человека с помощью этих новых инструментов. [144] и подобные опасения сохранялись по мере развития технологий. [145] [146] С появлением новых методов, таких как CRISPR , в марте 2015 года группа ученых призвала ввести во всем мире мораторий на клиническое использование технологий редактирования генов для редактирования генома человека таким образом, чтобы он мог передаваться по наследству. [147] [148] [149] [150] В апреле 2015 года исследователи вызвали споры, когда сообщили о результатах фундаментального исследования по редактированию ДНК нежизнеспособных человеческих эмбрионов с помощью CRISPR. [151] [152] Комитет Американской национальной академии наук и Национальной медицинской академии оказал квалифицированную поддержку редактированию генома человека в 2017 году [153] [154] как только будут найдены ответы на проблемы безопасности и эффективности, «но только для серьезных условий при строгом надзоре». [155]
История [ править ]
Этот раздел может быть слишком длинным и чрезмерно подробным. ( ноябрь 2018 г. ) |
1970-е и ранее [ править ]
статью В 1972 году Фридман и Роблин опубликовали в журнале Science под названием «Генная терапия генетических заболеваний человека?». [156] Роджерса (1970) цитировали за предложение экзогенную хорошую ДНК для замены дефектной ДНК у людей с генетическими дефектами. использовать [157]
1980-е годы [ править ]
В 1984 году была разработана ретровирусная векторная система, которая могла эффективно вставлять чужеродные гены в хромосомы млекопитающих. [158]
1990-е годы [ править ]
Первое одобренное клиническое исследование генной терапии в США состоялось 14 сентября 1990 года в Национальных институтах здравоохранения (NIH) под руководством Уильяма Френча Андерсона . [159] Четырехлетняя Ашанти ДеСильва прошла лечение от генетического дефекта, из-за которого у нее возник дефицит аденозиндезаминазы (ADA-SCID), серьезный дефицит иммунной системы. Дефектный ген клеток крови пациента был заменен функциональным вариантом. Иммунная система Ашанти была частично восстановлена в результате терапии. Производство недостающего фермента было временно стимулировано, но новые клетки с функциональными генами не были созданы. Она вела нормальную жизнь только с регулярными инъекциями, которые делались каждые два месяца. Эффект был успешным, но временным. [160]
Генная терапия рака была внедрена в 1992/93 году (Trojan et al. 1993). [161] Лечение мультиформной глиобластомы , злокачественной опухоли головного мозга, исход которой всегда фатален, проводилось с использованием вектора, экспрессирующего антисмысловую РНК IGF-I (клиническое исследование одобрено протоколом NIH № 1602 от 24 ноября 1993 г., [162] и FDA в 1994 г.). Эта терапия также представляет собой начало иммуногенной терапии рака, лечения, которое оказывается эффективным благодаря противоопухолевому механизму антисмыслового IGF-I, который связан с сильными иммунными и апоптотическими явлениями.
В 1992 году Клаудио Бординьон , работающий в Университете Вита-Салюте Сан-Раффаэле , провел первую процедуру генной терапии с использованием гемопоэтических стволовых клеток в качестве векторов для доставки генов, предназначенных для коррекции наследственных заболеваний . [163] В 2002 году эта работа привела к публикации первого успешного метода генной терапии ADA-SCID. Успех многоцентрового исследования по лечению детей с ТКИД ( тяжелый комбинированный иммунодефицит или болезнь «пузырного мальчика») в 2000 и 2002 годах был поставлен под сомнение, когда у двоих из десяти детей, проходивших лечение в парижском центре исследования, развилось заболевание, похожее на лейкемию. . Клинические испытания были временно приостановлены в 2002 году, но возобновились после проверки протокола регулирующими органами в США, Великобритании, Франции, Италии и Германии. [164]
Эндрю Гобеа родился с ТКИД В 1993 году после пренатального генетического скрининга . Сразу после рождения у его матери взяли кровь из плаценты и пуповины для получения стволовых клеток. Аллель , кодирующая аденозиндезаминазу (ADA), была получена и вставлена в ретровирус. Ретровирусы и стволовые клетки смешивали, после чего вирусы встраивали ген в хромосомы стволовых клеток. Стволовые клетки, содержащие рабочий ген ADA, были введены в кровь Эндрю. Инъекции фермента ADA также делались еженедельно. В течение четырех лет Т-клетки (лейкоциты), продуцируемые стволовыми клетками, вырабатывали ферменты ADA с использованием гена ADA. Через четыре года потребовалось дополнительное лечение. [165]
В 1996 году Луиджи Нальдини и Дидье Троно разработали новый класс векторов для генной терапии на основе ВИЧ, способных инфицировать неделящиеся клетки, которые с тех пор широко использовались в клинических и исследовательских целях, став пионерами лентивирусных векторов в генной терапии . [166]
Смерть Джесси Гелсингера в 1999 году помешала исследованиям генной терапии в США. [167] [168] В результате FDA приостановило несколько клинических исследований в ожидании переоценки этической и процедурной практики. [169]
2000-е [ править ]
Модифицированная стратегия генной терапии антисмысловой РНК IGF-I (NIH № 1602) [162] Использование антисмыслового/тройного спирального анти-IGF-I подхода было зарегистрировано в 2002 году клиническим исследованием генной терапии Wiley - № 635 и 636. Этот подход показал многообещающие результаты при лечении шести различных злокачественных опухолей: глиобластомы , рака печени, толстая кишка, простата, матка и яичник (Совместная научная программа НАТО по генной терапии США, Франции, Польши, номер LST 980517, проводимая Дж. Трояном) (Trojan et al., 2012). Эта антигенная антисмысловая/тройная спиральная терапия доказала свою эффективность благодаря механизму одновременной остановки экспрессии IGF-I на уровнях трансляции и транскрипции, усилению противоопухолевых иммунных и апоптотических явлений.
2002 [ править ]
Серповидноклеточную анемию можно лечить у мышей. [170] Мыши, у которых по сути тот же дефект, что и у людей, использовали вирусный вектор, чтобы индуцировать выработку фетального гемоглобина (HbF), который обычно перестает вырабатываться вскоре после рождения. У людей использование гидроксимочевины для стимуляции выработки HbF временно облегчает симптомы серповидноклеточной анемии. Исследователи продемонстрировали, что это лечение является более постоянным средством увеличения терапевтического производства HbF. [171]
Новый подход генной терапии исправил ошибки в информационной РНК, полученной из дефектных генов. Этот метод потенциально может помочь в лечении талассемии , муковисцидоза и некоторых видов рака. [172]
Исследователи создали липосомы диаметром 25 нанометров, которые могут переносить терапевтическую ДНК через поры ядерной мембраны . [173]
2003 [ править ]
В 2003 году исследовательская группа впервые ввела гены в мозг. Они использовали липосомы, покрытые полимером под названием полиэтиленгликоль , который, в отличие от вирусных векторов, достаточно мал, чтобы преодолевать гематоэнцефалический барьер . [174]
Короткие фрагменты двухцепочечной РНК (короткие интерферирующие РНК или миРНК ) используются клетками для деградации РНК определенной последовательности. Если миРНК спроектирована так, чтобы соответствовать РНК, скопированной из дефектного гена, то аномальный белковый продукт этого гена производиться не будет. [175]
Гендицин — это генная терапия рака, которая доставляет супрессор опухоли ген- р53 с использованием сконструированного аденовируса . В 2003 году он был одобрен в Китае для лечения плоскоклеточного рака головы и шеи . [31]
2006 [ править ]
В марте исследователи объявили об успешном использовании генной терапии для лечения двух взрослых пациентов с Х-сцепленной хронической гранулематозной болезнью — заболеванием, которое поражает миелоидные клетки и повреждает иммунную систему . Исследование впервые показало, что генная терапия может лечить миелоидную систему. [176]
В мае команда сообщила о способе предотвратить отторжение иммунной системой только что доставленного гена. [177] Подобно трансплантации органов , генная терапия сталкивается с этой проблемой. Иммунная система обычно распознает новый ген как чужеродный и отвергает клетки, несущие его. В исследовании использовалась недавно открытая сеть генов, регулируемая молекулами, известными как микроРНК . Эта естественная функция избирательно скрывала терапевтический ген в клетках иммунной системы и защищала его от открытия. Мыши, инфицированные геном, содержащим целевую последовательность микроРНК иммунных клеток, не отторгали этот ген.
В августе ученые успешно вылечили метастатическую меланому у двух пациентов, используя Т-клетки-киллеры, генетически перенацеленные на атаку раковых клеток. [178]
В ноябре исследователи сообщили об использовании VRX496, генной иммунотерапии для лечения ВИЧ , в которой используется лентивирусный вектор для доставки антисмыслового гена против оболочки ВИЧ . В первой фазе клинических испытаний пять пациентов с хронической ВИЧ-инфекцией, у которых не было эффекта как минимум на две схемы антиретровирусной терапии лечились . Однократная внутривенная инфузия аутологичных CD4 Т-клеток, генетически модифицированных VRX496, хорошо переносилась. У всех пациентов была стабильная или сниженная вирусная нагрузка; у четырех из пяти пациентов было стабильное или повышенное количество Т-клеток CD4. У всех пяти пациентов наблюдался стабильный или повышенный иммунный ответ на антигены ВИЧ и другие патогены . Это была первая оценка лентивирусного вектора, введенного в клинических испытаниях на людях в США. [179] [180]
2007 [ править ]
В мае исследователи объявили о первом испытании генной терапии наследственного заболевания сетчатки . Первая операция была проведена 23-летнему британцу Роберту Джонсону в начале 2007 года. [181]
2008 [ править ]
Врожденный амавроз Лебера — наследственное заболевание, вызывающее слепоту, вызванное мутациями гена RPE65 . Результаты небольшого клинического исследования на детях были опубликованы в апреле. [17] Доставка рекомбинантного аденоассоциированного вируса (AAV), несущего RPE65, дала положительные результаты. В мае еще две группы сообщили о положительных результатах независимых клинических испытаний использования генной терапии для лечения этого заболевания. Во всех трех клинических исследованиях у пациентов восстановилось функциональное зрение без видимых побочных эффектов. [17] [18] [19] [20]
2009 [ править ]
В сентябре исследователи смогли дать трихроматическое зрение обезьянам беличьим . [182] В ноябре 2009 года исследователи остановили смертельное генетическое заболевание , называемое адренолейкодистрофией, у двух детей, используя лентивирусный вектор для доставки функционирующей версии ABCD1 , гена, который мутирует при этом заболевании. [183]
2010-е [ править ]
2010 [ править ]
В апрельской статье сообщалось, что генная терапия лечит ахроматопсию (дальтонизм) у собак, воздействуя на фоторецепторы колбочек . У двух молодых особей функция колбочек и дневное зрение восстанавливались в течение как минимум 33 месяцев. Терапия была менее эффективной для пожилых собак. [184]
В сентябре было объявлено, что 18-летний пациент мужского пола во Франции бета-талассемии . успешно вылечился от большой [185] Большая бета-талассемия — это наследственное заболевание крови , при котором отсутствует бета-гемоглобин , и пациенты зависят от регулярных переливаний крови на протяжении всей жизни . [186] В этом методе использовался лентивирусный вектор для преобразования человеческого гена β-глобина в очищенные клетки крови и костного мозга , полученные от пациента в июне 2007 года. [187] Уровень гемоглобина у пациента был стабильным и составлял от 9 до 10 г/дл. Около трети гемоглобина содержало форму, введенную вирусным вектором, и переливание крови не требовалось. [187] [188] Были запланированы дальнейшие клинические испытания. [189] Трансплантация костного мозга — единственное лекарство от талассемии, но 75% пациентов не находят подходящего донора. [188]
Иммуногенная терапия рака с использованием модифицированного антигена, антисмыслового подхода/тройной спирали была внедрена в Южной Америке в 2010/11 году в Университете Ла-Сабаны, Богота (Этический комитет, 14 декабря 2010 г., № P-004-10). Учитывая этический аспект генной диагностики и генной терапии, нацеленной на IGF-I, лечили опухоли, экспрессирующие IGF-I, то есть рак легких и эпидермиса (Trojan et al. 2016). [190] [191]
2011 [ править ]
В 2007 и 2008 годах мужчина ( Тимоти Рэй Браун ) был излечен от ВИЧ путем повторной трансплантации гемопоэтических стволовых клеток (см. также аллогенная трансплантация стволовых клеток , аллогенная трансплантация костного мозга , аллотрансплантация ) с двойной мутацией дельта-32, которая отключает рецептор CCR5 . Это лекарство было принято медицинским сообществом в 2011 году. [192] Это потребовало полной абляции существующего костного мозга , что очень изнурительно. [193]
В августе было подтверждено, что двое из трех участников пилотного исследования излечились от хронического лимфоцитарного лейкоза (ХЛЛ). В терапии использовались генетически модифицированные Т-клетки для атаки клеток, экспрессирующих белок CD19 , для борьбы с заболеванием. [26] В 2013 году исследователи объявили, что 26 из 59 пациентов достигли полной ремиссии, а у первоначального пациента не было опухоли. [194]
плазмидной ДНК человека HGF Терапия кардиомиоцитов , рассматривается как потенциальное средство лечения ишемической болезни сердца а также лечения повреждений сердца после инфаркта миокарда . [195] [196]
В 2011 году Неоваскулген был зарегистрирован в России как первый в своем классе генотерапевтический препарат для лечения заболеваний периферических артерий , в том числе критической ишемии конечностей ; он доставляет ген, кодирующий VEGF . [32] Неоваскулоген представляет собой плазмиду , кодирующую промотор CMV , состоящую из 165 аминокислот и форму VEGF . [197] [198]
2012 [ править ]
В июле FDA одобрило клинические испытания фазы I на пациентах с тяжелой талассемией в США с участием 10 участников. [199] Ожидалось, что исследование продлится до 2015 года. [189]
В июле 2012 года Европейское агентство по лекарственным средствам впервые рекомендовало одобрить лечение генной терапией как в Европе, так и в США. В лечении использовался Alipogene typarvovec (Glybera) для компенсации дефицита липопротеинлипазы , который может вызвать тяжелый панкреатит . [200] Рекомендация была одобрена Европейской комиссией в ноябре 2012 года. [16] [33] [201] [202] а коммерческое внедрение началось в конце 2014 года. [203] Ожидалось, что в 2012 году стоимость одного курса лечения алипогеном типарвовеком составит около 1,6 миллиона долларов. [204] пересмотрен до 1 миллиона долларов в 2015 году, [205] что делало его самым дорогим лекарством в мире на тот момент. [206] По состоянию на 2016 год [update]Препарат получали только пациенты, проходившие лечение в клинических исследованиях, и пациент, заплативший полную стоимость лечения. [207]
В декабре 2012 года сообщалось, что 10 из 13 пациентов с множественной миеломой находились в состоянии ремиссии «или очень близко к ней» через три месяца после инъекции лечения с использованием генно-инженерных Т-клеток , нацеленных на белки NY-ESO-1 и LAGE-1. , которые существуют только на раковых клетках миеломы. [28]
2013 [ править ]
В марте исследователи сообщили, что трое из пяти взрослых пациентов с острым лимфоцитарным лейкозом (ОЛЛ) находились в состоянии ремиссии от пяти месяцев до двух лет после лечения генетически модифицированными Т-клетками , которые атаковали клетки с генами CD19 на поверхности, то есть все В-клетки. раковая или нет. Исследователи полагали, что иммунная система пациентов через пару месяцев выработает нормальные Т- и В-клетки. Им также давали костный мозг. У одного пациента случился рецидив и он умер, а еще один умер от тромба, не связанного с заболеванием. [27]
После обнадеживающих испытаний фазы I в апреле исследователи объявили, что начинают клинические испытания фазы II (называемые CUPID2 и SERCA-LVAD) на 250 пациентах. [208] в нескольких больницах для борьбы с сердечно-сосудистыми заболеваниями . Терапия была разработана для повышения уровня SERCA 2, белка в сердечных мышцах, и улучшения мышечной функции. [209] США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) присвоило этому препарату статус революционной терапии , чтобы ускорить процесс испытаний и одобрения. [210] В 2016 году сообщалось, что в исследовании CUPID 2 улучшений не обнаружено. [211]
В июле исследователи сообщили об обнадеживающих результатах лечения шести детей с двумя тяжелыми наследственными заболеваниями частично деактивированным лентивирусом для замены дефектного гена через 7–32 месяца. У троих детей была метахроматическая лейкодистрофия , из-за которой дети теряют когнитивные и двигательные навыки. [212] У других детей был синдром Вискотта-Олдрича , который делает их уязвимыми для инфекций, аутоиммунных заболеваний и рака. [213] Последующие испытания генной терапии на еще шести детях с синдромом Вискотта-Олдрича также были названы многообещающими. [214] [215]
В октябре исследователи сообщили, что двое детей, родившихся с тяжелым комбинированным иммунодефицитом аденозиндезаминазы (ADA-SCID), 18 месяцев назад лечились генно-инженерными стволовыми клетками, и что их иммунная система демонстрирует признаки полного выздоровления. Еще трое детей добились прогресса. [24] В 2014 году еще 18 детей с ADA-SCID были вылечены с помощью генной терапии. [216] У детей ADA-SCID не функционирует иммунная система, и их иногда называют «детями-пузырями». [24]
Также в октябре исследователи сообщили, что в начале 2011 года они лечили шесть человек с гемофилией с помощью аденоассоциированного вируса. Спустя два года все шестеро начали производить фактор свертывания крови . [24] [217]
2014 [ править ]
В январе исследователи сообщили, что шесть пациентов с хоридеремией лечились аденоассоциированным вирусом с копией REP1 . За период от шести месяцев до двух лет у всех улучшилось зрение. [66] [218] К 2016 году 32 пациента получили положительные результаты лечения, и исследователи надеялись, что лечение будет длительным. [21] Хороидеремия — наследственное генетическое заболевание глаз, не имеющее одобренного лечения и приводящее к потере зрения.
В марте исследователи сообщили, что с 2009 года 12 пациентов с ВИЧ лечились с помощью генно-инженерного вируса с редкой мутацией ( дефицит CCR5 ), который, как известно, защищает от ВИЧ, и дали многообещающие результаты. [219] [220]
Клинические испытания генной терапии серповидноклеточной анемии начались в 2014 году. [221] [222]
В феврале LentiGlobin BB305 , препарат генной терапии, проходящий клинические испытания для лечения бета-талассемии, получил статус «прорыва» FDA после того, как несколько пациентов смогли отказаться от частых переливаний крови, обычно необходимых для лечения этого заболевания. [223]
В марте исследователи ввели рекомбинантный ген , кодирующий антитело широкого нейтрализующего действия , обезьянам, зараженным ВИЧ-инфекцией обезьян ; клетки обезьян выработали антитела , которые очистили их от ВИЧ. Этот метод называется иммунопрофилактикой путем переноса генов (IGT). В настоящее время проводятся испытания на животных на наличие антител к лихорадке Эбола, малярии, гриппу и гепатиту. [224] [225]
В марте ученые, в том числе изобретательница CRISPR , Дженнифер Дудна призвали ввести во всем мире мораторий на генную терапию зародышевой линии, написав: «Ученым следует избегать даже попыток, в слабых юрисдикциях, модификации генома зародышевой линии для клинического применения у людей» до тех пор, пока все последствия «не будут определены». обсуждается среди научных и правительственных организаций». [147] [148] [149] [150]
В декабре ученые крупнейших академий мира призвали ввести мораторий на наследуемые правки генома человека , в том числе связанные с CRISPR-Cas9. технологиями [226] но фундаментальные исследования, включая редактирование генов эмбрионов, должны продолжаться. [227]
2015 [ править ]
Исследователи успешно вылечили мальчика с буллезным эпидермолизом, используя кожные трансплантаты, выращенные из его собственных клеток кожи, генетически измененных для устранения мутации, вызвавшей его заболевание. [228]
В ноябре исследователи объявили, что они лечили девочку Лейлу Ричардс экспериментальным методом с использованием донорских Т-клеток, генетически модифицированных с помощью TALEN для атаки раковых клеток. Через год после лечения у нее все еще не было рака (высокоагрессивная форма острого лимфобластного лейкоза [ОЛЛ]). [229] Дети с высокоагрессивным ОЛЛ обычно имеют очень плохой прогноз, а до начала лечения болезнь Лейлы считалась терминальной. [230] [231]
2016 [ править ]
В апреле Комитет по лекарственным препаратам для использования человеком Европейского агентства по лекарственным средствам одобрил метод генной терапии под названием «Стримвелис». [232] [233] и Европейская комиссия одобрила его в июне. [234] Это лечит детей, рожденных с дефицитом аденозиндезаминазы и у которых не функционирует иммунная система. Это второй метод генной терапии, одобренный в Европе. [235]
В октябре китайские ученые сообщили, что начали исследование по генетической модификации Т-клеток у 10 взрослых пациентов с раком легких и повторной инъекции модифицированных Т-клеток обратно в их тела для атаки на раковые клетки. Из Т-клеток был удален белок PD-1 (который останавливает или замедляет иммунный ответ) с помощью CRISPR-Cas9. [236] [237]
2016 года Кокрейновский систематический обзор , в котором рассматриваются данные четырех исследований по местной генной терапии регулятором трансмембранной проводимости муковисцидоза (CFTR), не подтверждает его клиническое использование в виде тумана, вдыхаемого в легкие, для лечения пациентов с муковисцидозом и легочными инфекциями. В одном из четырех исследований были обнаружены слабые доказательства того, что терапия по переносу гена CFTR на основе липосом может привести к небольшому улучшению дыхания у людей с МВ. Этих слабых доказательств недостаточно, чтобы дать клинические рекомендации по рутинной генной терапии CFTR. [238]
2017 [ править ]
В феврале Kite Pharma объявила о результатах клинического исследования CAR-T -клеток примерно на сотне человек с неходжкинской лимфомой на поздней стадии . [239]
В марте французские ученые сообщили о клинических исследованиях генной терапии для лечения серповидноклеточной анемии . [240]
В августе FDA одобрило тисагенлеклейцел для лечения острого лимфобластного лейкоза . [241] Тисагенлеклейцел представляет собой адоптивную терапию переносом клеток при остром В-клеточном лимфобластном лейкозе; Т-клетки у человека, больного раком, удаляют, подвергают генетической инженерии для создания специфического рецептора Т-клеток (химерного рецептора Т-клеток, или «CAR-T»), который реагирует на рак, и вводят обратно человеку. Т-клетки созданы для воздействия на белок CD19 , который является общим для В-клеток. Это первая форма генной терапии, одобренная в США. В октябре аналогичная терапия под названием аксикабтаген цилолеуцел была одобрена для лечения неходжкинской лимфомы. [242]
В октябре биофизик и биохакер Джозайя Зейнер заявил, что осуществил самое первое редактирование человеческого генома in vivo в форме самостоятельной терапии. [243] [244]
13 ноября ученые-медики, работающие с Sangamo Therapeutics со штаб-квартирой в Ричмонде, штат Калифорния , объявили о первой в истории терапии редактирования генов человека внутри тела . [245] [246] Лечение, предназначенное для постоянного внедрения здоровой версии дефектного гена, вызывающего синдром Хантера , было проведено 44-летнему Брайану Мадо и является частью первого в мире исследования по постоянному редактированию ДНК внутри человеческого тела. [247] Позже успех внедрения гена был подтвержден. [248] [249] Клинические испытания Sangamo, включающие редактирование генов с использованием нуклеазы цинковых пальцев (ZFN), продолжаются. [250]
В декабре были опубликованы результаты применения аденоассоциированного вируса с фактором свертывания крови VIII для лечения девяти гемофилией А. больных У шести из семи пациентов, получавших высокие дозы, уровень свертываемости крови VIII повысился до нормального уровня. Режимы низких и средних доз не оказали влияния на уровень свертываемости крови пациента. [251] [252]
В декабре FDA одобрило Luxturna , первую генную терапию in vivo для лечения слепоты, вызванной врожденным амаврозом Лебера . [253] Цена этого лечения составляет 850 000 долларов США за оба глаза. [254] [255]
2019 [ править ]
В мае FDA одобрило онасемноген абепарвовек (Золгенсма) для лечения спинальной мышечной атрофии у детей в возрасте до двух лет. Прейскурантная цена Золгенсмы была установлена на уровне 2,125 миллиона долларов США за дозу, что сделало его самым дорогим препаратом за всю историю. [256]
В мае EMA одобрило бетабеглоген аутотемцел (Зинтегло) для лечения бета-талассемии у людей двенадцати лет и старше. [257] [258]
В июле компании Allergan и Editas Medicine объявили о проведении I/II фазы клинических испытаний AGN-151587 для лечения врожденного амавроза Лебера 10. [259] Это первое исследование CRISPR на основе in vivo терапии редактирования генов человека , при которой редактирование происходит внутри человеческого тела. [260] Первое внедрение системы CRISPR-Cas было подтверждено в марте 2020 года. [261]
2020-е годы [ править ]
2020 [ править ]
В мае онасемноген абепарвовек (Золгенсма) был одобрен Европейским Союзом для лечения спинальной мышечной атрофии у людей, которые либо имеют клинические симптомы СМА 1 типа, либо имеют не более трех копий гена , SMN2 независимо от массы тела или возраст. [262]
В августе компания Audentes Therapeutics сообщила, что трое из 17 детей с Х-сцепленной миотубулярной миопатией , участвовавших в клинических испытаниях генной терапии AT132 на основе AAV8, умерли. Было высказано предположение, что лечение, дозировка которого зависит от массы тела, оказывает непропорционально токсическое воздействие на более тяжелых пациентов, поскольку трое умерших пациентов были тяжелее остальных. [263] [264] Испытание было приостановлено. [265]
15 октября Комитет по лекарственным средствам для человеческого применения (CHMP) Европейского агентства по лекарственным средствам (EMA) принял положительное заключение, рекомендуя выдать регистрационное удостоверение на лекарственный препарат Либмелди (аутологичная популяция, обогащенная CD34+ клетками, содержащая гемопоэтические стволовые клетки). и клетки-предшественники, трансдуцированные ex vivo с использованием лентивирусного вектора, кодирующего ген арилсульфатазы А человека), генная терапия для лечения детей с «поздней инфантильной» (LI) или «ранней ювенильной» (EJ) формами метахроматической лейкодистрофии (MLD). . [266] Активное вещество Либмелди состоит из собственных стволовых клеток ребенка, которые были модифицированы и содержат рабочие копии гена ARSA. [266] Когда модифицированные клетки вводятся обратно пациенту в виде однократной инфузии, ожидается, что клетки начнут вырабатывать фермент ARSA, который разрушает накопление сульфатидов в нервных клетках и других клетках тела пациента. [267] Либмелди был одобрен для медицинского использования в ЕС в декабре 2020 года. [268]
15 октября французская биотехнологическая компания Lysogene сообщила о смерти пациента, получившего LYS-SAF302, экспериментальный метод генной терапии мукополисахаридоза типа IIIA (синдром Санфилиппо типа А). [269]
2021 [ править ]
В мае сообщалось о новом методе с использованием измененной версии ВИЧ в качестве лентивирусного вектора при лечении 50 детей с ADA-SCID, получив положительные результаты у 48 из них. [270] [271] [272] Ожидается, что этот метод будет более безопасным, чем ретровирусные векторы, обычно используемые в предыдущих исследованиях ТКИД, где развитие лейкемии . обычно наблюдалось [273] и уже использовался в 2019 году, но в меньшей группе с X-SCID. [274] [275] [276] [277]
В июне клиническое исследование на шести пациентах, страдающих транстиретиновым амилоидозом, показало снижение концентрации неправильно свернутого белка транстретина (TTR) в сыворотке за счет на основе CRISPR инактивации гена TTR в клетках печени, наблюдая среднее снижение на 52% и 87% среди нижних слоев. и группы с более высокими дозами. Это было сделано in vivo без изъятия клеток у пациента для их редактирования и повторного введения позже. [278] [279] [280]
В июле были опубликованы результаты небольшого исследования фазы I генной терапии , в котором сообщалось о наблюдении восстановления дофамина у семи пациентов в возрасте от 4 до 9 лет, страдающих дефицитом декарбоксилазы ароматических L-аминокислот (дефицит AADC). [281] [282] [283]
2022 [ править ]
первой в истории генной терапии болезни Тея-Сакса В феврале было объявлено о . В ней используется аденоассоциированный вирус для доставки правильной инструкции гену HEXA в клетки головного мозга, вызывающему заболевание. Только двое детей участвовали в сострадательном исследовании, в котором были продемонстрированы улучшения по сравнению с естественным течением заболевания и отсутствие побочных эффектов, связанных с переносчиками инфекции . [284] [285] [286]
В мае эладокаген эксупарвовек рекомендован для одобрения Европейской комиссии. [287] [288]
В июле были объявлены результаты кандидата на генную терапию гемофилии B под названием FLT180. Он работает с использованием аденоассоциированного вируса (AAV) для восстановления белка фактора свертывания крови IX (FIX), нормальные уровни белка наблюдались при низких дозах препарата. терапия, но для снижения риска иммунных реакций, связанных с переносчиками, была необходима иммуносупрессия. [289] [290] [291]
В декабре 13-летняя девочка, у которой был диагностирован острый Т-клеточный лимфобластный лейкоз, была успешно вылечена в больнице Грейт-Ормонд-Стрит (GOSH) в ходе первого задокументированного применения терапевтического редактирования генов для этой цели после шестимесячного экспериментального курса. лечения, где все попытки других методов лечения оказались безуспешными. Процедура включала перепрограммирование здоровой Т-клетки для уничтожения раковых Т-клеток, чтобы сначала избавить ее от лейкемии, а затем восстановление ее иммунной системы с использованием здоровых иммунных клеток. [292] Команда GOSH использовала редактирование BASE и ранее лечила случай острого лимфобластного лейкоза в 2015 году с использованием TALEN . [231]
2023 [ править ]
В мае FDA одобрило Вьювек для лечения ран у пациентов с дистрофическим буллезным эпидермолизом (DEB), который применяется в виде геля для местного применения, доставляющего вектор вируса простого герпеса 1 типа (ВПГ-1), кодирующий альфа-1-цепь коллагена VII типа. ( COL7A1 ) ген, который дисфункционален у людей, пораженных DEB. Одно исследование показало, что 65% ран, обработанных Вьювеком, полностью закрылись, в то время как только 26% ран, обработанных плацебо, через 24 недели. [95] Также сообщалось о его использовании в качестве глазных капель пациенту с ДЭБ, у которого была потеря зрения из-за обширного образования волдырей, с хорошими результатами. [293]
В июне FDA дало ускоренное одобрение препарата Элевидис для лечения мышечной дистрофии Дюшенна (МДД) только для мальчиков в возрасте от 4 до 5 лет, поскольку они с большей вероятностью получат пользу от терапии, состоящей из однократной внутривенной инфузии вируса (вектор AAV rh74). ), который доставляет функционирующий ген «микродистрофина» (138 кДа ) в мышечные клетки, чтобы действовать вместо нормального дистрофина (427 кДа), который мутирует при этом заболевании. [100]
В июле сообщалось, что разработан новый метод воздействия на экспрессию генов посредством постоянного тока. [294]
Список генной терапии
- Генная терапия дальтонизма
- Генная терапия эпилепсии
- Генная терапия остеоартрита
- Генная терапия при болезни Паркинсона
- Генная терапия сетчатки человека
Генная терапия находится в стадии разработки для:
- синдром Ашера, глухота
- отоферлина Мутационная глухота
Ссылки [ править ]
- ^ Кадзи Э.Х., Лейден Дж.М. (февраль 2001 г.). «Генная терапия и стволовые клетки» . ДЖАМА . 285 (5): 545–550. дои : 10.1001/jama.285.5.545 . ПМИД 11176856 .
- ^ Ермак Г (2015). Новые медицинские технологии . Всемирная научная. ISBN 978-981-4675-81-9 .
- ^ Исследования, Центр оценки биологических препаратов (9 декабря 2020 г.). «Что такое генная терапия?» . FDA .
- ^ Розенберг С.А., Эберсолд П., Корнетта К., Касид А., Морган Р.А., Моен Р. и др. (август 1990 г.). «Перенос генов человеку - иммунотерапия пациентов с прогрессирующей меланомой с использованием проникающих в опухоль лимфоцитов, модифицированных трансдукцией ретровирусных генов» . Медицинский журнал Новой Англии . 323 (9): 570–578. дои : 10.1056/NEJM199008303230904 . ПМИД 2381442 .
- ↑ Перейти обратно: Перейти обратно: а б «Всемирная база данных клинических испытаний генной терапии» . Журнал генной медицины . Уайли. Июнь 2016. Архивировано из оригинала 31 июля 2020 года.
- ^ Горелл Э., Нгуен Н., Лейн А., Сипрашвили З. (апрель 2014 г.). «Генная терапия заболеваний кожи» . Перспективы Колд-Спринг-Харбора в медицине . 4 (4): а015149. doi : 10.1101/cshperspect.a015149 . ПМЦ 3968787 . ПМИД 24692191 .
- ^ Циммер С (16 сентября 2013 г.). «Двойной дубль ДНК» . Нью-Йорк Таймс . Архивировано из оригинала 2 января 2022 года.
- ^ «Некролог Лоррейн Краус» . Коммерческий призыв . Проверено 7 июля 2023 г.
- ^ «Генная терапия» . WhatIsBiotechnology.org . Фонд образования в области биотехнологии и медицины (Биотехмет) . Проверено 7 июля 2023 г.
- ^ Конгресс США, Управление по оценке технологий (декабрь 1984 г.). Генная терапия человека – Справочный документ . Издательство ДИАНА. ISBN 978-1-4289-2371-3 .
- ^ Сунь М (октябрь 1982 г.). «Мартин Клайн проигрывает апелляцию по гранту НИЗ». Наука . 218 (4567): 37. Бибкод : 1982Sci...218...37S . дои : 10.1126/science.7123214 . ПМИД 7123214 .
- ^ Ловенштейн PR (2008). «Генная терапия неврологических расстройств: новые методы лечения или эксперименты на людях?» . В Берли Дж., Харрис Дж. (ред.). Компаньон генетики . Джон Уайли и сыновья. ISBN 978-0-470-75637-9 .
- ↑ Перейти обратно: Перейти обратно: а б Шеридан С. (февраль 2011 г.). «Генная терапия находит свою нишу». Природная биотехнология . 29 (2): 121–128. дои : 10.1038/nbt.1769 . ПМИД 21301435 . S2CID 5063701 .
- ^ О'Мэлли BW, Ледли FD (октябрь 1993 г.). «Соматическая генная терапия. Методы настоящего и будущего». Арка Отоларингол Хирургия головы и шеи . 119 (10): 1100–7. дои : 10.1001/archotol.1993.01880220044007 . ПМИД 8398061 .
- ^ Олдфилд Э.Х., Рэм З., Калвер К.В., Блез Р.М., ДеВрум Х.Л., Андерсон В.Ф. (февраль 1993 г.). «Генная терапия для лечения опухолей головного мозга с использованием внутриопухолевой трансдукции геном тимидинкиназы и внутривенного введения ганцикловира». Генная терапия человека . 4 (1): 39–69. дои : 10.1089/hum.1993.4.1-39 . ПМИД 8384892 .
- ↑ Перейти обратно: Перейти обратно: а б с Ричардс С. (6 ноября 2012 г.). «Генная терапия приходит в Европу» . Ученый .
- ↑ Перейти обратно: Перейти обратно: а б с д Магуайр А.М., Симонелли Ф., Пирс Э.А., Пью Э.Н., Мингоцци Ф., Бенничелли Дж. и др. (май 2008 г.). «Безопасность и эффективность переноса генов при врожденном амаврозе Лебера» . Медицинский журнал Новой Англии . 358 (21): 2240–2248. doi : 10.1056/NEJMoa0802315 . ПМЦ 2829748 . ПМИД 18441370 .
- ↑ Перейти обратно: Перейти обратно: а б Симонелли Ф., Магуайр А.М., Теста Ф., Пирс Э.А., Мингоцци Ф., Бенничелли Дж.Л. и др. (март 2010 г.). «Генная терапия врожденного амавроза Лебера безопасна и эффективна в течение 1,5 лет после введения вектора» . Молекулярная терапия . 18 (3): 643–650. дои : 10.1038/mt.2009.277 . ПМЦ 2839440 . ПМИД 19953081 .
- ↑ Перейти обратно: Перейти обратно: а б Сидециан А.В., Хаусвирт В.В., Алеман Т.С., Каушал С., Шварц С.Б., Бойе С.Л., Виндзор Э.А., Конлон Т.Дж., Сумарока А., Роман А.Дж., Бирн Б.Дж., Джейкобсон С.Г. (август 2009 г.). «Зрение через 1 год после генной терапии врожденного амавроза Лебера» . Медицинский журнал Новой Англии . 361 (7): 725–727. дои : 10.1056/NEJMc0903652 . ПМЦ 2847775 . ПМИД 19675341 .
- ↑ Перейти обратно: Перейти обратно: а б Бейнбридж Дж.В., Смит А.Дж., Баркер С.С., Робби С., Хендерсон Р., Балагган К. и др. (май 2008 г.). «Влияние генной терапии на зрительную функцию при врожденном амаврозе Лебера». Медицинский журнал Новой Англии . 358 (21): 2231–2239. doi : 10.1056/NEJMoa0802268 . hdl : 10261/271174 . ПМИД 18441371 .
- ↑ Перейти обратно: Перейти обратно: а б Гош П. (28 апреля 2016 г.). «Генная терапия обращает вспять потерю зрения и действует надолго» . Новости BBC онлайн . Проверено 29 апреля 2016 г.
- ^ Фишер А., Хасейн-Бей-Абина С., Каваццана-Кальво М. (июнь 2010 г.). «20 лет генной терапии ТКИН». Природная иммунология . 11 (6): 457–460. дои : 10.1038/ni0610-457 . ПМИД 20485269 . S2CID 11300348 .
- ^ Ферруа Ф, Бригида I, Аюти А (декабрь 2010 г.). «Обновленная информация о генной терапии тяжелого комбинированного иммунодефицита с дефицитом аденозиндезаминазы». Современное мнение в области аллергии и клинической иммунологии . 10 (6): 551–556. дои : 10.1097/ACI.0b013e32833fea85 . ПМИД 20966749 . S2CID 205435278 .
- ↑ Перейти обратно: Перейти обратно: а б с д и Геддес Л. (30 октября 2013 г.). « Успех «ребенка-пузыря» возвращает генную терапию в нужное русло» . Новый учёный . Проверено 2 января 2022 г.
- ^ Картье Н., Обур П. (июль 2010 г.). «Трансплантация гемопоэтических стволовых клеток и генная терапия гемопоэтическими стволовыми клетками при Х-сцепленной адренолейкодистрофии» . Патология головного мозга . 20 (4): 857–862. дои : 10.1111/j.1750-3639.2010.00394.x . ПМЦ 8094635 . ПМИД 20626747 . S2CID 24182017 .
- ↑ Перейти обратно: Перейти обратно: а б Ледфорд Х (2011). «Клеточная терапия борется с лейкемией». Природа . дои : 10.1038/news.2011.472 .
- ↑ Перейти обратно: Перейти обратно: а б Коглан А. (26 марта 2013 г.). «Генная терапия лечит лейкемию за восемь дней» . Новый учёный . Проверено 15 апреля 2013 г.
- ↑ Перейти обратно: Перейти обратно: а б Коглан А. (11 декабря 2013 г.). «Усиленные иммунные клетки приводят к ремиссии лейкемии» . Новый учёный . Проверено 15 апреля 2013 г.
- ^ Левитт П.А., Резай А.Р., Лихи М.А., Оджеманн С.Г., Флаэрти А.В., Эскандар Э.Н. и др. (апрель 2011 г.). «Генная терапия AAV2-GAD для лечения прогрессирующей болезни Паркинсона: двойное слепое рандомизированное исследование, контролируемое ложной хирургической операцией». «Ланцет». Неврология . 10 (4): 309–319. дои : 10.1016/S1474-4422(11)70039-4 . ПМИД 21419704 . S2CID 37154043 .
- ^ Герпер М. (26 марта 2014 г.). «Большое возвращение генной терапии» . Форбс . Проверено 28 апреля 2014 г.
- ↑ Перейти обратно: Перейти обратно: а б Пирсон С., Цзя Х., Кандачи К. (январь 2004 г.). «Китай одобряет первую генную терапию» . Природная биотехнология . 22 (1): 3–4. дои : 10.1038/nbt0104-3 . ПМК 7097065 . ПМИД 14704685 .
- ↑ Перейти обратно: Перейти обратно: а б «Одобрена генная терапия при ЗПА» . 6 декабря 2011 года . Проверено 5 августа 2015 г.
- ↑ Перейти обратно: Перейти обратно: а б с Галлахер Дж. (2 ноября 2012 г.). «Генная терапия: Glybera одобрена Европейской комиссией» . Новости Би-би-си . Проверено 15 декабря 2012 г.
- ^ «Что такое генная терапия?» . Домашний справочник по генетике . 28 марта 2016 г. Архивировано из оригинала 6 апреля 2016 г. Проверено 2 января 2022 г.
- ^ «Как работает генная терапия?» . Домашний справочник по геномике . Национальная медицинская библиотека США.
- ^ Пеццоли Д., Кьеза Р., Де Нардо Л., Кандиани Дж. (сентябрь 2012 г.). «Нам еще предстоит пройти долгий путь до эффективной доставки генов!». Журнал прикладных биоматериалов и функциональных материалов . 10 (2): 82–91. дои : 10.5301/JABFM.2012.9707 . ПМИД 23015375 . S2CID 6283455 .
- ^ Ваннуччи Л., Лай М., Кьюппези Ф., Чеккерини-Нелли Л., Пистелло М. (январь 2013 г.). «Вирусные векторы: взгляд назад и вперед на технологию переноса генов». Новая микробиология . 36 (1): 1–22. ПМИД 23435812 .
- ^ Готелф А., Гейл Дж. (ноябрь 2012 г.). «Что вам всегда нужно было знать о ДНК-вакцинах на основе электропорации» . Человеческие вакцины и иммунотерапия . 8 (11): 1694–1702. дои : 10.4161/hv.22062 . ПМК 3601144 . ПМИД 23111168 .
- ^ Урнов Ф.Д., Ребар Э.Дж., Холмс М.К., Чжан Х.С., Грегори П.Д. (сентябрь 2010 г.). «Редактирование генома с помощью модифицированных нуклеаз цинковых пальцев». Обзоры природы Генетика . 11 (9): 636–646. дои : 10.1038/nrg2842 . ПМИД 20717154 . S2CID 205484701 .
- ↑ Перейти обратно: Перейти обратно: а б Бак Р.О., Гомес-Оспина Н., Портеус М.Х. (август 2018 г.). «Редактирование генов в центре внимания». Тенденции в генетике . 34 (8): 600–611. дои : 10.1016/j.tig.2018.05.004 . ПМИД 29908711 . S2CID 49269023 .
- ^ Стоун Д., Нийонзима Н., Джером КР (сентябрь 2016 г.). «Редактирование генома и противовирусная терапия нового поколения» . Генетика человека . 135 (9): 1071–82. дои : 10.1007/s00439-016-1686-2 . ПМК 5002242 . ПМИД 27272125 .
- ^ Кросс Д., Бурместер Дж.К. (сентябрь 2006 г.). «Генная терапия для лечения рака: прошлое, настоящее и будущее» . Клиническая медицина и исследования . 4 (3): 218–27. дои : 10.3121/cmr.4.3.218 . ПМК 1570487 . ПМИД 16988102 .
- ^ Медер М.Л., Герсбах, Калифорния (март 2016 г.). «Технологии редактирования генома для генной и клеточной терапии» . Молекулярная терапия . 24 (3): 430–46. дои : 10.1038/mt.2016.10 . ПМЦ 4786923 . ПМИД 26755333 .
- ^ «Испытания показывают, что ученые впервые осуществили редактирование генов «внутри тела»» . АП НОВОСТИ . 7 февраля 2019 года . Проверено 17 ноября 2020 г.
- ^ «Первая дозировка CRISPR-терапии» . Природная биотехнология . 38 (4): 382. 1 апреля 2020 г. doi : 10.1038/s41587-020-0493-4 . ISSN 1546-1696 . ПМИД 32265555 . S2CID 215406440 .
- ↑ Перейти обратно: Перейти обратно: а б Шерков Дж.С., Зеттлер П.Дж., Грили Х.Т. (декабрь 2018 г.). «Это «генная терапия»?» . Журнал права и биологических наук . 5 (3): 786–793. дои : 10.1093/jlb/lsy020 . ПМК 6534757 . ПМИД 31143463 .
- ^ Асале А., Чжоу Дж., Рахманян Н. (ноябрь 2022 г.). « Письмо в редакцию: урок на будущее — Как семантическая неоднозначность привела к распространению антинаучных взглядов на мРНК-вакцины от COVID-19» . Генная терапия человека . 33 (21–22): 1213–1216. doi : 10.1089/hum.2022.29223.aas (неактивен 31 января 2024 г.). ПМИД 36375123 .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на январь 2024 г. ( ссылка ) - ^ «Эндрю Бриджен неправильно называл мРНК-вакцины генной терапией» . Полный факт . 12 января 2023 г. Проверено 19 февраля 2023 г.
- ^ «Вакцины Fact Check-mRNA отличаются от генной терапии, которая изменяет гены реципиента» . Рейтер . 10 августа 2021 г. Проверено 19 февраля 2023 г.
- ^ «Джо Роган ложно утверждает, что мРНК-вакцины — это «генная терапия» » . ПолитиФакт . Проверено 19 февраля 2023 г.
- ^ Спенсер С.Х. (28 июня 2022 г.). «Веб-сайт торгует старой, опровергнутой ложью о мРНК-вакцинах против COVID-19» . FactCheck.org . Проверено 19 февраля 2023 г.
- ^ «Эти эксперты говорят, что Джо Роган «чрезвычайно опасен» для общества – и вот почему» . Независимый . 2 февраля 2022 г. Проверено 19 февраля 2023 г.
- ^ «Ложные заявления депутата Эндрю Бриджена ставят под угрозу жизни людей» . Полный факт . 11 января 2023 г. Проверено 19 февраля 2023 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и Нобрега К., Мендонса Л., Матос К.А. (2020). Справочник по генной и клеточной терапии . Чам: Спрингер. ISBN 978-3-030-41333-0 . OCLC 1163431307 .
- ^ Уильямс Д.А., Оркин С.Х. (апрель 1986 г.). «Соматическая генная терапия. Современное состояние и перспективы» . Журнал клинических исследований . 77 (4): 1053–6. дои : 10.1172/JCI112403 . ПМЦ 424438 . ПМИД 3514670 .
- ^ Мавилио Ф, Феррари G (июль 2008 г.). «Генетическая модификация соматических стволовых клеток. Развитие, проблемы и перспективы новой терапевтической технологии» . Отчеты ЭМБО . 9 (Приложение 1): S64–69. дои : 10.1038/embor.2008.81 . ПМЦ 3327547 . ПМИД 18578029 .
- ↑ Перейти обратно: Перейти обратно: а б с «Международное право» . Центр генетики и государственной политики Берманского института биоэтики Университета Джонса Хопкинса. 2010. Архивировано из оригинала 2 сентября 2014 года.
- ^ Страчнан Т., Рид AP (2004). Молекулярная генетика человека (3-е изд.). Издательство «Гирлянда». п. 616 . ISBN 978-0-8153-4184-0 .
- ^ Ханна К. (2006). «Перенос генов зародышевой линии» . Национальный институт исследования генома человека.
- ^ «Клонирование человека и генетическая модификация» . Ассоциация представителей репродуктивного здоровья. 2013. Архивировано из оригинала 18 июня 2013 года.
- ^ «Генная терапия» . ama-assn.org . 4 апреля 2014 г. Архивировано из оригинала 15 марта 2015 г. Проверено 22 марта 2015 г.
- ^ «Часто задаваемые вопросы по генной и клеточной терапии | ASGCT — Американское общество генной и клеточной терапии | ASGCT — Американское общество генной и клеточной терапии» . asgct.org . Проверено 23 июля 2021 г.
- ^ «Оценка клинического успеха генной терапии ex vivo и in vivo» . Журнал юных исследователей . Январь 2009 года . Проверено 23 июля 2021 г.
- ^ «Проблемы генной терапии» . Learn.genetics.utah.edu . Проверено 23 июля 2021 г.
- ^ Маллард А. (июнь 2020 г.). «Конвейер редактирования генов набирает обороты». Обзоры природы. Открытие наркотиков . 19 (6): 367–372. дои : 10.1038/d41573-020-00096-y . ПМИД 32415249 . S2CID 218657910 .
- ↑ Перейти обратно: Перейти обратно: а б Макларен Р.Э., Гропп М., Барнард А.Р., Коттриалл С.Л., Толмачева Т., Сеймур Л., Кларк К.Р., Во время MJ, Кремерс Ф.П., Блэк GC, Лотери А.Дж., Даунс С.М., Вебстер А.Р., Сибра MC (март 2014 г.). «Генная терапия сетчатки у пациентов с хоридеремией: первые результаты клинического исследования фазы 1/2» . Ланцет . 383 (9923): 1129–1137. дои : 10.1016/S0140-6736(13)62117-0 . ПМК 4171740 . ПМИД 24439297 .
- ^ Девер Д.П., Бак Р.О., Рейниш А., Камарена Дж., Вашингтон Дж., Николас С.Э. и др. (ноябрь 2016 г.). «Нацеливание на ген CRISPR/Cas9 β-глобина в гемопоэтических стволовых клетках человека» . Природа . 539 (7629): 384–389. Бибкод : 2016Natur.539..384D . дои : 10.1038/nature20134 . ПМЦ 5898607 . ПМИД 27820943 .
- ^ Гупта Р.М., Мусунуру К. (октябрь 2014 г.). «Расширение набора инструментов генетического редактирования: ZFN, TALEN и CRISPR-Cas9» . Журнал клинических исследований . 124 (10): 4154–61. дои : 10.1172/JCI72992 . ПМК 4191047 . ПМИД 25271723 .
- ^ Санчес-да-Сильва Г.Н., Медейрос Л.Ф., Лима FM (21 августа 2019 г.). «Потенциальное использование системы CRISPR-Cas для генной терапии ВИЧ-1» . Международный журнал геномики . 2019 : 8458263. doi : 10.1155/2019/8458263 . ПМК 6721108 . ПМИД 31531340 .
- ^ Патент: US7824869B2.
- ^ Би А, Цуй Дж, Ма Ю.П., Ольшевская Е, Пу М, Дижоор А.М., Пан Ж. (апрель 2006 г.). «Эктопическая экспрессия родопсина микробного типа восстанавливает зрительные реакции у мышей с дегенерацией фоторецепторов» . Нейрон . 50 (1): 23–33. дои : 10.1016/j.neuron.2006.02.026 . ПМК 1459045 . ПМИД 16600853 .
- ↑ Перейти обратно: Перейти обратно: а б Сун, Сянжун; Лю, Чао; Ван, Нин; Хуан, Хай; Он, Сиян; Гонг, Чанъян; Вэй, Юйцюань (1 января 2021 г.). «Поставка систем CRISPR/Cas для генной терапии и иммунотерапии рака» . Обзоры расширенной доставки лекарств . Доставка биомакромолекул для терапевтического редактирования генома. 168 : 158–180. дои : 10.1016/j.addr.2020.04.010 . ISSN 0169-409X . ПМИД 32360576 . S2CID 218493473 .
- ^ Найероссадат Н., Маеде Т., Али П.А. (2012). «Вирусные и невирусные системы доставки генов» . Передовые биомедицинские исследования . 1 (1): 27. дои : 10.4103/2277-9175.98152 . ПМК 3507026 . ПМИД 23210086 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж Гинн С.Л., Амайя А.К., Александр И.Е., Эдельштейн М., Абеди М.Р. (май 2018 г.). «Клинические испытания генной терапии во всем мире до 2017 года: обновленная информация» . Журнал генной медицины . 20 (5): e3015. дои : 10.1002/jgm.3015 . ПМИД 29575374 . S2CID 4966300 .
- ↑ Перейти обратно: Перейти обратно: а б Бульча Дж.Т., Ван Й., Ма Х., Тай П.В., Гао Дж. (февраль 2021 г.). «Платформы вирусных векторов в сфере генной терапии» . Сигнальная трансдукция и таргетная терапия . 6 (1): 53. дои : 10.1038/s41392-021-00487-6 . ПМЦ 7868676 . ПМИД 33558455 .
- ^ Дженсен, Томас Лет; Гётше, Каспер Рене; Уолдбай, Дэвид П.Д. (2021). «Текущие и будущие перспективы генной терапии редких генетических заболеваний, поражающих головной и спинной мозг» . Границы молекулярной нейронауки . 14 : 695937. doi : 10.3389/fnmol.2021.695937 . ISSN 1662-5099 . ПМЦ 8527017 . ПМИД 34690692 .
- ^ Манини А, Абати Е, Нуредини А, Корти С, Гран-при Коми (2022). «Генная терапия, опосредованная аденоассоциированным вирусом (AAV), при мышечной дистрофии Дюшенна: проблема персистенции трансгенов» . Границы в неврологии . 12 : 814174. doi : 10.3389/fneur.2021.814174 . ПМЦ 8797140 . ПМИД 35095747 .
- ↑ Перейти обратно: Перейти обратно: а б с Сабатино Д.Е., Бушман Ф.Д., Чендлер Р.Дж., Кристал Р.Г., Дэвидсон Б.Л., Долметш Р. и др. (август 2022 г.). «Оценка состояния науки об интеграции аденоассоциированных вирусов: комплексный взгляд» . Молекулярная терапия . 30 (8): 2646–2663. дои : 10.1016/j.ymthe.2022.06.004 . ПМЦ 9372310 . ПМИД 35690906 .
- ^ «Генная терапия неоваскулярной возрастной макулярной дегенерации путем субретинальной доставки RGX-314: исследование фазы 1/2а с увеличением дозы». Ланцет . ПМИД 38554726 .
- ^ «Безопасность и эффективность иксоберогена соропарвовека при неоваскулярной возрастной дегенерации желтого пятна в США (OPTIC): проспективное двухлетнее многоцентровое исследование фазы 1». ЭККлиническая медицина . ПМИД 38152412 .
- ^ Инь Х., Канасти Р.Л., Элтухи А.А., Вегас А.Дж., Доркин Дж.Р., Андерсон Д.Г. (август 2014 г.). «Невирусные векторы для генной терапии». Обзоры природы. Генетика . 15 (8): 541–555. дои : 10.1038/nrg3763 . ПМИД 25022906 . S2CID 15273455 .
- ^ Красильникова О.; Якимова А.; Иванов С.; Атиакшин Д.; Костин А.А.; Сосин Д.; Шегай, П.; Каприн А.Д.; Клабуков И. (2023). «Генно-активированные материалы в регенеративной стоматологии: описательный обзор технологий и результатов исследований» . Международный журнал молекулярных наук . 24 (22): 16250. doi : 10.3390/ijms242216250 . ISSN 1422-0067 . ПМЦ 10671237 . ПМИД 38003439 .
- ^ Фолдвари, М.; Чен, Д.В.; Нафиси, Н.; Кальдерон, Д.; Нарсинени, Л.; Рафи, А. (2016). «Невирусная генная терапия: преимущества и проблемы неинвазивных методов введения» . Журнал контролируемого выпуска . 240 : 165–190. дои : 10.1016/j.jconrel.2015.12.012 . ISSN 1873-4995 . ПМИД 26686079 .
- ^ Бертран Н., Гренье П., Махмуди М., Лима Э.М., Аппель Э.А., Дормон Ф. и др. (октябрь 2017 г.). «Механистическое понимание формирования белковой короны in vivo на полимерных наночастицах и влияние на фармакокинетику» . Природные коммуникации . 8 (1): 777. Бибкод : 2017NatCo...8..777B . дои : 10.1038/s41467-017-00600-w . ПМК 5626760 . ПМИД 28974673 .
- ↑ Перейти обратно: Перейти обратно: а б с Госвами Р., Субраманиан Г., Силаева Л., Ньюкирк И., Доктор Д., Чавла К. и др. (24 апреля 2019 г.). «Генная терапия создает порочный круг» . Границы онкологии . 9 : 297. doi : 10.3389/fonc.2019.00297 . ПМК 6491712 . ПМИД 31069169 .
- ^ Вирт Т., Паркер Н., Юля-Херттуала С. (август 2013 г.). «История генной терапии». Джин . 525 (2): 162–169. дои : 10.1016/j.gene.2013.03.137 . ПМИД 23618815 .
- ^ Сингх В., Хан Н., Джаяндхаран Г.Р. (май 2022 г.). «Векторная инженерия, стратегии и цели в генной терапии рака». Генная терапия рака . 29 (5): 402–417. дои : 10.1038/s41417-021-00331-7 . ПМИД 33859378 . S2CID 233258994 .
- ^ Ангела XM, High KA (январь 2019 г.). «Вступая в современную эпоху генной терапии» . Ежегодный обзор медицины . 70 (1): 273–288. doi : 10.1146/annurev-med-012017-043332 . ПМИД 30477394 . S2CID 53750215 .
- ^ Ван Ю, Чжан Р., Тан Л., Ян Л. (февраль 2022 г.). «Невирусные системы доставки мРНК-вакцин для генной терапии рака» . Фармацевтика . 14 (3): 512. doi : 10.3390/pharmaceutics14030512 . ПМЦ 8949480 . ПМИД 35335891 .
- ^ Монга И., Куреши А., Тхакур Н., Гупта А.К., Кумар М. (сентябрь 2017 г.). «ASPsiRNA: ресурс ASP-siRNA, обладающий терапевтическим потенциалом в отношении генетических нарушений человека, и алгоритм прогнозирования их ингибирующей эффективности» . Г3 . 7 (9): 2931–2943. дои : 10.1534/g3.117.044024 . ПМК 5592921 . ПМИД 28696921 .
- ↑ Перейти обратно: Перейти обратно: а б Оловойе А., Оквунду CI (ноябрь 2020 г.). «Генная терапия серповидноклеточной анемии» . Кокрановская база данных систематических обзоров . 2020 (11): CD007652. дои : 10.1002/14651858.CD007652.pub7 . ПМЦ 8275984 . ПМИД 33251574 .
- ^ Чен В., Ху Ю, Цзюй Д. (август 2020 г.). «Генная терапия нейродегенеративных заболеваний: достижения, идеи и перспективы» . Акта Фармацевтика Синика Б. 10 (8): 1347–1359. дои : 10.1016/j.apsb.2020.01.015 . ПМЦ 7488363 . ПМИД 32963936 .
- ^ «FDA одобрило первую генную терапию для детей с метахроматической лейкодистрофией» .
- ^ «Orchard Therapeutics получает одобрение ЕС на препарат Libmeldy для лечения метахроматической лейкодистрофии с ранним началом (MLD)» (пресс-релиз). Садовая терапия. 21 декабря 2020 г. Проверено 23 июля 2021 г. - через GlobeNewswire.
- ↑ Перейти обратно: Перейти обратно: а б Комиссар Управления (19 мая 2023 г.). «FDA одобрило первый метод местной генной терапии для лечения ран у пациентов с буллезным дистрофическим эпидермолизом» . FDA . Проверено 31 июля 2023 г.
- ^ Офис комиссара (17 августа 2022 г.). «FDA одобрило первую клеточную генную терапию для лечения взрослых и детей с бета-талассемией, которым требуется регулярное переливание крови» . FDA . Проверено 31 августа 2022 г.
- ^ «FDA одобрило первую клеточную генную терапию для взрослых пациентов с рецидивирующим или рефрактерным MCL» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 24 июля 2020 г. Проверено 24 июля 2020 г.
- ^ «FDA одобрило аутолейцел брексукабтагена для лечения рецидивирующего или рефрактерного острого лимфобластного лейкоза-предшественника В-клеток» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 1 октября 2021 г. Проверено 2 октября 2021 г.
- ^ «Текарт» . Европейское агентство по лекарственным средствам . 13 октября 2020 г.
- ↑ Перейти обратно: Перейти обратно: а б Комиссар Управления (23 июня 2023 г.). «FDA одобрило первую генную терапию для лечения некоторых пациентов с мышечной дистрофией Дюшенна» . FDA . Проверено 12 июля 2023 г.
- ^ «Касжеви» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 8 декабря 2023 г. Проверено 8 декабря 2023 г.
- ^ «Абекма (idecabtagene vicleucel)» . США Управление по контролю за продуктами и лекарствами (FDA). 21 апреля 2021 г.
- ^ «Бреянзи (лизокабтаген маралеуцел)» . США Управление по контролю за продуктами и лекарствами (FDA). 4 марта 2021 г.
- ^ «Лифгения» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 8 декабря 2023 года. Архивировано из оригинала 8 декабря 2023 года . Проверено 9 декабря 2023 г.
- ^ «FDA одобрило первую генную терапию для лечения неинвазивного рака мочевого пузыря высокого риска» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 16 декабря 2022 г. Проверено 16 декабря 2022 г.
- ^ «Золгенсма» . США Управление по контролю за продуктами и лекарствами (FDA). 16 марта 2021 г.
- ^ «Одобренное EMA приложение для Zolgensma» . Aetion (Пресс-релиз) . Проверено 23 июля 2021 г.
- ^ «FDA одобрило T-VEC для лечения метастатической меланомы - Национальный институт рака» . Национальный институт рака . 25 ноября 2015 года . Проверено 23 июля 2021 г.
- ^ «Имлыгический» . Европейское агентство лекарственных средств (EMA) . 17 сентября 2018 г.
- ^ «Первая генная терапия для лечения тяжелой гемофилии А» . Европейское агентство лекарственных средств (EMA) (пресс-релиз). 24 июня 2022 года. Архивировано из оригинала 26 июня 2022 года . Проверено 26 июня 2022 г.
- ^ «Роктавиан: Ожидается решение ЕС» . Европейское агентство лекарственных средств (EMA) . 23 июня 2022 года. Архивировано из оригинала 26 июня 2022 года . Проверено 26 июня 2022 г.
- ^ «Роктавиан» . Союзный реестр лекарственных средств . 25 августа 2022 г. Проверено 6 сентября 2022 г.
- ^ «FDA одобрило новую генную терапию для лечения пациентов с редкой формой наследственной потери зрения» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 24 марта 2020 г. Проверено 23 июля 2021 г.
- ^ «Люкстурна» . Европейское агентство лекарственных средств (EMA) . 24 сентября 2018 г.
- ^ Го, Цунтин; Ма, Сяотэн; Гао, Фэй; Го, Юйсюань (9 марта 2023 г.). «Нецелевые эффекты при редактировании генов CRISPR/Cas9» . Границы биоинженерии и биотехнологии . 11 : 1143157. doi : 10.3389/fbioe.2023.1143157 . ISSN 2296-4185 . ПМЦ 10034092 . ПМИД 36970624 .
- ^ У, Шао-Шуай; Ли, Цин-Цуй; Инь, Чан-Цин; Сюэ, Вэнь; Сун, Чунь-Цин (15 марта 2020 г.). «Достижения в области генной терапии на основе CRISPR/Cas при генетических заболеваниях человека» . Тераностика . 10 (10): 4374–4382. дои : 10.7150/thno.43360 . ISSN 1838-7640 . ПМК 7150498 . ПМИД 32292501 .
- ^ Кортхоф Г. «Значение обратной связи Стила от сомы к зародышевой линии для генной терапии человека» .
- ^ Вудс Н.Б., Боттеро В., Шмидт М., фон Калле С., Верма И.М. (апрель 2006 г.). «Генная терапия: терапевтический ген, вызывающий лимфому» . Природа . 440 (7088): 1123. Бибкод : 2006Natur.440.1123W . дои : 10.1038/4401123а . ПМИД 16641981 . S2CID 4372110 .
- ^ Трэшер А.Дж., Гаспар Х.Б., Баум С., Модлич У., Шамбах А., Кандотти Ф. и др. (сентябрь 2006 г.). «Генная терапия: трансгенная лейкемогенность X-SCID». Природа . 443 (7109): Е5-6, обсуждение Е6-7. Бибкод : 2006Natur.443E...5T . дои : 10.1038/nature05219 . ПМИД 16988659 . S2CID 4301764 .
- ^ Бак Р.О., Портеус М.Х. (июль 2017 г.). «CRISPR-опосредованная интеграция больших кассет генов с использованием донорских векторов AAV» . Отчеты по ячейкам . 20 (3): 750–756. дои : 10.1016/j.celrep.2017.06.064 . ПМЦ 5568673 . ПМИД 28723575 .
- ^ Роян С.Ю. (11 февраля 2014 г.). «Геномная хирургия» . Обзор технологий Массачусетского технологического института . Архивировано из оригинала 15 февраля 2014 года . Проверено 17 февраля 2014 г.
- ^ «Генной терапии нужен герой, который сможет оправдать шумиху» . Новый учёный . 30 октября 2013 года . Проверено 2 января 2022 г.
- ^ Красто AM (7 июля 2013 г.). «Глибера – самый дорогой препарат в мире и первая одобренная на Западе генная терапия» . Все о наркотиках . Проверено 2 ноября 2013 г.
- ^ «Генная терапия» . Окриджская национальная лаборатория . 20 декабря 2012 года. Архивировано из оригинала 20 декабря 2012 года . Проверено 2 января 2022 г.
- ^ Рэпер С.Э., Чирмул Н., Ли Ф.С., Вивел Н.А., Бэгг А., Гао Г.П. и др. (сентябрь 2003 г.). «Синдром фатального системного воспалительного ответа у пациента с дефицитом орнитинтранскарбамилазы после переноса аденовирусного гена». Молекулярная генетика и обмен веществ . 80 (1–2): 148–58. дои : 10.1016/j.ymgme.2003.08.016 . ПМИД 14567964 .
- ^ Фрэнк К.М., Хогарт Д.К., Миллер Дж.Л., Мандал С., Мис П.Дж., Самульски Р.Дж. и др. (июль 2009 г.). «Расследование причины смерти в ходе исследования генной терапии» . Медицинский журнал Новой Англии . 361 (2): 161–9. дои : 10.1056/NEJMoa0801066 . ПМИД 19587341 .
- ^ Комитет по этике Хьюго (апрель 2001 г.). «Заявление об исследованиях в области генной терапии» (PDF) . Организация генома человека . Архивировано из оригинала (PDF) 7 сентября 2008 года.
- ^ Исаси Р.М., Нгуен Т.М., Кнопперс Б.М. (октябрь 2006 г.). «Национальная нормативно-правовая база в отношении технологий генетической модификации человека (соматическая модификация и модификация зародышевой линии)» (PDF) . Центр генетики и государственной политики. Архивировано из оригинала (PDF) 17 сентября 2014 года.
- ^ «Главная страница — Реестр генетических тестов NIH (GTR) — NCBI» . www.ncbi.nlm.nih.gov . Проверено 2 мая 2022 г.
- ↑ Перейти обратно: Перейти обратно: а б «Руководство Национального института здравоохранения США по исследованиям молекул рекомбинантных или синтетических нуклеиновых кислот» . Национальные институты здравоохранения США . Апрель 2016. Архивировано из оригинала 28 мая 2016 года.
- ^ «Читайте отчет Бельмонта» . HHS.gov . 15 января 2018 года . Проверено 2 января 2022 г.
- ^ Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (14 октября 1993 г.). «Применение действующих законодательных актов к продуктам соматической клеточной терапии человека и продуктам генной терапии» (PDF) . Федеральный реестр . 58 (197). Архивировано (PDF) из оригинала 21 июня 2009 г.
- ^ «Руководство для промышленности: Руководство по соматической клеточной терапии и генной терапии человека» . FDA.gov . 9 июля 2009 года. Архивировано из оригинала 9 июля 2009 года . Проверено 2 января 2022 г.
- ^ «Генный допинг ВАДА» . ВАДА. Архивировано из оригинала 21 ноября 2009 года . Проверено 27 сентября 2013 г.
- ^ Кайзер Б., Маурон А., Миа А. (март 2007 г.). «Текущая антидопинговая политика: критическая оценка» . Медицинская этика BMC . 8 :2. дои : 10.1186/1472-6939-8-2 . ЧВК 1851967 . ПМИД 17394662 .
- ^ Пауэлл Р., Бьюкенен А. (февраль 2011 г.). «Разрыв цепей эволюции: перспектива преднамеренной генетической модификации человека». Журнал медицины и философии . 36 (1): 6–27. дои : 10.1093/jmp/jhq057 . ПМИД 21228084 .
- ^ Бэйлис Ф., Роберт Дж.С. (2004). «Неизбежность технологий генетического улучшения». Биоэтика . 18 (1): 1–26. дои : 10.1111/j.1467-8519.2004.00376.x . ПМИД 15168695 .
- ^ Эванс Дж (2002). Играя в Бога?: Генная инженерия человека и рационализация общественных биоэтических дебатов . Издательство Чикагского университета. ISBN 978-0-226-22262-2 .
- ^ «Центр этики здоровья - Медицинский факультет Университета Миссури - Генная терапия и генная инженерия» . Ethics.missouri.edu . 3 декабря 2013 года. Архивировано из оригинала 3 декабря 2013 года . Проверено 2 января 2022 г.
- ^ Роко MC, Бейнбридж WS (2002). «Конвергентные технологии для улучшения деятельности человека: интеграция на наноуровне». Журнал исследований наночастиц . 4 (4): 281–295. Бибкод : 2002JNR.....4..281R . дои : 10.1023/A:1021152023349 . S2CID 136290217 .
- ^ Аллхофф Ф. (март 2005 г.). «Генетическое улучшение зародышевой линии и первичные товары Ролза» (PDF) . Журнал Института этики Кеннеди . 15 (1): 39–56. CiteSeerX 10.1.1.566.171 . дои : 10.1353/ken.2005.0007 . ПМИД 15881795 . S2CID 14432440 . Архивировано (PDF) из оригинала 30 января 2012 года.
- ^ Раниш Р. (январь 2020 г.). «Специальный выпуск: Редактирование зародышевой линии человека» . Биоэтика . 34 (1): 1–143.
- ^ «Этические вопросы, связанные с пренатальным генетическим тестированием. Совет по этическим и юридическим вопросам Американской медицинской ассоциации». Архив семейной медицины . 3 (7): 633–642. Июль 1994 г. doi : 10.1001/archfami.3.7.633 . ПМИД 7921302 .
- ^ «Декларация Инуямы: картирование генома человека, генетический скрининг и генная терапия» . Совет международных организаций медицинских наук . Архивировано из оригинала 5 августа 2001 года.
- ^ Смит К.Р., Чан С., Харрис Дж. (октябрь 2012 г.). «Генетическая модификация зародышевой линии человека: научные и биоэтические перспективы». Архивы медицинских исследований . 43 (7): 491–513. doi : 10.1016/j.arcmed.2012.09.003 . ПМИД 23072719 .
- ^ Рирдон С. (14 февраля 2017 г.). «Американские научные консультанты намечают путь к генетически модифицированным детям» . Природа . дои : 10.1038/nature.2017.21474 .
- ↑ Перейти обратно: Перейти обратно: а б Уэйд Н. (19 марта 2015 г.). «Ученые добиваются запрета метода редактирования генома человека» . Нью-Йорк Таймс . Архивировано из оригинала 2 января 2022 года . Проверено 20 марта 2015 г.
- ↑ Перейти обратно: Перейти обратно: а б Поллак А (3 марта 2015 г.). «Новый мощный способ редактирования ДНК» . Нью-Йорк Таймс . Архивировано из оригинала 2 января 2022 года . Проверено 20 марта 2015 г.
- ↑ Перейти обратно: Перейти обратно: а б Балтимор Д., Берг П., Ботчан М., Кэрролл Д., Чаро Р.А., Чёрч Дж. и др. (апрель 2015 г.). «Биотехнология. Разумный путь вперед в области геномной инженерии и модификации генов зародышевой линии» . Наука . 348 (6230): 36–38. Бибкод : 2015Sci...348...36B . дои : 10.1126/science.aab1028 . ПМЦ 4394183 . ПМИД 25791083 .
- ↑ Перейти обратно: Перейти обратно: а б Ланфье Э., Урнов Ф., Хеккер С.Е., Вернер М., Смоленски Дж. (март 2015 г.). «Не редактируйте зародышевую линию человека» . Природа . 519 (7544): 410–411. Бибкод : 2015Natur.519..410L . дои : 10.1038/519410a . ПМИД 25810189 .
- ^ Лян П., Сюй Ю, Чжан Х, Дин С., Хуан Р., Чжан З. и др. (май 2015 г.). «CRISPR/Cas9-опосредованное редактирование генов в трехпронуклеарных зиготах человека» . Белок и клетка . 6 (5): 363–372. дои : 10.1007/s13238-015-0153-5 . ПМЦ 4417674 . ПМИД 25894090 .
- ^ Колата Г (23 апреля 2015 г.). «Китайские ученые редактируют гены человеческих эмбрионов, вызывая обеспокоенность» . Нью-Йорк Таймс . Архивировано из оригинала 2 января 2022 года . Проверено 24 апреля 2015 г.
- ^ Хармон А (14 февраля 2017 г.). «Редактирование человеческого гена получает поддержку научной группы» . Нью-Йорк Таймс . ISSN 0362-4331 . Архивировано из оригинала 2 января 2022 года . Проверено 17 февраля 2017 г.
- ^ Комитет по редактированию генов человека: научные, медицинские и этические соображения. «Редактирование генома человека: наука, этика и управление» . Nationalacademies.org . Национальная академия наук; Национальная Медицинская Академия . Проверено 21 февраля 2017 г.
- ^ «Ученые занимаются генной инженерией младенцев» . Нью-Йорк Пост . Рейтер. 14 февраля 2017 года . Проверено 17 февраля 2017 г.
- ^ Фридман Т., Роблин Р. (март 1972 г.). «Генная терапия генетических заболеваний человека?». Наука . 175 (4025): 949–955. Бибкод : 1972Sci...175..949F . дои : 10.1126/science.175.4025.949 . ПМИД 5061866 . S2CID 19952096 .
- ^ Роджерс С., New Scientist 1970, стр. 194
- ^ Чепко CL, Робертс BE, Маллиган RC (июль 1984 г.). «Создание и применение высокотрансмиссивного челночного вектора мышиного ретровируса. Этот вектор используется для проникновения в клетку человеческого тела». Клетка . 37 (3): 1053–1062. дои : 10.1016/0092-8674(84)90440-9 . ПМИД 6331674 . S2CID 34544709 .
- ^ «Первая генная терапия» . Фонд наук о жизни. 21 июня 2011 года. Архивировано из оригинала 28 ноября 2012 года . Проверено 7 января 2014 г.
- ^ Блезе Р.М., Калвер К.В., Миллер А.Д., Картер К.С., Флейшер Т., Клеричи М. и др. (октябрь 1995 г.). «Генная терапия, направленная на Т-лимфоциты, при ADA-SCID: первые результаты испытаний через 4 года» . Наука . 270 (5235): 475–480. Бибкод : 1995Sci...270..475B . дои : 10.1126/science.270.5235.475 . ПМИД 7570001 . S2CID 46339645 .
- ^ Троян Дж., Джонсон Т.Р., Рудин С.Д., Илан Дж., Тыкочински М.Л., Илан Дж. (январь 1993 г.). «Лечение и профилактика глиобластомы крыс с помощью иммуногенных клеток C6, экспрессирующих антисмысловую РНК инсулиноподобного фактора роста I». Наука . 259 (5091): 94–97. Бибкод : 1993Sci...259...94T . дои : 10.1126/science.8418502 . ПМИД 8418502 .
- ↑ Перейти обратно: Перейти обратно: а б Троян Дж., Пан YX, Вэй М.Х., Ли А., Шевелев А., Бирваген М. и др. (2012). «Методология антигенной анти-IGF-I терапии злокачественных опухолей» . Исследования и практика химиотерапии . 2012 : 1–12. дои : 10.1155/2012/721873 . ПМК 3287029 . ПМИД 22400112 .
- ^ Эбботт А. (апрель 1992 г.). «Генная терапия. Итальянцы первыми применили стволовые клетки» . Природа . 356 (6369): 465. Бибкод : 1992Natur.356..465A . дои : 10.1038/356465a0 . ПМИД 1560817 . S2CID 4319842 .
- ^ Каваццана-Кальво М., Трэшер А., Мавилио Ф. (февраль 2004 г.). «Будущее генной терапии». Природа . 427 (6977): 779–781. Бибкод : 2004Natur.427..779C . дои : 10.1038/427779a . ПМИД 14985734 . S2CID 4421364 .
- ^ Блейксли С. (18 мая 1993 г.). «Лечение «болезни мальчика-пузыря» » . Нью-Йорк Таймс . ISSN 0362-4331 . Проверено 9 февраля 2018 г.
- ^ Нальдини, Луиджи; Блёмер, Ульрике; Галлай, Филипп; Ори, Дэниел; Маллиган, Ричард; Гейдж, Фред Х.; Верма, Индер М.; Троно, Дидье (12 апреля 1996 г.). «Доставка генов in vivo и стабильная трансдукция неделящихся клеток лентивирусным вектором» . Наука . 272 (5259): 263–267. Бибкод : 1996Sci...272..263N . дои : 10.1126/science.272.5259.263 . ISSN 0036-8075 . ПМИД 8602510 . S2CID 18997464 .
- ^ Штейн Р. (11 октября 2010 г.). «Первый пациент, прошедший лечение в рамках исследования стволовых клеток» . Вашингтон Пост . Проверено 10 ноября 2010 г.
- ^ «Смерть побудила FDA приостановить исследование генной терапии артрита» . Медпейдж сегодня. 27 июля 2007 года . Проверено 10 ноября 2010 г.
- ^ Столберг С.Г. (22 января 2000 г.). «В университете приказано прекратить генную терапию» . Нью-Йорк Таймс . Проверено 10 ноября 2010 г.
- ^ Уилсон Дж. Ф. (18 марта 2002 г.). «Мышиная генная терапия корректирует симптомы серповидноклеточной анемии» . Ученый – журнал наук о жизни . Проверено 17 августа 2010 г.
- ^ «Генная терапия корректирует серповидноклеточную анемию в лабораторных исследованиях» . Детская исследовательская больница Св. Иуды . 4 декабря 2008 года . Проверено 29 декабря 2012 г. - через ScienceDaily.
- ^ Пенман Д. (11 октября 2002 г.). «Тонкая генная терапия борется с заболеваниями крови» . Новый учёный . Проверено 17 августа 2010 г.
- ^ «Наношарики ДНК ускоряют генную терапию» . Новый учёный . 12 мая 2002 года . Проверено 17 августа 2010 г.
- ^ Анантасвами А. (20 марта 2003 г.). «Тайные гены проникают в мозг» . Новый учёный . Проверено 17 августа 2010 г.
- ^ Холмс Р. (13 марта 2003 г.). «Генная терапия может выключить болезнь Хантингтона» . Новый учёный . Проверено 17 августа 2010 г.
- ^ Отт М.Г., Шмидт М., Шварцвальдер К., Штейн С., Силер У., Кёль У. и др. (апрель 2006 г.). «Коррекция Х-сцепленной хронической гранулематозной болезни с помощью генной терапии, дополненной инсерционной активацией MDS1-EVI1, PRDM16 или SETBP1» . Природная медицина . 12 (4): 401–409. дои : 10.1038/nm1393 . ПМИД 16582916 . S2CID 7601162 .
- ^ Браун Б.Д., Веннери М.А., Зингале А., Сержи Сержи Л., Налдини Л. (май 2006 г.). «Регуляция эндогенной микроРНК подавляет экспрессию трансгена в гемопоэтических линиях и обеспечивает стабильный перенос генов». Природная медицина . 12 (5): 585–591. дои : 10.1038/nm1398 . ПМИД 16633348 . S2CID 11114427 .
- ^ Морган Р.А., Дадли М.Э., Вундерлих Дж.Р., Хьюз М.С., Ян Дж.К., Шерри Р.М. и др. (октябрь 2006 г.). «Регрессия рака у больных после переноса генно-инженерных лимфоцитов» . Наука . 314 (5796): 126–129. Бибкод : 2006Sci...314..126M . дои : 10.1126/science.1129003 . ПМК 2267026 . ПМИД 16946036 .
- ^ Левин Б.Л., Юмо Л.М., Бойер Дж., МакГрегор Р.Р., Ребелло Т., Лу X и др. (ноябрь 2006 г.). «Перенос генов у человека с использованием условно реплицирующегося лентивирусного вектора» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (46): 17372–17377. Бибкод : 2006PNAS..10317372L . дои : 10.1073/pnas.0608138103 . ПМК 1635018 . ПМИД 17090675 .
- ^ «Penn Medicine представляет данные испытаний генной терапии ВИЧ на CROI 2009» . ЭврекАлерт! . 10 февраля 2009 года. Архивировано из оригинала 25 августа 2012 года . Проверено 19 ноября 2009 г.
- ^ «Генная терапия в первую очередь при плохом зрении» . Новости Би-би-си . 1 мая 2007 года . Проверено 3 мая 2010 г.
- ^ Долгин Э (2009). «Цветовая слепота, исправленная генной терапией» . Природа . дои : 10.1038/news.2009.921 .
- ^ Картье Н., Хасейн-Бей-Абина С., Бартоломе К.С., Верес Г., Шмидт М., Кучера И. и др. (ноябрь 2009 г.). «Генная терапия гемопоэтическими стволовыми клетками с использованием лентивирусного вектора при Х-сцепленной адренолейкодистрофии» (PDF) . Наука . 326 (5954): 818–823. Бибкод : 2009Sci...326..818C . дои : 10.1126/science.1171242 . ПМИД 19892975 . S2CID 27783 .
- ^ Комароми А.М., Александр Дж.Дж., Роулан Дж.С., Гарсия М.М., Чиодо В.А., Кая А. и др. (июль 2010 г.). «Генная терапия спасает функцию колбочки при врожденной ахроматопсии» . Молекулярная генетика человека . 19 (13): 2581–2593. дои : 10.1093/hmg/ddq136 . ПМЦ 2883338 . ПМИД 20378608 .
- ^ Каваццана-Кальво М., Пайен Э., Негре О., Ван Г., Хехир К., Фусил Ф. и др. (сентябрь 2010 г.). «Независимость от трансфузии и активация HMGA2 после генной терапии β-талассемии человека» . Природа . 467 (7313): 318–322. Бибкод : 2010Natur.467..318C . дои : 10.1038/nature09328 . ПМЦ 3355472 . ПМИД 20844535 .
- ^ Галанелло Р., Орига Р. (май 2010 г.). «Бета-талассемия» . Сиротский журнал редких заболеваний . 5:11 . дои : 10.1186/1750-1172-5-11 . ПМЦ 2893117 . ПМИД 20492708 .
- ↑ Перейти обратно: Перейти обратно: а б Билс Дж. К. (16 сентября 2010 г.). «Генная терапия освобождает пациента с бета-талассемией от переливания крови на 2+ года» . МедСкейп . Проверено 15 декабря 2012 г.
- ↑ Перейти обратно: Перейти обратно: а б Лебулш П. (20 марта 2013 г.). «Пятилетние результаты лентивирусной генной терапии бета-талассемии человека, уроки и перспективы» . Отчеты о талассемии . 3 (1 с): 108. doi : 10.4081/thal.2013.s1.e43 .
- ↑ Перейти обратно: Перейти обратно: а б Номер клинического исследования NCT01639690 для «Большая β-талассемия с аутологичными CD34+ гематопоэтическими клетками-предшественниками, трансдуцированными TNS9.3.55, лентивирусным вектором, кодирующим нормальный ген β-глобина человека» на сайте ClinicalTrials.gov
- ^ Троян А, Аристисабал Б.Х., Джей Л.М., Кастильо Т., Пенагос П.Дж., Брисеньо I, Троян Дж. (2016). «Тестирование биомаркера IGF-I в этическом контексте». Adv Modern Oncol Res . 2 (4): 188–200. doi : 10.18282/amor.v2.i4.58 (неактивен 31 января 2024 г.).
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на январь 2024 г. ( ссылка ) - ^ Кастильо Т., Троян А., Ногера М.С., Джей Л.М., Крейн С., Альварес А. и др. (2016). «Эпистемологический опыт разработки технологий молекулярной биологии для стратегии иммуногенной терапии » . Преподобный Сьен (на испанском языке). 2 (25): 228–240. doi : 10.14483//udistrital.jour.RC.2016.25.a6 .
- ^ Розенберг Т. (27 мая 2011 г.). «Человек, который излечился от ВИЧ, и что это значит для лечения СПИДа» . Нью-Йорк . Проверено 2 января 2022 г.
- ^ «Письма директора: Вспоминая Тимоти Рэя Брауна: борца за исследования в области лечения ВИЧ | Управление исследований СПИДа Национального института здравоохранения» . www.oar.nih.gov . Проверено 26 июня 2022 г.
- ^ «Генная терапия избавляет некоторых пациентов от лейкемии от рака. Будет ли она работать и при других видах рака?» . Центр сингулярности. 6 января 2014 года . Проверено 7 января 2014 г.
- ^ Ян З.Дж., Чжан Ю.Р., Чен Б., Чжан С.Л., Цзя Э.З., Ван Л.С. и др. (июль 2009 г.). «Фаза I клинического исследования интракоронарного введения Ad-hHGF для лечения тяжелой ишемической болезни сердца». Отчеты по молекулярной биологии . 36 (6): 1323–1329. дои : 10.1007/s11033-008-9315-3 . ПМИД 18649012 . S2CID 23419866 .
- ^ Хан В., Пьюн В.Б., Ким Д.С., Ю В.С., Ли С.Д., Вон Дж.Х. и др. (октябрь 2011 г.). «Усиленное кардиозащитное действие за счет совместной экспрессии двух изоформ фактора роста гепатоцитов из обнаженной плазмидной ДНК на модели ишемической болезни сердца у крыс». Журнал генной медицины . 13 (10): 549–555. дои : 10.1002/jgm.1603 . ПМИД 21898720 . S2CID 26812780 .
- ^ «Неоваскулоген» . Евролаб . Проверено 4 августа 2015 г.
- ^ Деев Р.В., Бозо И.Ю., Мжаванадзе Н.Д., Воронов Д.А., Гавриленко А.В., Червяков Ю.В. и др. (сентябрь 2015 г.). «Внутримышечный перенос гена pCMV-vegf165 — эффективный метод лечения пациентов с хронической ишемией нижних конечностей». Журнал сердечно-сосудистой фармакологии и терапии . 20 (5): 473–482. дои : 10.1177/1074248415574336 . ПМИД 25770117 . S2CID 13443907 .
- ^ «О раке: запуск исследования терапии стволовыми клетками дает надежду пациентам с наследственными заболеваниями крови» . Мемориальный онкологический центр Слоана-Кеттеринга. 16 июля 2012 года . Проверено 15 декабря 2012 г.
- ^ Поллак А (20 июля 2012 г.). «Европейское агентство рекомендует одобрить генную терапию» . Нью-Йорк Таймс . Проверено 2 января 2022 г.
- ^ «Первая генная терапия, одобренная Европейской комиссией» . UniQure (Пресс-релиз). 2 ноября 2012 года. Архивировано из оригинала 5 ноября 2012 года . Проверено 2 января 2022 г.
- ^ «Chiesi и uniQure откладывают запуск Glybera, чтобы добавить данные» . Биотехнология . Фармацевтическое письмо . 4 августа 2014 года . Проверено 28 августа 2014 г.
- ^ Бургер Л., Хиршлер Б. (26 ноября 2014 г.). «Первый препарат для генной терапии установил ценовой рекорд в миллион евро» . Рейтер . Проверено 30 марта 2015 г.
- ^ Уэлен Дж. (2 ноября 2012 г.). «Одобрение генной терапии знаменует собой важную веху» . Уолл Стрит Джорнал .
- ^ Моррисон С. (3 марта 2015 г.). «Установлен ценник в 1 миллион долларов за генную терапию Glybera» . Коммерческая тайна . 33 (3): 217–218. дои : 10.1038/nbt0315-217 . ПМИД 25748892 . S2CID 205266596 .
- ^ «Генная терапия впервые одобрена в Европе» . Архивировано из оригинала 4 января 2014 года.
- ^ Регаладо А (4 мая 2016 г.). «Самое дорогое лекарство в мире — крах» . Обзор технологий Массачусетского технологического института .
- ^ Босели С (30 апреля 2013 г.). «Новаторские испытания генной терапии дают надежду пациентам с сердечно-сосудистыми заболеваниями» . Хранитель . Проверено 28 апреля 2014 г.
- ^ «Новости сердечной генной терапии: Клиника врачей» . thePhysiciansclinic.co.uk . 8 сентября 2013 года. Архивировано из оригинала 29 апреля 2014 года . Проверено 2 января 2022 г.
- ^ «Селладон получил от FDA статус прорывной терапии для мидикара, нового, первого в своем классе разрабатываемого препарата для лечения сердечной недостаточности» . Селладон . 10 июля 2015 г. Архивировано из оригинала 10 июля 2015 г. Проверено 2 января 2022 г.
- ^ Фернандес-Руис I (март 2016 г.). «Генная терапия: отсутствие улучшения результатов при генной терапии сердечной недостаточности». Обзоры природы. Кардиология . 13 (3): 122–123. дои : 10.1038/nrcardio.2016.14 . ПМИД 26843287 . S2CID 205472001 .
- ^ Биффи А., Монтини Е., Лориоли Л., Чезани М., Фумагалли Ф., Плати Т. и др. (август 2013 г.). «Лентивирусная генная терапия гемопоэтическими стволовыми клетками приносит пользу при метахроматической лейкодистрофии» . Наука . 341 (6148): 1233158. doi : 10.1126/science.1233158 . ПМИД 23845948 . S2CID 206546808 .
- ^ Аюти А., Биаско Л., Скарамуцца С., Ферруа Ф., Чикалезе М.П., Барикорди С. и др. (август 2013 г.). «Лентивирусная генная терапия гемопоэтическими стволовыми клетками у пациентов с синдромом Вискотта-Олдрича» . Наука . 341 (6148): 1233151. doi : 10.1126/science.1233151 . ПМЦ 4375961 . ПМИД 23845947 .
- ^ Галлахер Дж. (21 апреля 2015 г.). «Генная терапия: «Прирученный ВИЧ» используется для лечения болезней» . Новости BBC, Здоровье . Проверено 21 апреля 2015 г.
- ^ Малех Х.Л., Окс HD (апрель 2015 г.). «Новая эра клинической пользы генной терапии». ДЖАМА . 313 (15): 1522–1523. дои : 10.1001/jama.2015.2055 . ПМИД 25898049 .
- ^ «Лечение генной терапией детей с болезнью «пузырного ребенка»» . Наука Дейли . 18 ноября 2014 г.
- ^ «Генная терапия обеспечивает безопасное и долгосрочное облегчение для пациентов с тяжелой формой гемофилии B» . Наука Дейли . 20 ноября 2014 г.
- ^ Беали А (25 января 2014 г.). «Генная терапия восстанавливает зрение людям с заболеваниями глаз» . Новый учёный . Проверено 25 января 2014 г.
- ^ Тебас П., Стейн Д., Тан В.В., Фрэнк И., Ван С.К., Ли Дж. и др. (март 2014 г.). «Редактирование гена CCR5 в аутологичных Т-клетках CD4 людей, инфицированных ВИЧ» . Медицинский журнал Новой Англии . 370 (10): 901–910. дои : 10.1056/NEJMoa1300662 . ПМК 4084652 . ПМИД 24597865 .
- ^ Дворский Г. (6 марта 2014 г.). «Ученые создают генетически модифицированные клетки, защищающие от ВИЧ» . io9, Биотехнология . Проверено 6 марта 2014 г.
- ^ Номер клинического исследования NCT02247843 «Генная терапия стволовыми клетками при серповидно-клеточной анемии» на сайте ClinicalTrials.gov.
- ^ Номер клинического исследования NCT00012545 «Сбор и хранение стволовых клеток пуповины для лечения серповидноклеточной анемии» на сайте ClinicalTrials.gov.
- ^ «Десять вещей из мира бизнеса, которые вы могли пропустить в понедельник» . Бостон Глобус . 3 февраля 2015 года . Проверено 13 февраля 2015 г.
- ^ Циммер С (9 марта 2015 г.). «Защита без вакцины» . Нью-Йорк Таймс . Архивировано из оригинала 2 января 2022 года . Проверено 30 марта 2015 г.
- ^ Гарднер М.Р., Каттенхорн Л.М., Кондур Х.Р., фон Шавен М., Дорфман Т., Чианг Дж.Дж. и др. (март 2015 г.). «AAV-экспрессируемый eCD4-Ig обеспечивает надежную защиту от множества инфекций, вызванных вирусом SHIV» . Природа . 519 (7541): 87–91. Бибкод : 2015Natur.519...87G . дои : 10.1038/nature14264 . ПМЦ 4352131 . ПМИД 25707797 .
- ^ Уэйд Н. (3 декабря 2015 г.). «Ученые вводят мораторий на изменения генома человека, которые могут передаваться по наследству» . Нью-Йорк Таймс . Архивировано из оригинала 2 января 2022 года . Проверено 3 декабря 2015 г.
- ^ Уолш Ф. (3 декабря 2015 г.). «Редактирование генов: приближается ли эра дизайнерских людей?» . BBC News Здоровье . Проверено 31 декабря 2015 г.
- ^ «Генетически измененная кожа спасла мальчика, умирающего от редкой болезни» . NPR.org .
- ^ Генри Р. (19 февраля 2017 г.). «Надежды на излечение от лейкемии растут, поскольку генная редактирование девочки» . Таймс . Проверено 20 февраля 2017 г.
- ^ Образец I (5 ноября 2015 г.). «Девочку впервые в мире лечат «созданными иммунными клетками» » . Хранитель . Проверено 6 ноября 2015 г.
- ↑ Перейти обратно: Перейти обратно: а б « Дизайнерские клетки» обращают вспять рак у годовалого ребенка» . Новости Би-би-си . 5 ноября 2015 года . Проверено 11 декабря 2022 г.
- ^ «Краткое заключение1 (первоначальное разрешение) Стримвелиса» (PDF) . Европейское агентство по лекарственным средствам . 1 апреля 2016 г. стр. 1–2. Архивировано из оригинала (PDF) 28 января 2018 года . Проверено 13 апреля 2016 г.
- ^ Хиршелер Б. (1 апреля 2016 г.). «Европа дает зеленый свет первой генной терапии для детей» . Рейтер . Проверено 13 апреля 2016 г.
- ^ Ривз Р. (6 июня 2016 г.). «Вторая генная терапия получает одобрение в Европе» . Бионьюс . Архивировано из оригинала 21 февраля 2017 года . Проверено 20 февраля 2017 г.
- ^ Коглан А. (9 апреля 2016 г.). «Генная терапия одобрена» . Новый учёный . № 3068. С. 8–9.
- ^ Сираноски Д. (июль 2016 г.). «Китайские учёные проведут первое испытание CRISPR на людях» . Природа . 535 (7613): 476–477. Бибкод : 2016Natur.535..476C . дои : 10.1038/nature.2016.20302 . ПМИД 27466105 .
- ^ Беннетт Дж. (15 ноября 2016 г.). «Китайские ученые стали первыми, кто применил редактирование генов CRISPR на людях» . Популярная механика . Проверено 16 ноября 2016 г.
- ^ Ли Т.В., Саузерн К.В., Перри Л.А., Пенни-Димри Дж.К., Аслам А.А. (июнь 2016 г.). Южный KW (ред.). «Местная замена гена регулятора трансмембранной проводимости при муковисцидозе при заболеваниях легких, связанных с муковисцидозом» . Кокрановская база данных систематических обзоров . 2016 (6): CD005599. дои : 10.1002/14651858.CD005599.pub5 . ПМЦ 8682957 . ПМИД 27314455 .
- ^ Уиппл Т. (1 марта 2017 г.). «Новая генная терапия «уменьшает опухоли, как кубики льда» » . Таймс . Проверено 1 марта 2017 г.
- ^ Коглан А. (март 2017 г.). «Генная терапия «вылечивает» мальчика от болезней крови, от которых страдают миллионы» . Новый учёный .
- ^ «Одобрение FDA приносит первую генную терапию в Соединенные Штаты» (пресс-релиз). США Управление по контролю за продуктами и лекарствами (FDA). 30 августа 2017 г.
- ^ «FDA одобрило аксикабтаген цилолеуцел для лечения крупноклеточной В-клеточной лимфомы» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . Проверено 5 января 2018 г.
- ^ Зайнер Дж. (6 октября 2017 г.). «Нокаут миостатина CRISPR человека своими руками» . Ютуб . Архивировано из оригинала 11 ноября 2017 года . Проверено 20 мая 2020 г.
- ^ Зайнер Дж. «Первая попытка редактирования гена CRISPR человека» . Проверено 20 мая 2020 г.
- ^ «Эксклюзив AP: американские ученые впервые пробуют редактировать гены в организме» . АП НОВОСТИ . 15 ноября 2017 года . Проверено 17 ноября 2020 г.
- ^ Кайзер Дж. (ноябрь 2017 г.). «Человеку ввели инструменты редактирования генов, чтобы вылечить его инвалидизирующую болезнь. Вот что вам нужно знать» . Наука . дои : 10.1126/science.aar5098 .
- ^ Чжан С. (15 ноября 2017 г.). «Первый человек, гены которого были отредактированы внутри тела» . Атлантика . Проверено 17 ноября 2020 г.
- ^ Ледфорд Х (5 сентября 2018 г.). «Первые испытания редактирования генов в организме дают многообещающие результаты» . Природа . дои : 10.1038/d41586-018-06195-6 . S2CID 92840885 .
- ^ Маркионе М (7 февраля 2019 г.). «Испытания показывают, что ученые впервые осуществили редактирование генов «внутри тела»» . АП Новости . Проверено 7 февраля 2019 г.
- ^ Персонал (2 февраля 2019 г.). «Исследование возрастающей дозы редактирования генома с помощью терапевтической нуклеазы цинковых пальцев (ZFN) SB-913 у субъектов с МПС II» . ClinicalTrials.gov . Национальная медицинская библиотека США . Проверено 7 февраля 2019 г.
- ^ Рангараджан С., Уолш Л., Лестер В., Перри Д., Мадан Б., Лаффан М. и др. (декабрь 2017 г.). «Перенос гена AAV5-фактора VIII при тяжелой гемофилии А» . Медицинский журнал Новой Англии . 377 (26): 2519–2530. дои : 10.1056/nejmoa1708483 . hdl : 10044/1/57163 . ПМИД 29224506 .
- ^ ван ден Берг HM (декабрь 2017 г.). «Лекарство от гемофилии в пределах досягаемости». Медицинский журнал Новой Англии . 377 (26): 2592–2593. дои : 10.1056/nejme1713888 . ПМИД 29224412 .
- ^ «FDA одобрило новую генную терапию для лечения пациентов с редкой формой наследственной потери зрения» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 19 декабря 2017 года . Проверено 20 декабря 2017 г.
- ^ Герпер М. (2 января 2018 г.). «Spark Therapeutics установила цену генной терапии для лечения слепоты в 850 000 долларов» . Форбс . Проверено 4 января 2018 г.
- ^ Шеридан К. (19 декабря 2017 г.). «FDA одобрило генную терапию для лечения слепоты, что стало революционным моментом для медицины, основанной на ДНК» . Newsweek . Проверено 20 декабря 2017 г.
- ^ Штейн Р. (24 мая 2019 г.). «Новая генная терапия стоимостью 2,1 миллиона долларов является самым дорогим препаратом за всю историю» . ЭНЕРГЕТИЧЕСКИЙ ЯДЕРНЫЙ РЕАКТОР . Проверено 24 мая 2019 г.
- ^ Тонг А (3 июня 2019 г.). «ЕС дает историческое одобрение генной терапии синей птицы для лечения β-талассемии – теперь расслабьтесь и ждите цены» . Проверено 4 июня 2019 г.
- ^ «Зинтегло ЭПАР» . Европейское агентство лекарственных средств (EMA) . 25 марта 2019 года . Проверено 8 июня 2020 г. Текст был скопирован из этого источника © European Medicines Agency. Воспроизведение разрешено при условии указания источника.
- ^ «Исследование однократной возрастающей дозы у участников с LCA10» . www.clinicaltrials.gov . Проверено 20 августа 2019 г.
- ^ «Allergan и Editas Medicine начинают клиническое исследование Brilliance Phase 1/2 AGN-151587 (EDIT-101) для лечения LCA10» . Эдитас Медицина . Проверено 20 августа 2019 г.
- ^ Ледфорд Х (март 2020 г.). «Лечение CRISPR впервые введено непосредственно в организм» . Природа . 579 (7798): 185. Бибкод : 2020Natur.579..185L . дои : 10.1038/d41586-020-00655-8 . ПМИД 32157225 .
- ^ «Золгенсма ЭПАР» . Европейское агентство лекарственных средств (EMA) . 24 марта 2020 г. Проверено 16 октября 2020 г.
- ^ «Audentes Therapeutics предоставляет обновленную информацию о клиническом исследовании ASPIRO по оценке AT132 у пациентов с Х-сцепленной миотубулярной миопатией» . Аудентес Терапевтик . 10 августа 2020 года. Архивировано из оригинала 27 октября 2020 года . Проверено 21 сентября 2020 г.
- ^ «Аудентес» компании Astellas сообщает о третьей смерти в ходе испытания генной терапии» . Жестокие биотехнологии . 21 августа 2020 г. Проверено 21 сентября 2020 г.
- ^ «Смерть от генной терапии AAV в высоких дозах» . Природная биотехнология . 38 (8): 910. 1 августа 2020 г. doi : 10.1038/s41587-020-0642-9 . ISSN 1546-1696 . ПМИД 32760031 . S2CID 220981004 .
- ↑ Перейти обратно: Перейти обратно: а б «Либмелди: Ожидается решение ЕС» . Европейское агентство лекарственных средств (EMA) . 16 октября 2020 года. Архивировано из оригинала 17 октября 2020 года . Проверено 16 октября 2020 г. Текст был скопирован из этого источника © European Medicines Agency. Воспроизведение разрешено при условии указания источника.
- ^ «Новая генная терапия для лечения редкого генетического заболевания — метахроматической лейкодистрофии» . Европейское агентство по лекарственным средствам . 16 октября 2020 г. Проверено 16 октября 2020 г. Текст был скопирован из этого источника © European Medicines Agency. Воспроизведение разрешено при условии указания источника.
- ^ «Либмелды ЭПАР» . Европейское агентство лекарственных средств (EMA) . 13 октября 2020 г. Проверено 22 декабря 2020 г.
- ^ Лизоген (15 октября 2020 г.). «Лизоген предоставляет обновленную информацию о клиническом исследовании AAVance по оценке LYS-SAF302 у пациентов с МПС IIIA – Лизоген» . Архивировано из оригинала 17 октября 2020 года . Проверено 17 октября 2020 г.
- ^ Кон Д.Б., Бут С., Шоу К.Л., Сюй-Бэйфорд Дж., Гарабедиан Э., Тревизан В. и др. (май 2021 г.). «Аутологичная лентивирусная генная терапия ex vivo при дефиците аденозиндезаминазы» . Медицинский журнал Новой Англии . 384 (21): 2002–2013. дои : 10.1056/NEJMoa2027675 . ПМК 8240285 . ПМИД 33974366 .
- ^ Маркионе М (11 мая 2021 г.). «Вирус СПИДа, используемый в генной терапии для лечения болезни «пузырного ребенка»» . Стат . Проверено 19 июля 2021 г.
- ^ «Генная терапия восстанавливает иммунную функцию у детей с редким иммунодефицитом» . Национальные институты здравоохранения (NIH) . 11 мая 2021 г. Проверено 19 июля 2021 г.
- ^ «Почему генная терапия вызвала лейкемию у некоторых пациентов с синдромом «мальчика в пузыре»» . ScienceDaily . Проверено 19 июля 2021 г.
- ^ Мамкарц Э., Чжоу С., Локки Т., Абдельсамед Х., Кросс С.Дж., Кан Г. и др. (апрель 2019 г.). «Лентивирусная генная терапия в сочетании с низкими дозами бусульфана у младенцев с SCID-X1» . Медицинский журнал Новой Англии . 380 (16): 1525–1534. дои : 10.1056/NEJMoa1815408 . ПМК 6636624 . ПМИД 30995372 .
- ^ «ВИЧ использовался для лечения болезни «мальчика-пузыря»» . Новости Би-би-си . 17 апреля 2019 г. Проверено 19 июля 2021 г.
- ^ Питтман Дж., Равиц Дж.Д. «Эти ученые, возможно, нашли лекарство от болезни «мальчика-пузыря»» . Смитсоновский журнал . Проверено 19 июля 2021 г.
- ^ Рор К. (17 апреля 2019 г.). «Генная терапия восстанавливает иммунитет у детей раннего возраста с редким иммунодефицитным заболеванием» . Национальные институты здравоохранения (NIH) . Проверено 4 июня 2020 г.
- ^ Гиллмор Дж.Д., Гейн Э., Таубель Дж., Као Дж., Фонтана М., Мейтленд М.Л. и др. (август 2021 г.). «Редактирование гена CRISPR-Cas9 in vivo при транстиретиновом амилоидозе» . Медицинский журнал Новой Англии . 385 (6): 493–502. дои : 10.1056/NEJMoa2107454 . ПМИД 34215024 . S2CID 235722446 .
- ^ «Новости: Обновление клинических испытаний: положительные данные о первом в истории лекарстве CRISPR in vivo» . CRISPR Медицина . Проверено 16 декабря 2021 г.
- ^ «Новости науки, определившие 2021 год: выбор природы». Природа . Декабрь 2021 г. doi : 10.1038/d41586-021-03734-6 . ПМИД 34907370 . S2CID 245144020 .
- ^ Пирсон Т.С., Гупта Н., Сан-Себастьян В., Имамура-Чинг Дж., Виховер А., Грихальво-Перес А. и др. (июль 2021 г.). «Генная терапия дефицита декарбоксилазы ароматических L-аминокислот путем прямой доставки AAV2-AADC под контролем МРТ в дофаминергические нейроны среднего мозга» . Природные коммуникации . 12 (1): 4251. Бибкод : 2021NatCo..12.4251P . дои : 10.1038/s41467-021-24524-8 . ПМЦ 8275582 . ПМИД 34253733 .
- ^ Ибрагим М (14 июля 2021 г.). «Генная терапия восстанавливает недостающий дофамин у детей с редким заболеванием головного мозга» . Наука . Проверено 18 июля 2021 г.
- ^ «Испытания генной терапии указывают на более широкие возможности для изменения течения редкого заболевания» . Стат . 12 июля 2021 г. Проверено 18 июля 2021 г.
- ^ Флотте Т.Р., Каталтепе О., Пури А., Батиста А.Р., Мозер Р., Маккенна-Ясек Д. и др. (февраль 2022 г.). «Генная терапия AAV при болезни Тея-Сакса» . Природная медицина . 28 (2): 251–259. дои : 10.1038/s41591-021-01664-4 . ПМЦ 10786171 . ПМИД 35145305 . S2CID 246748772 .
- ^ Сена-Эстевес М (14 февраля 2022 г.). «Первая генная терапия болезни Тея-Сакса успешно проведена двум детям» . Разговор . Проверено 7 марта 2022 г.
- ^ «Родители стали инициатором прорыва в генной терапии для детей с болезнью Тея-Сакса» . Независимый . 18 февраля 2022 г. Проверено 7 марта 2022 г.
- ^ «Упстаза: Ожидается решение ЕС» . Европейское агентство по лекарственным средствам . 19 мая 2022 года. Архивировано из оригинала 25 мая 2022 года . Проверено 22 мая 2022 г.
- ^ «PTC Therapeutics получила положительное заключение CHMP об использовании Upstaza для лечения дефицита AADC» . PTC Therapeutics (пресс-релиз). 20 мая 2022 г. Проверено 22 мая 2022 г.
- ^ Чоудари П., Шапиро С., Макрис М., Эванс Г., Бойс С., Толкс К. и др. (июль 2022 г.). «Фазы 1-2 исследования генной терапии AAVS3 у пациентов с гемофилией B» . Медицинский журнал Новой Англии . 387 (3): 237–247. дои : 10.1056/NEJMoa2119913 . ПМИД 35857660 . S2CID 250697905 .
- ^ «Новая генная терапия может снизить риск кровотечений у пациентов с гемофилией» . ScienceDaily . Проверено 3 августа 2022 г.
- ^ «Трансформационная терапия лечит гемофилию B» . Новости Би-би-си . 21 июля 2022 г. Проверено 3 августа 2022 г.
- ^ «Редактирование базы: революционная терапия избавляет девушку от неизлечимого рака» . Новости Би-би-си . 11 декабря 2022 г. Проверено 11 декабря 2022 г.
- ^ «Главные капли для генной терапии вернули мальчику зрение. Подобные методы лечения могут помочь миллионам» . АП Новости . 24 июля 2023 г. Проверено 31 июля 2023 г.
- ^ Хуан, Цзиньбо; Сюэ, Шуай; Бухманн, Питер; Тейшейра, Ана Пальма; Фюссенеггер, Мартин (16 августа 2023 г.). «Электрогенетический интерфейс для программирования экспрессии генов млекопитающих с помощью постоянного тока» . Природный метаболизм . 5 (8): 1395–1407. дои : 10.1038/s42255-023-00850-7 . ПМЦ 10447240 . ПМИД 37524785 .
Дальнейшее чтение [ править ]
- «Генная терапия: обзор одобренных и разрабатываемых технологий» (PDF) . КАДТ (171). Март 2018 г. Архивировано (PDF) из оригинала 19 октября 2018 г.
- Баум С., Дюльманн Дж., Ли З., Фезе Б., Мейер Дж., Уильямс Д.А., фон Калле С. (март 2003 г.). «Побочные эффекты переноса ретровирусных генов в гемопоэтические стволовые клетки». Кровь . 101 (6): 2099–2114. дои : 10.1182/blood-2002-07-2314 . ПМИД 12511419 . S2CID 8489829 .
- Дейли Дж. (январь 2020 г.). «Прибытие генной терапии: после фальстарта лекарства, манипулирующие кодом жизни, наконец-то меняют жизнь» . Научный американец . 322 (1).
- Гардлик Р., Палфи Р., Ходоси Дж., Лукач Дж., Турна Дж., Селец П. (апрель 2005 г.). «Векторы и системы доставки в генной терапии». Монитор медицинских наук . 11 (4): RA110–121. ПМИД 15795707 .
- Хорн П.А., Моррис Дж.К., Нефф Т., Кием Х.П. (сентябрь 2004 г.). «Перенос генов стволовых клеток – эффективность и безопасность в исследованиях на крупных животных» . Молекулярная терапия . 10 (3): 417–431. дои : 10.1016/j.ymthe.2004.05.017 . ПМИД 15336643 .
- Парамби Д.Г., Альхарби К.С., Кумар Р., Харилал С., Батиха Г.Е., Круз-Мартинс Н., Магди О., Муса А., Панда Д.С., Мэтью Б. (октябрь 2021 г.). «Подход генной терапии с акцентом на факторы роста: теоретические и клинические результаты при нейродегенеративных заболеваниях» . Молекулярная нейробиология . 59 (1): 191–233. дои : 10.1007/s12035-021-02555-y . ПМЦ 8518903 . ПМИД 34655056 .
- Салмонс Б., Гюнцбург WH (апрель 1993 г.). «Нацеливание ретровирусных векторов на генную терапию». Генная терапия человека . 4 (2): 129–141. дои : 10.1089/hum.1993.4.2-129 . ПМИД 8494923 .
- Персонал (18 ноября 2005 г.). «Генная терапия» . Информация о проекте «Геном человека» . Окриджская национальная лаборатория . Архивировано из оригинала (FAQ) 27 апреля 2006 года . Проверено 28 мая 2006 г.
- Тиньков С., Бекереджян Р., Винтер Г., Костер С. (20 ноября 2000 г.). «Микропузырьки, конъюгированные с полиплексом, для усиленной генной терапии, нацеленной на ультразвук» (PDF) . Всемирный конгресс-центр Джорджии , Атланта, Джорджия: Ежегодное собрание и выставка AAPS 2008 г. Архивировано из оригинала (PDF) 7 июля 2012 года . Проверено 26 января 2009 г.
- Ван Х, Шаяхметов Д.М., Лидж Т., Харки М., Ли Кью, Папаяннопулу Т., Стаматояннопулус Г., Либер А. (сентябрь 2005 г.). «Модифицированный капсидом хелпер-зависимый аденовирусный вектор, содержащий контрольную область локуса бета-глобина, демонстрирует неслучайную картину интеграции и обеспечивает стабильную, специфичную для эритроида экспрессию генов» . Журнал вирусологии . 79 (17): 10999–11013. doi : 10.1128/JVI.79.17.10999-11013.2005 . ПМК 1193620 . ПМИД 16103151 .
