Хороидеремия
| Хороидеремия | |
|---|---|
| Другие имена | ХМ, тапетохориоидальная дистрофия |
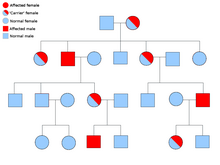 | |
| Пример родословной, показывающий наследование расстройства, сцепленного с полом, такого как хороидеремия. | |
| Специальность | Офтальмология |
| Симптомы | Прогрессирующая потеря зрения |
| Обычное начало | Детство |
| Продолжительность | Хронический |
| Причины | Генетический |
| Метод диагностики | Генетическое тестирование, семейный анамнез, исследование глазного дна |
Хороидеремия ( / k ɒ ˌ r ɔɪ d ɪ ˈ r iː m i ə / ; CHM ) — редкая, Х-сцепленная рецессивная форма наследственной дегенерации сетчатки , которая поражает примерно 1 из 50 000 мужчин. Заболевание вызывает постепенную потерю зрения, начиная с детской куриной слепоты , за которой следует потеря периферического зрения и прогрессирование до потери центрального зрения в более позднем возрасте. Прогрессирование продолжается на протяжении всей жизни человека, но как скорость изменений, так и степень потери зрения различаются среди пострадавших, даже в пределах одной семьи. [1]
Хороидеремия вызвана мутацией потери функции в CHM гене , который кодирует эскортный белок 1 Rab (REP1), белок, участвующий в липидной модификации белков Rab . Хотя полный механизм заболевания не до конца понятен, отсутствие функционального белка в сетчатке приводит к гибели клеток и постепенному разрушению пигментного эпителия сетчатки (ПЭС), фоторецепторов и сосудистой оболочки . [2] [3]
По состоянию на 2019 год лечения хороидеремии не существует; однако сетчатки клинические испытания генной терапии продемонстрировали возможное лечение. [4]
Презентация
[ редактировать ]Поскольку ген CHM расположен на Х-хромосоме , симптомы наблюдаются почти исключительно у мужчин. Хотя есть несколько исключений, женщины -носители имеют заметное отсутствие пигментации в ПЭС, но не испытывают никаких симптомов. [5] У женщин-носителей есть 50% вероятность рождения либо больного сына, либо дочери-носителя, в то время как у мужчины с хоридеремией будут все дочери-носители и незатронутые сыновья.
Несмотря на то, что течение заболевания может существенно различаться, [1] [6] есть общие тенденции. Первым симптомом, который замечают многие люди с хоридеремией, является значительная потеря ночного зрения, которая начинается в молодом возрасте. [7] Потеря периферического зрения происходит постепенно, начиная с кольцевой потери зрения и заканчивая «туннельным зрением» во взрослом возрасте. [8] Люди с хоридеремией, как правило, сохраняют хорошую остроту зрения до 40 лет, но в конечном итоге теряют зрение в какой-то момент в возрастном диапазоне 50–70 лет. [8] Исследование 115 человек с хоридеремией показало, что 84% пациентов в возрасте до 60 лет имели остроту зрения 20/40 или выше, а 33% пациентов старше 60 лет имели остроту зрения 20/200 или хуже. Наиболее серьезное нарушение остроты зрения (способность только считать пальцы или что-то еще хуже) не возникало до седьмого десятилетия жизни. В том же исследовании было обнаружено, что средняя скорость потери остроты зрения составляет около 0,09 logMAR за 5 лет, что соответствует примерно 1 строке в таблице Снеллена . [2]
Диагностика
[ редактировать ]Диагноз хороидеремии можно поставить на основании семейного анамнеза, симптомов и характерного внешнего вида глазного дна . [9] Однако хороидеремия имеет некоторые общие клинические особенности с пигментным ретинитом , сходной, но более широкой группой дегенеративных заболеваний сетчатки, что затрудняет постановку конкретного диагноза без генетического тестирования. Из-за этого хороидеремию часто первоначально ошибочно принимают за пигментный ретинит. [10] различные методы генетического тестирования . Для постановки дифференциального диагноза можно использовать [11] [12]
Управление
[ редактировать ]Хотя в настоящее время ничего нельзя сделать, чтобы остановить или обратить вспять дегенерацию сетчатки, есть шаги, которые можно предпринять, чтобы замедлить скорость потери зрения. Рекомендуется использовать солнцезащитные очки с УФ-защитой для улицы, соответствующее диетическое потребление свежих фруктов и листовых зеленых овощей, антиоксидантные витаминные добавки и регулярное употребление с пищей жирных кислот омега-3 с очень длинной цепью. [8] Одно исследование показало, что пищевая добавка лютеина повышает уровень макулярного пигмента у пациентов с хоридеремией. В течение длительного периода времени этот повышенный уровень пигментации «может» замедлить дегенерацию сетчатки. [13] Дополнительные вмешательства, которые могут потребоваться, включают хирургическую коррекцию отслойки сетчатки и катаракты, услуги при слабовидении и консультирование, чтобы помочь справиться с депрессией, потерей независимости и тревогой по поводу потери работы. [8]
Генная терапия
[ редактировать ]Генная терапия в настоящее время не является вариантом лечения, однако клинические испытания на людях как хороидеремии, так и врожденного амавроза Лебера (LCA) дали несколько многообещающие результаты. [14]
Клинические испытания генной терапии для пациентов с LCA начались в 2008 году в трех разных центрах. [15] [16] [17] [18] В целом, эти исследования показали, что терапия безопасна, в некоторой степени эффективна и перспективна в качестве будущего лечения подобных заболеваний сетчатки.
В 2011 году было проведено первое генное лечение хоридеремии. [19] Операцию провел Роберт Макларен , профессор офтальмологии Оксфордского университета и руководитель исследовательской группы клинической офтальмологии в офтальмологической лаборатории Наффилда (NLO). [14] [20] [21] В ходе исследования 2 дозы вектора AAV .REP1 вводились субретинально 12 пациентам с хоридеремией. Исследование преследовало 2 цели:
- для оценки безопасности и переносимости вектора AAV.REP1
- наблюдать терапевтический эффект или замедление дегенерации сетчатки от генной терапии во время исследования и через 24 месяца после лечения. [22]
Несмотря на отслойку сетчатки, вызванную инъекцией, в исследовании наблюдалось первоначальное улучшение функции палочек и колбочек, что требует дальнейшего изучения.
В 2016 году исследователи были оптимистичны в отношении того, что положительные результаты 32 пациентов с хоридеремией, получавших генную терапию в течение четырех с половиной лет в четырех странах, могут быть долгосрочными. [23]
Преимплантационная генетическая диагностика
[ редактировать ]Для женщин, несущих мутацию в гене CHM, преимплантационную генетическую диагностику можно использовать во время процесса экстракорпорального оплодотворения для отбора непораженных эмбрионов для имплантации. [24] Этот процесс можно применить к любому моногенному заболеванию.
Другие потенциальные методы лечения
[ редактировать ]Хотя хороидеремия является идеальным кандидатом для генной терапии [2] Существуют и другие потенциальные методы лечения, которые могут восстановить зрение после его утраты в более позднем возрасте. Прежде всего, это стволовыми клетками терапия . Клиническое исследование, опубликованное в 2014 году, показало, что субретинальная инъекция эмбриональных стволовых клеток человека пациентам с возрастной дегенерацией желтого пятна и болезнью Штаргардта безопасна и улучшает зрение у большинства пациентов. Из 18 пациентов зрение улучшилось у 10, улучшилось или осталось прежним у 7 и снизилось у 1 пациента, при этом в нелеченых глазах улучшения не наблюдалось. Исследование не обнаружило «никаких доказательств неблагоприятного пролиферации, отторжения или серьезных глазных или системных проблем безопасности, связанных с трансплантированной тканью». [25] [26] В исследовании 2015 года CRISPR/Cas9 использовался для восстановления мутаций в индуцированных пациентами плюрипотентных стволовых клетках , которые вызывают Х-сцепленный пигментный ретинит. [27] Это исследование предполагает, что собственные восстановленные клетки пациента могут быть использованы для терапии, что снижает риск иммунного отторжения и этических проблем , возникающих при использовании эмбриональных стволовых клеток.
Исследовать
[ редактировать ]История
[ редактировать ]Хороидеремия была впервые описана в 1872 году австрийским офтальмологом Людвигом Маутнером . [9] Первоначально считалось, что это заболевание является нарушением развития, вызывающим отсутствие большей части сосудистой оболочки (отсюда и вероятное использование древнегреческого суффикса «еремия», означающего бесплодную землю или пустыню). [9] Спустя несколько десятилетий непрогрессирующий характер заболевания был поставлен под сомнение и в конечном итоге был отвергнут Paymerer et al. в 1960 году. [9] [28] Ген CHM был идентифицирован и клонирован в 1990 году Франсом П.М. Кремерсом. [29]
Фундаментальные исследования
[ редактировать ]При многих наследственных заболеваниях сетчатки белок, затронутый мутацией, непосредственно участвует в светочувствительной функции глаза, однако это не относится к хоридеремии. [9] REP1 способствует пренилированию Rab G-белков путем связывания и представления их субъединице Rab-геранилгеранилтрансферазы . [30] REP1 также сопровождает пренилированные Rabs через цитоплазму, связывая гидрофобные пренильные группы и перенося их к определенной мембране назначения. [30]
У здоровых людей REP1 обнаруживается во всех клетках организма, однако у пациентов с хоридеремией наблюдается только потеря зрения, а не более широкие системные симптомы (за исключением исследования, в котором были обнаружены кристаллы и аномалии жирных кислот в лейкоцитах ). [31] REP2, белок, который на 75% идентичен и на 90% похож на REP1, способен существенно компенсировать потерю REP1 вне глаза. [9] [32] Считается, что REP2 не способен полностью компенсировать потерю REP1 в сетчатке. [9] RAB27A , Rab, который выполняет важные функции в сетчатке, [33] было показано, что он преимущественно пренилируется с помощью REP1. [34] Rab27a-REP1 и Rab27a-REP2 Кроме того, комплексы имеют различное сродство к ферменту Rab-геранилгеранилтрансферазы, что, возможно, объясняет неспособность REP2 полностью компенсировать REP1 в сетчатке. [34]
Культура
[ редактировать ]Ряд людей, занимающих общественные должности, живут с хороидеремией, а некоторые участвовали в сборе средств на борьбу с этой болезнью. бывший Великобритании от Лейбористской партии член парламента Сион Саймон страдает этим заболеванием. Известно, что [35] Комик и активист Э. Джей Скотт, партнер «Сорвиголовы» актрисы Деборы Энн Уолл , также страдает хороидеремией и регулярно участвует в сборе средств. [36] [37]
Ссылки
[ редактировать ]- ^ Jump up to: а б Кярня, Дж (1986). «Хороидеремия. Клинико-генетическое исследование 84 финских пациентов и 126 женщин-носителей». Добавка Acta Ophthalmologica . 176 : 1–68. ПМИД 3014804 .
- ^ Jump up to: а б с Робертс, МФ; Фишман, Джорджия; Робертс, ДК; Хекенлайвли-младший; Велебер, Р.Г.; Андерсон, Р.Дж.; Гровер, С. (июнь 2002 г.). «Ретроспективное, продольное и поперечное исследование снижения остроты зрения при хороидеремии» . Британский журнал офтальмологии . 86 (6): 658–62. дои : 10.1136/bjo.86.6.658 . ПМЦ 1771148 . ПМИД 12034689 .
- ^ Алеман, Т.С.; Вешать; Серрано, LW; Фюрст, Нью-Мексико; Чарльсон, ES; Пирсон, диджей; Чанг, округ Колумбия; Трабанд, А; Пан, Вт; Ин, Г.С.; Беннетт, Дж; Магуайр, AM; Морган, JI (13 декабря 2016 г.). «Естественная история центральных структурных аномалий при хороидеремии: проспективное поперечное исследование» . Офтальмология . 124 (3): 359–373. дои : 10.1016/j.ophtha.2016.10.022 . ПМЦ 5319901 . ПМИД 27986385 .
- ^ Эбигейл Билл, 2014, «Генная терапия восстанавливает зрение у людей с заболеваниями глаз», New Scientist (онлайн), 16 января 2014 г., см. [1] , по состоянию на 21 января 2017 г.
- ^ Дугель, Правин Ю.; Циммер, Шерил Н.; Шахиди, Айда М. (июль 2016 г.). «Пример носителя хороидеремии – использование мультиспектральной визуализации для выявления клинических особенностей» . Американский журнал офтальмологии . Отчеты о случаях заболевания. 2 : 18–22. дои : 10.1016/j.ajoc.2016.04.003 . ПМЦ 5757363 . ПМИД 29503891 .
- ^ Струнникова, Н; Зейн, ВМ; Сильвин, К; Макдональд, IM (2012). «Биомаркеры сыворотки и дефекты движения в периферических тканях отражают тяжесть ретинопатии у трех братьев, страдающих хоридеремией». Дегенеративные заболевания сетчатки . Достижения экспериментальной медицины и биологии. Том. 723. стр. 381–7. дои : 10.1007/978-1-4614-0631-0_49 . ISBN 978-1-4614-0630-3 . ПМИД 22183356 .
- ^ Хан, Камрон Н.; Ислам, Фарра; Мур, Энтони Т.; Михаэлидис, Мишель (октябрь 2016 г.). «Клинико-генетические особенности хоридеремии в детском возрасте» . Офтальмология (Представлена рукопись). 123 (10): 2158–2165. дои : 10.1016/j.ophtha.2016.06.051 . ПМИД 27506488 .
- ^ Jump up to: а б с д Макдональд, Ян М.; Хьюм, Стейси; Чан, Стефани; Сибра, Мигель К. (26 февраля 2015 г.). «Хороидеремия» . Джин Обзоры . Вашингтонский университет, Сиэтл. ПМИД 20301511 .
- ^ Jump up to: а б с д и ж г Барнард, Арканзас; Гроппе, М.; Макларен, RE (30 октября 2014 г.). «Генная терапия хороидеремии с использованием аденоассоциированного вирусного (AAV) вектора» . Перспективы Колд-Спринг-Харбора в медицине . 5 (3): а017293. doi : 10.1101/cshperspect.a017293 . ПМЦ 4355255 . ПМИД 25359548 .
- ^ Го, Хуэй; Ли, Цзишэн; Гао, Фэй; Ли, Цзянся; У, Синьи; Лю, Цицзи (28 июля 2015 г.). «Секвенирование всего экзома выявило новую мутацию гена CHM в семье с хороидеремией, первоначально диагностированной как пигментный ретинит» . БМК Офтальмология . 15 (1): 85. дои : 10.1186/s12886-015-0081-4 . ПМЦ 4517409 . ПМИД 26216097 .
- ^ Санчес-Алькудия, Росио; Гарсия-Ойос, Мария; Лопес-Мартинес, Мигель Анхель; Санчес-Боливар, Ноэлия; Зурита, Ольга; Хименес, Вознесение; Вильяверде, Кристина; Родригес-Жаси да Силва, Лусиана; Кортон, Марта; Перес-Карро, Ракель; Торриано, Симона; Калацис, Василики; Риволта, Карло; Авила-Фернандес, Альмудена; Лорда, Изабель; Трухильо-Тиебас, Мария Дж.; Гарсиа-Сандовал, Бланка; Лопес-Молина, Мария Исабель; Уайт-Келли, Фиона; Ривейро-Альварес, Роза; Аюсо, Кармен; Янеке, Андреас Р. (12 апреля 2016 г.). «Комплексный анализ хороидеремии: от генетической характеристики к клинической практике» . ПЛОС ОДИН . 11 (4): e0151943. Бибкод : 2016PLoSO..1151943S . дои : 10.1371/journal.pone.0151943 . ПМЦ 4829155 . ПМИД 27070432 .
- ^ Фургоч, МЮ; Мьюс-Арес, Дж; Радзивон, А; Макдональд, IM (25 апреля 2014 г.). «Молекулярно-генетические методы диагностики хоридеремии» . Молекулярное видение . 20 : 535–44. ПМК 4000712 . ПМИД 24791138 .
- ^ Дункан, Дж.Л.; Алеман, Т.С.; Гарднер, LM; Де Кастро, Э; Маркс, Д.А.; Эммонс, Дж. М.; Бибер, МЛ; Стейнберг, доктор медицинских наук; Беннетт, Дж; Стоун, Э.М.; Макдональд, IM; Сидеджиян, А.В.; Магуайр, Миннесота; Джейкобсон, С.Г. (март 2002 г.). «Макулярный пигмент и добавки лютеина при хороидеремии». Экспериментальное исследование глаз . 74 (3): 371–81. дои : 10.1006/exer.2001.1126 . ПМИД 12014918 .
- ^ Jump up to: а б Паллаб Гош, 2011 г., «Здоровье: генная терапия используется в попытке спасти человеку зрение», на BBC News (онлайн), 27 октября 2011 г., см. [2] , по состоянию на 23 апреля 2015 г.
- ^ Сидеджиян А.В.; Хаусвирт WW; Алеман Т.С.; Каушал С.; Шварц С.Б.; Бойе С.Л.; Виндзорский EAM; и др. (2009). «Генная терапия RPE65 человека при врожденном амаврозе Лебера: сохранение ранних улучшений зрения и безопасность в течение 1 года» . Генная терапия человека . 20 (9): 999–1004. дои : 10.1089/hum.2009.086 . ПМЦ 2829287 . ПМИД 19583479 .
- ^ Симонелли Ф.; Магуайр AM; Теста Ф.; Пирс Э.А.; Мингоцци Ф.; Бенничелли Дж.Л.; Росси С.; и др. (2010). «Генная терапия врожденного амавроза Лебера безопасна и эффективна в течение 1,5 лет после введения вектора» . Молекулярная терапия . 18 (3): 643–650. дои : 10.1038/mt.2009.277 . ПМЦ 2839440 . ПМИД 19953081 .
- ^ Магуайр AM; Высокий КА; Ауриккио А.; Райт Дж. Ф.; Пирс Э.А.; Теста Ф.; Мингоцци Ф.; и др. (2009). «Возрастные эффекты генной терапии RPE65 при врожденном амаврозе Лебера: исследование фазы 1 с увеличением дозы» . Ланцет . 374 (9701): 1597–1605. дои : 10.1016/S0140-6736(09)61836-5 . ПМЦ 4492302 . ПМИД 19854499 .
- ^ Бейнбридж JWB; Смит А.Дж.; Баркер СС; Робби С.; Хендерсон Р.; Балагган К.; Вишванатан А.; и др. (2008). «Влияние генной терапии на зрительную функцию при врожденном амаврозе Лебера». Медицинский журнал Новой Англии . 358 (21): 2231–2239. CiteSeerX 10.1.1.574.4003 . doi : 10.1056/NEJMoa0802268 . ПМИД 18441371 .
- ^ Макларен, RE; Гроппе, М; Барнард, Арканзас; Коттриалл, CL; Толмачева Т; Сеймур, Л; Кларк, КР; Во время, MJ; Кремерс, Ф.П.; Блэк, GC; Лотери, Эй Джей; Даунс, С.М.; Вебстер, Арканзас; Сибра, MC (29 марта 2014 г.). «Генная терапия сетчатки у пациентов с хоридеремией: первые результаты клинического исследования фазы 1/2» . Ланцет . 383 (9923): 1129–37. дои : 10.1016/s0140-6736(13)62117-0 . ПМК 4171740 . ПМИД 24439297 .
- ^ Эбигейл Билл, 2014, «Генная терапия восстанавливает зрение у людей с заболеваниями глаз», New Scientist (онлайн), 16 января 2014 г., см. [3] , по состоянию на 23 апреля 2015 г.
- ^ Юэн Каллауэй, 2008, «Успех генной терапии «обратит» слепоту», New Scientist (онлайн), 28 апреля 2008 г., см. [4] и [5] и [6] , по состоянию на 23 апреля 2015 г.
- ^ CT.gov, 2014, «Генная терапия слепоты, вызванной хоридеремией (спонсор: Оксфордский университет): NCT01461213», на ClinicalTrials.gov, см. [7] , по состоянию на 23 апреля 2015 г.
- ^ Гош, Паллаб (28 апреля 2016 г.). «Генная терапия обращает вспять потерю зрения и действует надолго» . Новости BBC, Наука и окружающая среда . Проверено 29 апреля 2016 г.
- ^ «Преимплантационная генетическая диагностика: (ПГД)» . www.americanpregnancy.org . 24 апреля 2012 г. Проверено 23 июня 2018 г.
- ^ Шварц, SD; Реджило, CD; Лам, БЛ; Элиотт, Д; Розенфельд, П.Дж.; Грегори, Новая Зеландия; Хабшман, JP; Дэвис, Дж. Л.; Хейлвелл, Дж; Спирн, М; Магуайр, Дж; Гей, Р; Бейтман, Дж; Острик, РМ; Моррис, Д; Винсент, М; Англаде, Э; Дель Приоре, LV; Ланца, Р. (7 февраля 2015 г.). «Пигментный эпителий сетчатки, полученный из эмбриональных стволовых клеток человека, у пациентов с возрастной дегенерацией желтого пятна и макулярной дистрофией Штаргардта: наблюдение за двумя открытыми исследованиями фазы 1/2». Ланцет . 385 (9967): 509–16. дои : 10.1016/s0140-6736(14)61376-3 . ПМИД 25458728 . S2CID 85799 .
- ^ Даффи, Морин (21 октября 2014 г.). «Обновленные результаты клинических испытаний стволовых клеток при болезни Штаргардта и сухой макулодистрофии — блог VisionAware — VisionAware» . www.visionaware.org . Проверено 23 января 2017 г.
- ^ Бассюк, Александр Григорьевич; Чжэн, Эндрю; Ли, Яо; Цанг, Стивен Х.; Махаджан, Винит Б. (27 января 2016 г.). «Точная медицина: генетическое восстановление пигментного ретинита с помощью стволовых клеток, полученных от пациента» . Научные отчеты . 6 : 19969. Бибкод : 2016NatSR...619969B . дои : 10.1038/srep19969 . ПМЦ 4728485 . ПМИД 26814166 .
- ^ Пеймейер, Дж. К.; Ваарденбург, П.Дж.; Хенкес, HE (1 декабря 1960 г.). «ХОРИДЕРЕМИЯ» . Британский журнал офтальмологии . 44 (12): 724–738. дои : 10.1136/bjo.44.12.724 . ISSN 0007-1161 . ПМК 510030 . ПМИД 13732369 .
- ^ Кремерс, Франс ПМ; ван де Поль, Дориен-младший; ван Керкхофф, премьер-министр Лисбет; Виринга, Беренд; Роперс, Ханс-Хильгер (18 октября 1990 г.). «Клонирование гена, который перестраивается у пациентов с хороидеремией». Природа . 347 (6294): 674–677. Стартовый код : 1990Natur.347..674C . дои : 10.1038/347674a0 . ПМИД 2215697 . S2CID 4347627 .
- ^ Jump up to: а б Пилипенко О; Рак, А; Реенц, Р; Никула, А; Сидорович, В; Чиоака, доктор медицины; Бессолицына Е; Тома, Нью-Хэмпшир; Вальдманн, Х; Шлихтинг, Я; Гуди, РС; Александров, К (февраль 2003 г.). «Структура эскортного белка-1 Rab в комплексе с Rab-геранилгеранилтрансферазой» . Молекулярная клетка . 11 (2): 483–94. дои : 10.1016/s1097-2765(03)00044-3 . ПМИД 12620235 .
- ^ Чжан А.Ю., Майсур Н., Вали Х., Кенекуп Дж., Цао С.Н., Ли С., Рен Х., Кесер В., Лопес-Солаче И., Сиддики С.Н., Хан А., Муи Дж., Сирс К., Диксон Дж., Шварцентрубер Дж., Маевски Дж., Браверман Н., Кенекуп РК (2015). «Хороидеремия — системное заболевание, характеризующееся кристаллами лимфоцитов, липидами плазмы и аномалиями мембран эритроцитов» . Invest Ophthalmol Vis Sci . 56 (13): 8158–8165. дои : 10.1167/iovs.14-15751 . ПМЦ 4699407 . ПМИД 26720468 .
- ^ Кремерс, Ф.П.; Армстронг, ЮАР; Сибра, MC; Браун, Миссисипи; Гольдштейн, Дж. Л. (21 января 1994 г.). «REP-2, эскортный белок Rab, кодируемый геном, подобным хороидеремии» . Журнал биологической химии . 269 (3): 2111–7. дои : 10.1016/S0021-9258(17)42142-9 . ПМИД 8294464 .
- ^ Толмачева Т; Рамальо, Дж.С.; Анант, Дж.С.; Шульц, РА; Хаксли, CM; Сибра, MC (18 октября 1999 г.). «Клонирование, картирование и характеристика человеческого гена RAB27A». Джин . 239 (1): 109–16. дои : 10.1016/s0378-1119(99)00371-6 . ПМИД 10571040 .
- ^ Jump up to: а б Лариджани, Б; Хьюм, АН; Тарафдер, АК; Сибра, MC (21 ноября 2003 г.). «Множество факторов способствуют неэффективному пренилированию Rab27a при заболеваниях пренилирования Rab» . Журнал биологической химии . 278 (47): 46798–804. дои : 10.1074/jbc.m307799200 . ПМИД 12941939 .
- ^ «BBC NEWS | Великобритания | Политика | Сион Саймон» . news.bbc.co.uk. 21 октября 2002 г. Проверено 20 января 2017 г.
- ↑ Билл Дуайр, 2013 г., «Несмотря на слепоту, Э. Дж. Скотт продолжает смотреть вперед, двигаться вперед», LA Times (онлайн), 11 января 2013 г., см. [8] , по состоянию на 23 апреля 2015 г.
- ^ Э. Дж. Скотт, 2015 г., «Это мои 40: пробежать 7 континентов за 1 год с завязанными глазами», на Crowdrise (онлайн-краудсорсинг), без даты, см. [9] , по состоянию на 23 апреля 2015 г.
Дальнейшее чтение
[ редактировать ]- Дэнни Борен, 2015 г., «Первое клиническое испытание генной терапии в США для лечения хоридеремии, начатое в Филадельфии» , Фонд исследований хороидеремии (онлайн), сводка пресс-релиза, 20 января 2015 г., см. [10]. Архивировано 21 сентября 2015 г. в Wayback Machine. , по состоянию на 23 апреля 2015 г.
- Кори Макдональд, 2015 г., «Nightstar получает статус орфанного препарата в США и Европе для генной терапии для лечения хоридеремии», Фонд исследований хороидеремии (онлайн), сводка пресс-релиза, 24 марта 2015 г. (дата выпуска — 11 января), см. [11] , по состоянию на 23 апреля 2015 г.
- FFB, 2015, «Исследование генной терапии хороидеремии в США, запущенное компанией Spark Therapeutics», Foundation Fighting Blindness (онлайн), 27 января 2015 г., см. [12] , по состоянию на 23 апреля 2015 г.
- NLO, 2014, «Первые результаты исследования генной терапии хороидеремии (2014 г.),» Лаборатория офтальмологии Наффилда (онлайн), пресс-релиз, без даты, см. [13] , по состоянию на 23 апреля 2015 г.