Аденозиндезаминаза
| ЕСТЬ | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | АДА , энтрез:100, Аденозиндезаминаза, АДА1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 608958 ; МГИ : 87916 ; Гомологен : 37249 ; GeneCards : ADA ; ОМА : АДА – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Аденозин/АМФ дезаминаза | |||
|---|---|---|---|
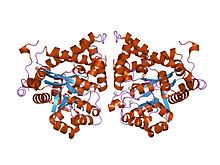 кристаллическая структура аденозиндезаминазы плазмодия yoelii (py02076) | |||
| Идентификаторы | |||
| Символ | А_дезаминаза | ||
| Пфам | PF00962 | ||
| Пфам Клан | CL0034 | ||
| ИнтерПро | ИПР001365 | ||
| PROSITE | PDOC00419 | ||
| СКОП2 | 1add / SCOPe / СУПФАМ | ||
| CDD | cd01320 | ||
| |||
| Домен аденозиндезаминазы (эдитазы) | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | А_деамин | ||
| Пфам | PF02137 | ||
| ИнтерПро | ИПР002466 | ||
| PROSITE | PDOC00419 | ||
| СКОП2 | 1add / SCOPe / СУПФАМ | ||
| |||
| N-концевая аденозин/АМФ-дезаминаза | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | А_дезаминаза_N | ||
| Пфам | PF08451 | ||
| ИнтерПро | ИПР013659 | ||
| |||
Аденозиндезаминаза (также известная как аденозинаминогидролаза или ADA ) представляет собой фермент ( EC 3.5.4.4 ), участвующий в метаболизме пуринов . Он необходим для расщепления аденозина , поступающего с пищей, и для обмена нуклеиновых кислот в тканях.
Его основной функцией у человека является развитие и поддержание иммунной системы. [5] Однако полная физиологическая роль АДА еще не до конца понята. [6]
Структура
[ редактировать ]АДА существует как в малой форме (в виде мономера), так и в большой форме (в виде димерного комплекса). [6] В мономерной форме фермент представляет собой полипептидную цепь, [7] свернуты в восемь нитей параллельных α/β-цилиндров, которые окружают центральный глубокий карман, который является активным сайтом. [5] Помимо восьми центральных β-бочек и восьми периферических α-спиралей , ADA содержит также пять дополнительных спиралей: остатки 19-76 сворачиваются в три спирали, расположенные между β1 и α1 складками; и две антипараллельные карбокси-концевые спирали расположены поперек аминоконца β-цилиндра.
Активный центр ADA содержит ион цинка, который расположен в самом глубоком углублении активного центра и координируется пятью атомами His15, His17, His214, Asp295 и субстрата. [5] Цинк — единственный кофактор, необходимый для активности.
Субстрат аденозин стабилизирован и связан с активным центром девятью водородными связями. [5] Карбоксильная группа Glu217, примерно копланарная пуриновому кольцу субстрата, способна образовывать водородную связь с N1 субстрата. Карбоксильная группа Asp296, также копланарная пуриновому кольцу субстрата, образует водородную связь с N7 субстрата. Группа NH Gly184 способна образовывать водородную связь с N3 субстрата. Asp296 образует связи как с Zn 2+ иона, а также с 6-OH субстрата. His238 также образует водородные связи с субстратом 6-OH. 3'-OH субстрата рибозы образует водородную связь с Asp19, а 5'-OH образует водородную связь с His17. Две дополнительные водородные связи образуются с молекулами воды при открытии активного центра за счет 2'-OH и 3'-OH субстрата.
Из-за углубления активного центра внутри фермента связанный субстрат почти полностью изолируется от растворителя. [5] Экспозиция поверхности подложки к растворителю в связанном состоянии составляет 0,5% от поверхности подложки в свободном состоянии.
Реакции
[ редактировать ]АДА необратимо дезаминирует аденозин, превращая его в родственный нуклеозид инозин путем замены аминогруппы на кетогруппу.


Затем инозин может быть дерибозилирован (удален из рибозы ) другим ферментом, называемым пуриннуклеозидфосфорилазой (ПНП), превращая его в гипоксантин .
Механизм катализа
[ редактировать ]Предлагаемый механизм дезаминирования, катализируемого ADA, представляет собой стереоспецифическое присоединение-элиминирование через тетраэдрическое промежуточное соединение. [8] По любому механизму Zn 2+ поскольку сильный электрофил активирует молекулу воды, которая депротонируется основным Asp295 с образованием атакующего гидроксида. [5] His238 ориентирует молекулу воды и стабилизирует заряд атакующего гидроксида. Glu217 протонируется, отдавая протон N1 субстрата.
Реакция стереоспецифична из-за расположения остатков цинка, Asp295 и His238, которые все обращены к B-стороне пуринового кольца субстрата. [5]
Конкурентное ингибирование наблюдалось для ADA, где продукт инозин действует как конкурентный ингибитор ферментативной активности. [9]
Функция
[ редактировать ]АДА считается одним из ключевых ферментов пуринового обмена. [8] Фермент был обнаружен у бактерий, растений, беспозвоночных, позвоночных и млекопитающих с высокой консервативностью аминокислотной последовательности . [6] Высокая степень консервативности аминокислотной последовательности предполагает решающую роль ADA в пути спасения пурина.
В первую очередь АДА у человека участвует в развитии и поддержании иммунной системы. Однако связь ADA также наблюдалась с дифференцировкой эпителиальных клеток , нейротрансмиссией и поддержанием беременности . [10] Также было высказано предположение, что ADA, помимо распада аденозина, стимулирует высвобождение возбуждающих аминокислот и необходима для соединения аденозиновых рецепторов A1 и гетеротримерных G-белков . [6] Дефицит аденозиндезаминазы приводит к легочному фиброзу. [11] предполагая, что хроническое воздействие высоких уровней аденозина может усугублять воспалительные реакции, а не подавлять их. Также было признано, что белок и активность AMP-дезаминазы повышаются в сердцах мышей, которые сверхэкспрессируют HIF-1α . [12] что частично объясняет пониженные уровни аденозина в сердцах, экспрессирующих HIF-1α, во время ишемического стресса. [13]
В мейотических и постмейотических мужских половых клетках ADA2 регулирует гетерохроматин посредством трансляции гена MDC1 . [14]
Патология
[ редактировать ]Некоторые мутации в гене аденозиндезаминазы приводят к тому, что он не экспрессируется. Возникающий в результате дефицит является одной из причин тяжелого комбинированного иммунодефицита (ТКИД), особенно аутосомно-рецессивного наследования. [15] Дефицитные уровни ADA также связаны с воспалением легких, гибелью клеток тимуса и дефектной передачей сигналов Т-клеточных рецепторов. [16] [17]
И наоборот, мутации, вызывающие сверхэкспрессию этого фермента, являются одной из причин гемолитической анемии . [18]
Есть некоторые свидетельства того, что другой аллель (ADA2) может привести к аутизму . [19]
Повышенный уровень ADA также связан со СПИДом . [16] [20]
Изоформы
[ редактировать ]Существует 2 изоформы АДА: АДА1 и АДА2.
- ADA1 обнаруживается в большинстве клеток организма, особенно в лимфоцитах и макрофагах , где он присутствует не только в цитозоле и ядре, но также в виде эктоформы на клеточной мембране, прикрепленной к дипептидилпептидазе-4 (также известной как CD26). ADA1 участвует в основном во внутриклеточной активности и существует как в малой форме (мономер), так и в большой форме (димер). [6] Взаимное превращение малых форм в крупные регулируется «коэффициентом преобразования» в легких. [21]
- ADA2 впервые был обнаружен в селезенке человека. [22] Впоследствии он был обнаружен в других тканях, включая макрофаги, где он сосуществует с ADA1. Две изоформы регулируют соотношение аденозина и дезоксиаденозина, усиливая уничтожение паразитов. ADA2 обнаруживается преимущественно в плазме и сыворотке человека и существует исключительно в виде гомодимера. [23]
Клиническое значение
[ редактировать ]ADA2 является преобладающей формой, присутствующей в плазме крови человека , и ее уровень увеличивается при многих заболеваниях, особенно связанных с иммунной системой: например, ревматоидном артрите , псориазе и саркоидозе . Уровень изоформы ADA2 в плазме также увеличивается при большинстве видов рака. ADA2 не распространен повсеместно, но сосуществует с ADA1 только в моноцитах-макрофагах. [ нужна ссылка ]
Общий уровень ADA в плазме можно измерить с помощью высокоэффективной жидкостной хроматографии , ферментативных или колориметрических методов. Вероятно, самая простая система — это измерение количества аммиака, выделяющегося из аденозина при расщеплении до инозина. После инкубации плазмы с забуференным раствором аденозина аммиак реагирует с реактивом Бертло с образованием синего цвета, пропорционального активности фермента. Для измерения ADA2 перед инкубацией добавляют эритро-9-(2-гидрокси-3-нонил)аденин (EHNA), чтобы ингибировать ферментативную активность ADA1. [22] Именно отсутствие ADA1 вызывает SCID .
ADA также может использоваться при исследовании лимфоцитарного плеврального выпота или перитонеального асцита , поскольку такие образцы с низким уровнем ADA практически исключают туберкулез из рассмотрения. [24]
Туберкулезный плевральный выпот теперь можно точно диагностировать по повышению уровня аденозиндезаминазы в плевральной жидкости выше 40 ЕД на литр. [25]
Кладрибин и пентостатин — противоопухолевые средства, используемые при лечении волосатоклеточного лейкоза ; механизм их действия – ингибирование аденозиндезаминазы.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000196839 – Ensembl , май 2017 г.
- ^ Jump up to: Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000017697 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Jump up to: Перейти обратно: а б с д и ж г Уилсон Д.К., Рудольф Ф.Б., Киочо Ф.А. (май 1991 г.). «Атомная структура аденозиндезаминазы в комплексе с аналогом переходного состояния: понимание катализа и мутаций иммунодефицита». Наука . 252 (5010): 1278–1284. Бибкод : 1991Sci...252.1278W . дои : 10.1126/science.1925539 . ПМИД 1925539 .
- ^ Jump up to: Перейти обратно: а б с д и Кристалли Дж., Костанци С., Ламбертуччи С., Лупиди Дж., Виттори С., Вольпини Р., Камайони Э. (март 2001 г.). «Аденозиндезаминаза: функциональное значение и различные классы ингибиторов». Обзоры медицинских исследований . 21 (2): 105–128. doi : 10.1002/1098-1128(200103)21:2<105::AID-MED1002>3.0.CO;2-U . ПМИД 11223861 . S2CID 24003578 .
- ^ Даддона П.Е., Келли В.Н. (январь 1977 г.). «Человеческая аденозиндезаминаза. Очистка и субъединичная структура» . Журнал биологической химии . 252 (1): 110–115. дои : 10.1016/S0021-9258(17)32805-3 . ПМИД 13062 .
- ^ Jump up to: Перейти обратно: а б Лоузи Х.К., Рутенбург А.Дж., Вердин Г.Л. (январь 2006 г.). «Кристаллическая структура тРНК аденозиндезаминазы TadA Staphylococcus aureus в комплексе с РНК». Структурная и молекулярная биология природы . 13 (2): 153–159. дои : 10.1038/nsmb1047 . ПМИД 16415880 . S2CID 34848284 .
- ^ Сабури А.А. , Дивсалар А., Джафари Г.А., Мусави-Мовахеди А.А., Хусаиндохт М.Р., Хакимелахи Г.Х. (май 2002 г.). «Исследование ингибирования продукта аденозиндезаминазы методами спектроскопии и калориметрии» . Журнал биохимии и молекулярной биологии . 35 (3): 302–305. дои : 10.5483/BMBRep.2002.35.3.302 . ПМИД 12297022 .
- ^ Мориваки Ю., Ямамото Т., Хигасино К. (октябрь 1999 г.). «Ферменты, участвующие в метаболизме пуринов - обзор гистохимической локализации и функциональных последствий». Гистология и гистопатология . 14 (4): 1321–1340. ПМИД 10506947 .
- ^ Блэкберн MR (2003). «Слишком много хорошего: перегрузка аденозина у мышей с дефицитом аденозиндезаминазы». Тенденции в фармакологических науках . 24 (2): 66–70. дои : 10.1016/S0165-6147(02)00045-7 . ПМИД 12559769 .
- ^ Ву Дж (2014). «4» . HIF-1α в сердце: обеспечение ишемической кардиопротекции и ремоделирование нуклеотидного обмена (диссертация).
- ^ Ву Дж, Бонд С, Чен П, Чен М, Ли Ю, Шохет Р.В., Райт Г (2015). «HIF-1α в сердце: ремоделирование нуклеотидного метаболизма» . Журнал молекулярной и клеточной кардиологии . 82 : 194–200. дои : 10.1016/j.yjmcc.2015.01.014 . ПМЦ 4405794 . ПМИД 25681585 .
- ^ Чукралла Л.Г., Бадринат А., Виттор Г.Г., Снайдер Э.М. ADAD2 регулирует гетерохроматин в мейотических и постмейотических мужских зародышевых клетках посредством трансляции MDC1. J Cell Sci. 2022, 15 февраля;135(4):jcs259196. doi: 10.1242/jcs.259196. Электронная публикация 2022 г., 22 февраля. PMID 35191498; PMCID: PMC8919335
- ^ Санчес Дж. Дж., Монаган Г., Бёрстинг С., Норбери Дж., Морлинг Н., Гаспар Х.Б. (май 2007 г.). «Носимая частота нонсенс-мутации в гене аденозиндезаминазы (ADA) предполагает высокую частоту тяжелого комбинированного иммунодефицита (SCID) с дефицитом ADA в Сомали, а единственный общий гаплотип указывает на общее происхождение». Анналы генетики человека . 71 (Часть 3): 336–47. дои : 10.1111/j.1469-1809.2006.00338.x . ПМИД 17181544 . S2CID 34850391 .
- ^ Jump up to: Перейти обратно: а б Блэкберн М.Р., Келлемс Р.Э. (2005). Дефицит аденозиндезаминазы: метаболическая основа иммунного дефицита и воспаления легких . Достижения иммунологии. Том. 86. стр. 1–41. дои : 10.1016/S0065-2776(04)86001-2 . ISBN 9780120044863 . ПМИД 15705418 .
- ^ Апасов С.Г., Блэкберн М.Р., Келлемс Р.Э., Смит П.Т., Ситковский М.В. (июль 2001 г.). «Дефицит аденозиндезаминазы увеличивает апоптоз тимуса и вызывает дефектную передачу сигналов Т-клеточных рецепторов» . Журнал клинических исследований . 108 (1): 131–141. дои : 10.1172/JCI10360 . ПМК 209335 . ПМИД 11435465 .
- ^ Чоттинер Э.Г., Клофт Х.Дж., Тарталья А.П., Митчелл Б.С. (март 1987 г.). «Повышенная активность аденозиндезаминазы и наследственная гемолитическая анемия. Доказательства аномального трансляционного контроля синтеза белка» . Журнал клинических исследований . 79 (3): 1001–5. дои : 10.1172/JCI112866 . ПМК 424261 . ПМИД 3029177 .
- ^ Персико А.М., Милитерни Р., Браваччо С., Шнайдер С., Мелмед Р., Трилло С., Монтекки Ф., Палермо М.Т., Паскуччи Т., Пуглизи-Аллегра С., Райхельт К.Л., Кончиатори М., Бальди А., Келлер Ф. (декабрь 2000 г.). «Аллели аденозиндезаминазы и аутистическое расстройство: исследования случай-контроль и семейные ассоциации». Американский журнал медицинской генетики . 96 (6): 784–90. doi : 10.1002/1096-8628(20001204)96:6<784::AID-AJMG18>3.0.CO;2-7 . ПМИД 11121182 .
- ^ Коуэн М.Дж., Брэди Р.О., Виддер К.Дж. (февраль 1986 г.). «Повышенная активность аденозиндезаминазы эритроцитов у больных с синдромом приобретенного иммунодефицита» . Труды Национальной академии наук Соединенных Штатов Америки . 83 (4): 1089–1091. Бибкод : 1986PNAS...83.1089C . дои : 10.1073/pnas.83.4.1089 . ПМК 323016 . ПМИД 3006027 .
- ^ Шредер В.П., Стейси А.Р. (сентябрь 1977 г.). «Очистка и субъединичная структура аденозиндезаминазы из почек человека» . Журнал биологической химии . 252 (18): 6409–6415. дои : 10.1016/S0021-9258(17)39973-8 . ПМИД 893413 .
- ^ Jump up to: Перейти обратно: а б Шредер В.П., Поллара Б., Мейвиссен Х.Дж. (январь 1978 г.). «Характеристика остаточной аденозиндезаминизирующей активности в селезенке больного с сочетанным иммунодефицитом и дефицитом аденозиндезаминазы» . Труды Национальной академии наук Соединенных Штатов Америки . 75 (1): 446–50. Бибкод : 1978PNAS...75..446S . дои : 10.1073/pnas.75.1.446 . ПМК 411266 . ПМИД 24216 .
- ^ Завьялов А.В., Энгстрем А. (октябрь 2005 г.). «Человеческий ADA2 принадлежит к новому семейству факторов роста с активностью аденозиндезаминазы» . Биохимический журнал . 391 (Часть 1): 51–57. дои : 10.1042/BJ20050683 . ПМЦ 1237138 . ПМИД 15926889 .
- ^ Хименес Кастро Д., Диас Нуэво Дж., Перес-Родригес Э., Лайт Р.В. (2003). «Диагностическая ценность аденозиндезаминазы в нетуберкулезных лимфоцитарных плевральных выпотах» (PDF) . Евро. Дыхание. Дж . 21 (2): 220–4. дои : 10.1183/09031936.03.00051603 . ПМИД 12608433 . S2CID 10703687 .
- ^ Бруникади Ф., Андерсен Д., Биллиар Т., Данн Д., Хантер Дж., Поллок Р.Э. (2005). «Глава 18, вопрос 16». Принципы хирургии Шварца (8-е изд.). Нью-Йорк: McGraw-Hill Professional. ISBN 978-0071410908 .
Дальнейшее чтение
[ редактировать ]- да Кунья Дж.Г. (1992). «[Аденозиндезаминаза. Многодисциплинарный фермент]». Португальский медицинский закон . 4 (6): 315–23. ПМИД 1807098 .
- Франко Р., Касадо В., Сируэла Ф., Саура К., Маллол Дж., Канела Э.И., Луис К. (июль 1997 г.). «Аденозинддезаминаза клеточной поверхности: гораздо больше, чем эктофермент». Прогресс нейробиологии . 52 (4): 283–94. дои : 10.1016/S0301-0082(97)00013-0 . ПМИД 9247966 . S2CID 40318396 .
- Валенсуэла А., Бланко Дж., Каллебо С., Жакото Э., Луис С., Ованесян А.Г., Франко Р. (1997). «Оболочка ВИЧ-1 gp120 и вирусные частицы блокируют связывание аденозиндезаминазы с CD26 человека». Клеточные пептидазы в иммунных функциях и заболеваниях . Достижения экспериментальной медицины и биологии. Том. 421. стр. 185–92. дои : 10.1007/978-1-4757-9613-1_24 . ISBN 978-1-4757-9615-5 . ПМИД 9330696 .
- Мориваки Ю., Ямамото Т., Хигасино К. (октябрь 1999 г.). «Ферменты, участвующие в метаболизме пуринов - обзор гистохимической локализации и функциональных последствий». Гистология и гистопатология . 14 (4): 1321–40. ПМИД 10506947 .
- Хиршхорн Р. (1993). «Идентификация двух новых миссенс-мутаций (R156C и S291L) у двух пациентов с ADA-SCID, необычных для ответа на терапию с частичными обменными трансфузиями». Человеческая мутация . 1 (2): 166–8. дои : 10.1002/humu.1380010214 . ПМИД 1284479 . S2CID 44617309 .
- Берквенс Т.М., ван Ормондт Х., Герритсен Э.Дж., Хан П.М., ван дер Эб А.Дж. (август 1990 г.). «Идентичная делеция 3250 п.н. между двумя повторами AluI в генах ADA неродственных пациентов с ADA-SCID». Геномика . 7 (4): 486–90. дои : 10.1016/0888-7543(90)90190-6 . ПМИД 1696926 .
- Аран Дж. М., Коломер Д., Матутес Э., Вивес-Корронс Дж. Л., Франко Р. (август 1991 г.). «Присутствие аденозиндезаминазы на поверхности мононуклеаров крови: иммунохимическая локализация с помощью световой и электронной микроскопии» . Журнал гистохимии и цитохимии . 39 (8): 1001–8. дои : 10.1177/39.8.1856451 . ПМИД 1856451 .
- Биелат К., Трич Г.Л. (апрель 1989 г.). «Эктоферментная активность аденозиндезаминазы эритроцитов человека». Молекулярная и клеточная биохимия . 86 (2): 135–42. дои : 10.1007/BF00222613 . ПМИД 2770711 . S2CID 20850552 .
- Хиршхорн Р., Цалл С., Элленбоген А., Оркин Ш. (февраль 1989 г.). «Идентификация точечной мутации, приводящей к термолабильной аденозиндезаминазе (АДА) у двух неродственных детей с частичным дефицитом АДА» . Журнал клинических исследований . 83 (2): 497–501. дои : 10.1172/JCI113909 . ПМК 303706 . ПМИД 2783588 .
- Мюррей Дж.Л., Перес-Солер Р., Байуотерс Д., Херш Э.М. (январь 1986 г.). «Снижение активности аденозиндезаминазы (ADA) и 5'-нуклеотидазы (5NT) в Т-клетках периферической крови при болезни Ходжкина». Американский журнал гематологии . 21 (1): 57–66. дои : 10.1002/ajh.2830210108 . ПМИД 3010705 . S2CID 25540139 .
- Вигинтон Д.А., Каплан Д.Дж., Стейтс Дж.К., Акесон А.Л., Перме К.М., Билык И.Дж., Вон А.Дж., Латтье Д.Л., Хаттон Дж.Дж. (декабрь 1986 г.). «Полная последовательность и структура гена аденозиндезаминазы человека». Биохимия . 25 (25): 8234–44. дои : 10.1021/bi00373a017 . ПМИД 3028473 .
- Акесон А.Л., Вигинтон Д.А., Дусинг М.Р., Стейтс Дж.К., Хаттон Дж.Дж. (ноябрь 1988 г.). «Мутантные аллели аденозиндезаминазы человека и их экспрессия путем трансфекции в фибробласты» . Журнал биологической химии . 263 (31): 16291–6. дои : 10.1016/S0021-9258(18)37591-4 . ПМИД 3182793 .
- Глэйдер Б.Е., Бэкер К. (февраль 1988 г.). «Повышенная активность аденозиндезаминазы эритроцитов: маркер нарушения эритропоэза при анемии Даймонда-Блэкфана и других гематологических заболеваниях». Британский журнал гематологии . 68 (2): 165–8. дои : 10.1111/j.1365-2141.1988.tb06184.x . ПМИД 3348976 . S2CID 44789636 .
- Петерсен М.Б., Транебьерг Л., Томмеруп Н., Найгаард П., Эдвардс Х. (февраль 1987 г.). «Новое отнесение локуса гена аденозиндезаминазы к хромосоме 20q13 X 11 при исследовании пациента с интерстициальной делецией 20q» . Журнал медицинской генетики . 24 (2): 93–6. дои : 10.1136/jmg.24.2.93 . ПМЦ 1049896 . ПМИД 3560174 .
- Оркин С.Х., Гофф С.К., Келли В.Н., Даддона П.Е. (апрель 1985 г.). «Транзиентная экспрессия кДНК аденозиндезаминазы человека: идентификация нефункционального клона, возникающего в результате замены одной аминокислоты» . Молекулярная и клеточная биология . 5 (4): 762–7. дои : 10.1128/mcb.5.4.762 . ПМК 366780 . ПМИД 3838797 .
- Валерио Д., Дуйвестейн М.Г., Деккер Б.М., Вида Г., Берквенс Т.М., ван дер Воорн Л., ван Ормондт Х., ван дер Эб ЭйДжей (февраль 1985 г.). «Аденозиндезаминаза: характеристика и экспрессия гена с замечательным промотором» . Журнал ЭМБО . 4 (2): 437–43. дои : 10.1002/j.1460-2075.1985.tb03648.x . ПМК 554205 . ПМИД 3839456 .
- Бонтрон Д.Т., Маркхэм А.Ф., Гинзбург Д., Оркин С.Х. (август 1985 г.). «Идентификация точечной мутации в гене аденозиндезаминазы, ответственной за иммунодефицит» . Журнал клинических исследований . 76 (2): 894–7. дои : 10.1172/JCI112050 . ПМЦ 423929 . ПМИД 3839802 .
- Даддона П.Е., Шевак Д.С., Келли В.Н., Аргос П., Маркхэм А.Ф., Оркин С.Х. (октябрь 1984 г.). «Аденозинддезаминаза человека. кДНК и полная первичная аминокислотная последовательность» . Журнал биологической химии . 259 (19): 12101–6. дои : 10.1016/S0021-9258(20)71325-6 . ПМИД 6090454 .
- Валерио Д., Дуйвестейн М.Г., Мира Хан П., Гертс ван Кессель А., де Ваард А., ван дер Эб А.Дж. (ноябрь 1983 г.). «Выделение клонов кДНК аденозиндезаминазы человека». Джин . 25 (2–3): 231–40. дои : 10.1016/0378-1119(83)90227-5 . ПМИД 6198240 .
Внешние ссылки
[ редактировать ]- Расположение человеческого гена ADA в браузере генома UCSC .
- Подробная информация о генах человека ADA в браузере генома UCSC .
- PDBe-KB предоставляет обзор всей информации о структуре, доступной в PDB для аденозиндезаминазы человека.
- PDBe-KB предоставляет обзор всей информации о структуре, доступной в PDB для аденозиндезаминазы мыши.