Фосфорибозилглицинамидформилтрансфераза
| Фосфорибозилглицинамидформилтрансфераза | |||
|---|---|---|---|
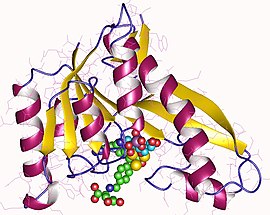 Мономер формилтрансферазы GAR, человек | |||
| Идентификаторы | |||
| Номер ЕС. | 2.1.2.2 | ||
| Номер CAS. | 2604945 | ||
| Альт. имена | 2-амино-N-рибозилацетамид-5'-фосфат-трансформилаза, GAR-формилтрансфераза, GAR-трансформилаза, глицинамид-рибонуклеотид-трансформилаза, GAR-TFаза, 5,10-метенилтетрагидрофолат:2-амино-N-рибозилацетамид рибонуклеотид-трансформилаза | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| |||
Фосфорибозилглицинамидформилтрансфераза ( EC 2.1.2.2 ), также известная как глицинамидрибонуклеотидтрансформилаза ( GAR Tfase ), [1] представляет собой фермент с систематическим названием 10-формилтетрагидрофолат:5'-фосфорибозилглицинамид-N-формилтрансфераза . [2] [3] [4] Этот фермент катализирует следующую химическую реакцию
- 10-формилтетрагидрофолат + N 1 -(5-фосфо-D-рибозил)глицинамид тетрагидрофолат + N 2 -формил-N 1 -(5-фосфо-D-рибозил)глицинамид

Этот тетрагидрофолат-зависимый фермент (ТГФ) катализирует нуклеофильное ацильное замещение формильной группы с 10-формилтетрагидрофолата (fTHF) на N 1 -(5-фосфо-D-рибозил)глицинамид (GAR) с образованием N 2 -формил-N 1 -(5-фосфо-D-рибозил)глицинамид (fGAR), как показано выше. [5] Эта реакция играет важную роль в образовании пурина посредством de novo пути биосинтеза пуринов . Этот путь создает инозинмонофосфат (ИМФ), предшественник аденозинмонофосфата (АМФ) и гуанозинмонофосфата (ГМФ). AMP является строительным блоком для важных энергоносителей, таких как АТФ, НАД. + и FAD , и сигнальные молекулы, такие как цАМФ . Роль GARTfase в биосинтезе пуринов de novo делает ее мишенью для противораковых препаратов. [6] и его сверхэкспрессия во время постнатального развития связана с синдромом Дауна . [7] Известны два типа генов, кодирующих трансформилазу GAR у Escherichia coli : purN и purT, тогда как у человека обнаружен только purN. [8] Многие остатки в активном центре консервативны в ферментах бактерий, дрожжей, птиц и человека. [9]
Структура фермента
[ редактировать ]
У человека GARTfase является частью трехфункционального фермента , который также включает глицинамидрибонуклеотидсинтазу ( GARS ) и аминоимидазолрибонуклеотидсинтетазу ( AIRS ). Этот белок (110 кДа) катализирует этапы 2, 3 и 5 биосинтеза пуринов de novo. Близость этих ферментных единиц и гибкость белка способствуют увеличению пропускной способности пути. GARTfase расположена на С-конце белка. [11]
Человеческая GARTfase была кристаллизована методом сидячей капельной диффузии и визуализирована в Стэнфордской лаборатории синхротронного излучения (SSRL) по крайней мере двумя группами. [1] [6]
Структуру можно описать двумя субдоменами, соединенными семинитевым бета-листом. N-концевой домен состоит из мононуклеотидной складки типа Россмана с четырехцепочечной частью бета-листа, окруженной с каждой стороны двумя альфа-спиралями. Бета-лист продолжается в С-концевой домен, где с одной стороны он покрыт длинной альфа-спиралью, а с другой частично подвергается воздействию растворителя. Это расщелина между двумя субдоменами, где находится активный сайт. [9]
Расщелина состоит из сайта связывания GAR и кармана, связывающего фолат. Карман для связывания фолата ограничен щелью, связывающей птеридин, областью переноса формила и областью бензоилглутамата, которые связывают птеридиновую головку и бензоилглутаматный хвост, соединенные формил-связанным азотом fTHF. Эта область, связывающая фолат, стала предметом многочисленных исследований, поскольку ее ингибирование малыми молекулами привело к открытию противоопухолевых препаратов. Было показано, что фолат-связывающая петля меняет конформацию в зависимости от pH раствора, и поэтому трансформилаза GAR человека проявляет наибольшую активность при pH 7,5–8. Условия более низкого pH (~ 4,2) также меняют конформацию петель связывания субстрата (GAR). [1]
Механизм
[ редактировать ]Механизм PurN GARTfase
[ редактировать ]
Кляйн и др. впервые предложил механизм, основанный на молекулах воды. Одна молекула воды, возможно, удерживаемая на месте за счет водородной связи с карбоксилатной группой персистентного остатка Asp144, переносит протоны от GAR-N к THF-N. Нуклеофильный азот на концевой аминогруппе GAR атакует карбонильный углерод формильной группы ТГФ, передавая отрицательный заряд кислороду. Кляйн предполагает, что His108 стабилизирует переходное состояние за счет водородной связи с отрицательно заряженным кислородом и что образование двойной карбонильной связи приводит к разрыву связи ТГФ-N-формил. Расчеты Qiao et al. предполагают, что ступенчатый перенос протона с помощью воды от Gar-N к THF-N на 80-100 кДж/моль более выгоден, чем согласованный перенос, предложенный Кляйном. Показанный механизм предложен Qiao et al., которые, по общему признанию, не учитывали окружающие остатки в своих расчетах. [12] [13] Большая часть раннего картирования активного сайта на GAR TFase была определена с помощью бактериального фермента из-за его количества, доступного в результате его сверхэкспрессии в E. coli . [14] Используя аффинный аналог бромацетилдидеазафолата, Джеймс Инглез и его коллеги впервые идентифицировали Asp144 как остаток активного центра, вероятно, участвующий в механизме переноса формила. [15]
Механизм PurT GARTfase
[ редактировать ]Исследования PurT-варианта трансформилазы GAR в E. coli показали, что реакция протекает через промежуточный формилфосфат. Хотя реакция in vitro может протекать без ТГФ, в целом реакция in vivo такая же. [16]
Участие в de novo биосинтезе пуринов
[ редактировать ]GART катализирует третий этап биосинтеза пуринов de novo - образование N 2 -формил-N 1 -(5-фосфо-D-рибозил)глицинамид (fGAR) путем присоединения формила к N 1 -(5-фосфо-D-рибозил)глицинамид (GAR). [4] В E. coli фермент purN представляет собой белок массой 23 кДа. [17] но у людей он является частью трехфункционального белка массой 110 кДа, который включает в себя функции AIRS и GARS. [11] Этот белок катализирует три различных этапа пуринового пути de novo .
Актуальность заболевания
[ редактировать ]Раковая мишень
[ редактировать ]Из-за повышенной скорости роста и метаболических потребностей раковые клетки полагаются на биосинтез нуклеотидов de novo для достижения необходимых уровней АМФ и ГМФ. [18] Возможность блокировать любой из этапов пуринового пути de novo приведет к значительному снижению роста опухоли. Были проведены исследования как по связыванию субстрата, так и по связыванию субстрата. [19] и сайт связывания фолата [20] найти ингибиторы.
Синдром Дауна
[ редактировать ]Предполагается, что GARTfase связана с синдромом Дауна. Ген, кодирующий трифункциональный белок человека GARS-AIRS-GART, расположен на хромосоме 21q22.1, в критической области синдрома Дауна. Белок сверхэкспрессируется в мозжечке во время постнатального развития людей с синдромом Дауна. Обычно этот белок не обнаруживается в мозжечке вскоре после рождения, но обнаруживается в больших количествах во время внутриутробного развития. [7] [21]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с Чжан Ю., Дешарне Дж., Грисли С.Э., Бердсли Г.П., Богер Д.Л., Уилсон И.А. (декабрь 2002 г.). «Кристаллические структуры человеческой GAR-Tfase при низком и высоком pH и с субстратом бета-GAR». Биохимия . 41 (48): 14206–15. дои : 10.1021/bi020522m . ПМИД 12450384 .
- ^ Хартман С.К., Бьюкенен Дж.М. (июль 1959 г.). «Биосинтез пуринов. XXVI. Идентификация формильных доноров реакций трансформации». Журнал биологической химии . 234 (7): 1812–6. ПМИД 13672969 .
- ^ Смит Г.К., Бенкович П.А., Бенкович С.Дж. (июль 1981 г.). «L (-)-10-формилтетрагидрофолат является кофактором глицинамид-рибонуклеотид-трансформилазы из куриной печени». Биохимия . 20 (14): 4034–6. дои : 10.1021/bi00517a013 . ПМИД 7284307 .
- ^ Перейти обратно: а б Уоррен Л., Бьюкенен Дж. М. (декабрь 1957 г.). «Биосинтез пуринов. XIX. 2-амино-N-рибозилацетамид-5'-фосфат (глицинамид риботид) трансформилаза». Журнал биологической химии . 229 (2): 613–26. ПМИД 13502326 .
- ^ Макмерри, Дж. и Тадг, Б. Органическая химия биологических путей.
- ^ Перейти обратно: а б Коннелли С., ДеМартино Дж.К., Богер Д.Л., Уилсон И.А. (июль 2013 г.). «Биологическая и структурная оценка 10R- и 10S-метилтио-DDACTHF обнаруживает новую роль серы в ингибировании глицинамидрибонуклеотидтрансформилазы» . Биохимия . 52 (30): 5133–44. дои : 10.1021/bi4005182 . ПМЦ 3823235 . ПМИД 23869564 .
- ^ Перейти обратно: а б Банерджи Д., Нандагопал К. (декабрь 2007 г.). «Потенциальное взаимодействие между геном GARS-AIRS-GART и фактором транскрипции CP2/LBP-1c/LSF при болезни Альцгеймера, связанной с синдромом Дауна». Клеточная и молекулярная нейробиология . 27 (8): 1117–26. дои : 10.1007/s10571-007-9217-2 . ПМИД 17902044 .
- ^ Найгаард П., Смит Дж. М. (июнь 1993 г.). «Доказательства существования новой глицинамидрибонуклеотидтрансформилазы в Escherichia coli» . Журнал бактериологии . 175 (11): 3591–7. дои : 10.1128/jb.175.11.3591-3597.1993 . ПМК 204760 . ПМИД 8501063 .
- ^ Перейти обратно: а б Чен П., Шульце-Гахмен У, Стура Э.А., Инглезе Дж., Джонсон Д.Л., Маролевски А., Бенкович С.Дж., Уилсон И.А. (сентябрь 1992 г.). «Кристаллическая структура глицинамидрибонуклеотидтрансформилазы из Escherichia coli с разрешением 3,0 А. Целевой фермент для химиотерапии». Журнал молекулярной биологии . 227 (1): 283–92. дои : 10.1016/0022-2836(92)90698-j . ПМИД 1522592 .
- ^ Чжан, Ю., Дешарне, Дж., Богер, Д.Л., Уилсон, И.А. (2005) «Комплексная структура человеческой GAR Tfase с 10-(трифторацетил)-5,10-дидеазаациклической-5,6,7,8-тетрагидрофолиевой кислотой. и субстрат бета-GAR». Неопубликовано. PDB: 1RBY .
- ^ Перейти обратно: а б Велин М, Гроссманн Й.Г., Флодин С., Найман Т., Стенмарк П., Тресог Л., Котенёва Т., Йоханссон И., Нордлунд П., Лехтиё Л. (ноябрь 2010 г.). «Структурные исследования трифункциональной GART человека» . Исследования нуклеиновых кислот . 38 (20): 7308–19. дои : 10.1093/nar/gkq595 . ПМЦ 2978367 . ПМИД 20631005 .
- ^ Кляйн С., Чен П., Аревало Дж.Х., Стура Э.А., Маролевски А., Уоррен М.С., Бенкович С.Дж., Уилсон И.А. (май 1995 г.). «На пути к разработке лекарств на основе структуры: кристаллическая структура мультисубстратного аддуктного комплекса глицинамидрибонуклеотидтрансформилазы с разрешением 1,96 А». Журнал молекулярной биологии . 249 (1): 153–75. дои : 10.1006/jmbi.1995.0286 . ПМИД 7776369 .
- ^ Цяо QA, Цзинь Ю, Ян С, Чжан Цз, Ван М (декабрь 2005 г.). «Квантово-химическое исследование механизма действия ингибитора глицинамид-рибонуклеотид-трансформилазы: 10-формил-5,8,10-тридеазафолиевой кислоты». Биофизическая химия . 118 (2–3): 78–83. дои : 10.1016/j.bpc.2005.07.001 . ПМИД 16198047 .
- ^ Инглезе Дж., Джонсон Д.Л., Шиау А., Смит Дж.М., Бенкович С.Дж. (февраль 1990 г.). «Субклонирование, характеристика и аффинное мечение глицинамидрибонуклеотидтрансформилазы Escherichia coli». Биохимия . 29 (6): 1436–43. дои : 10.1021/bi00458a014 . ПМИД 2185839 .
- ^ Инглезе Дж., Смит Дж.М., Бенкович С.Дж. (июль 1990 г.). «Картирование активных сайтов и сайт-специфический мутагенез глицинамидрибонуклеотидтрансформилазы из Escherichia coli». Биохимия . 29 (28): 6678–87. дои : 10.1021/bi00480a018 . ПМИД 2204419 .
- ^ Маролевски А.Е., Маттиа К.М., Уоррен М.С., Бенкович С.Дж. (июнь 1997 г.). «Формилфосфат: предлагаемый промежуточный продукт в реакции, катализируемой трансформилазой PurT GAR Escherichia coli». Биохимия . 36 (22): 6709–16. дои : 10.1021/bi962961p . ПМИД 9184151 .
- ^ Никсон А.Е., Бенкович С.Дж. (май 2000 г.). «Повышение эффективности формильного переноса гибридного фермента GAR-трансформилазы» . Белковая инженерия . 13 (5): 323–7. дои : 10.1093/протеин/13.5.323 . ПМИД 10835105 .
- ^ Тонг X, Чжао Ф, Томпсон CB (февраль 2009 г.). «Молекулярные детерминанты биосинтеза нуклеотидов de novo в раковых клетках» . Текущее мнение в области генетики и развития . 19 (1): 32–7. дои : 10.1016/j.где.2009.01.002 . ПМК 2707261 . ПМИД 19201187 .
- ^ Антле В.Д., Донат Н., Хуа М., Ляо П.Л., Винс Р., Карперелли К.А. (октябрь 1999 г.). «Субстратная специфичность глицинамидрибонуклеотидтрансформилазы человека». Архив биохимии и биофизики . 370 (2): 231–5. дои : 10.1006/abbi.1999.1428 . ПМИД 10577357 .
- ^ Кости MP, Ferrari S (июнь 2001 г.). «Обновленная информация о целевых показателях антифолатных препаратов». Текущие цели по борьбе с наркотиками . 2 (2): 135–66. дои : 10.2174/1389450013348669 . ПМИД 11469716 .
- ^ Бродский Г., Барнс Т., Блескан Дж., Беккер Л., Кокс М., Паттерсон Д. (ноябрь 1997 г.). «Ген человека GARS-AIRS-GART кодирует два белка, которые дифференциально экспрессируются во время развития мозга человека и временно сверхэкспрессируются в мозжечке у людей с синдромом Дауна» . Молекулярная генетика человека . 6 (12): 2043–50. дои : 10.1093/hmg/6.12.2043 . ПМИД 9328467 .
Внешние ссылки
[ редактировать ]- Фосфорибозилглицинамид + формилтрансфераза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
