Пуриновый обмен
Эта статья включает список общих ссылок , но в ней отсутствуют достаточные соответствующие встроенные цитаты . ( Июль 2014 г. ) |
Пуриновый метаболизм относится к метаболическим путям синтеза и расщепления пуринов , которые присутствуют во многих организмах.
Биосинтез [ править ]
Пурины биологически синтезируются в виде нуклеотидов и, в частности, в виде риботидов, т.е. оснований, присоединенных к рибозо-5-фосфату . И аденин , и гуанин происходят из нуклеотида инозинмонофосфата (ИМФ), который является первым соединением на пути, имеющим полностью сформированную пуриновую кольцевую систему.
ИМП [ править ]
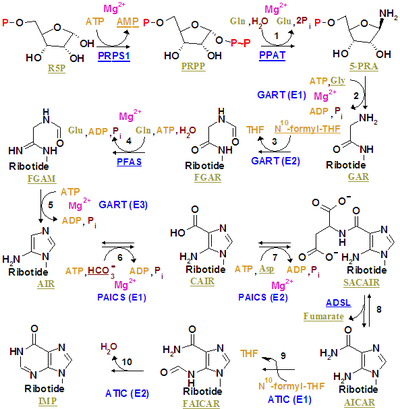
Инозинмонофосфат синтезируется на основе уже существующего рибозофосфата сложным путем (как показано на рисунке справа). Источником атомов углерода и азота пуринового кольца, 5 и 4 соответственно, являются различные источники. Аминокислота глицин вносит все свои атомы углерода (2) и азота (1), а также дополнительные атомы азота от глутамина (2) и аспарагиновой кислоты (1), а также дополнительные атомы углерода от формильных групп (2), которые переносятся из коэнзим тетрагидрофолат как 10-формилтетрагидрофолат и атом углерода из бикарбоната (1). Формильные группы образуют углерод-2 и углерод-8 в пуриновой кольцевой системе, которые действуют как мостики между двумя атомами азота.
Ключевым регуляторным этапом является производство 5-фосфо-α- D -рибозил-1-пирофосфата ( PRPP ) рибозофосфатпирофосфокиназой, которая активируется неорганическим фосфатом и инактивируется пуриновыми рибонуклеотидами. Это не обязательный шаг к синтезу пуринов, поскольку PRPP также используется в синтезе и путях утилизации пиримидинов.
Первым обязательным шагом является реакция PRPP, глутамина и воды с 5'-фосфорибозиламином (PRA), глутаматом и пирофосфатом , катализируемая амидофосфорибозилтрансферазой , которая активируется PRPP и ингибируется AMP , GMP и IMP .
- PRPP + L-глютамин + H 2 O → PRA + L-глутамат + PPi
На втором этапе происходит реакция PRA , глицина и АТФ с образованием GAR , ADP и пирофосфата, катализируемая фосфорибозиламин-глицинлигазой (GAR-синтетазой). Из-за химической лабильности PRA, период полураспада которого составляет 38 секунд при pH 7,5 и 37 °C, исследователи предположили, что соединение передается от амидофосфорибозилтрансферазы к GAR-синтетазе in vivo. [1]
- ПРА + Глицин + АТФ → ГАР + АДФ + Пи
Третий катализируется фосфорибозилглицинамидформилтрансферазой .
Четвертый катализируется фосфорибозилформилглицинамидинсинтазой .
- fGAR + L-глутамин + АТФ → fGAM + L-глутамат + АДФ + Pi
Пятый катализируется AIR-синтетазой (FGAM-циклазой) .
- фГАМ + АТФ → АИР + АДФ + Пи + Н 2 О
Шестой катализируется фосфорибозиламиноимидазолкарбоксилазой .
Седьмой катализируется фосфорибозиламиноимидазолсукцинокарбоксамидсинтазой .
- CAIR + L-аспартат + АТФ → SAICAR + ADP + Pi
Восьмерка катализируется аденилосукцинатлиазой .
Продукты AICAR и фумарат распространяются двумя разными путями. AICAR служит реагентом на девятом этапе, в то время как фумарат транспортируется в цикл лимонной кислоты, который затем может пропускать этапы выделения углекислого газа с образованием малата. Превращение фумарата в малат катализируется фумаразой. Таким образом, фумарат связывает синтез пуринов с циклом лимонной кислоты. [2]
Девятый катализируется фосфорибозиламиноимидазолкарбоксамидформилтрансферазой .
- AICAR + fTHF → FAICAR + THF
Последний этап катализируется инозинмонофосфатсинтазой .
- ФАЙКАР → ИМП + Н 2 О
У эукариот второй, третий и пятый этапы катализируются трифункциональным пуриновым биосинтетическим белком аденозин-3 , который кодируется геном GART.
И девятый, и десятый этап выполняются с помощью одного белка, называемого бифункциональным белком биосинтеза пуринов PURH, кодируемого геном ATIC.
GMP [ править ]
- IMP-дегидрогеназа (IMPDH) превращает IMP в XMP.
- GMP-синтаза превращает XMP в GMP.
- ГМФ-редуктаза превращает ГМФ обратно в ИМП.
AMP [ править ]
- аденилосукцинатсинтаза превращает ИМФ в аденилосукцинат
- аденилосукцинатлиаза превращает аденилосукцинат в АМФ
- АМФ-деаминаза превращает АМФ обратно в ИМФ.
Деградация [ править ]
Пурины метаболизируются несколькими ферментами :
Гуанин [ править ]
- Нуклеаза освобождает нуклеотид
- Нуклеотидаза создает гуанозин
- Пуриннуклеозидфосфорилаза превращает гуанозин в гуанин.
- Гуаназа превращает гуанин в ксантин
- Ксантиноксидаза (форма ксантиноксидоредуктазы) катализирует окисление ксантина до мочевой кислоты.
Аденин [ править ]
- Нуклеаза освобождает нуклеотид
- Нуклеотидаза аденозин создает создает , затем аденозиндезаминаза . инозин
- Альтернативно, АМФ-дезаминаза создает инозиновую кислоту , затем нуклеотидаза создает инозин.
- Пуриннуклеозидфосфорилаза действует на инозин, образуя гипоксантин.
- Ксантиноксидаза катализирует биотрансформацию гипоксантина в ксантин.
- Ксантиноксидаза действует на ксантин, образуя мочевую кислоту.
пуриновых Регуляция биосинтеза нуклеотидов
Образование 5'-фосфорибозиламина из глутамина и PRPP, катализируемое аминотрансферазой PRPP, является точкой регуляции синтеза пуринов. Фермент является аллостерическим ферментом, поэтому он может превращаться из ИМФ, ГМФ и АМФ в высокой концентрации, связывая фермент и оказывая ингибирующее действие, в то время как PRPP в больших количествах связывается с ферментом, вызывающим активацию. Таким образом, IMP, GMP и AMP являются ингибиторами, а PRPP — активатором. Между образованием 5'-фосфорибозила, аминоимидазола и ИМФ не существует известной стадии регуляции.
Спасение [ править ]
Пурины, образующиеся в клеточных нуклеиновых кислотах (или из пищи), также можно сохранить и повторно использовать в новых нуклеотидах.
- Фермент аденинфосфорибозилтрансфераза (APRT) восстанавливает аденин .
- Фермент гипоксантин-гуанинфосфорибозилтрансфераза (HGPRT) восстанавливает гуанин и гипоксантин . [3] (Генетический дефицит HGPRT вызывает синдром Леша-Нихана .)
Расстройства [ править ]
Когда дефектный ген вызывает появление пробелов в процессе метаболической переработки пуринов и пиримидинов, эти химические вещества не метаболизируются должным образом, и взрослые или дети могут страдать от любого из двадцати восьми наследственных заболеваний, а возможно, и еще некоторых, пока неизвестных. Симптомы могут включать подагру , анемию, эпилепсию, задержку развития, глухоту, компульсивное самокусание, почечную недостаточность или камни или потерю иммунитета.
Пуриновый обмен может иметь дисбаланс, который может возникнуть из-за включения вредных нуклеотид-трифосфатов в ДНК и РНК, что в дальнейшем приводит к генетическим нарушениям и мутациям и, как следствие, приводит к нескольким типам заболеваний. Некоторые из заболеваний:
- Тяжелый иммунодефицит вследствие потери аденозиндезаминазы.
- Гиперурикемия и синдром Леша-Нихана вследствие потери гипоксантин-гуанинфосфорибозилтрансферазы.
- Различные виды рака связаны с увеличением активности ферментов, таких как дегидрогеназа IMP. [4]
Фармакотерапия [ править ]
Модуляция пуринового обмена имеет фармакотерапевтическое значение.
Ингибиторы синтеза пуринов подавляют пролиферацию клеток, особенно лейкоцитов . Эти ингибиторы включают азатиоприн , иммунодепрессант, используемый при трансплантации органов , аутоиммунных заболеваниях , таких как ревматоидный артрит , или воспалительных заболеваниях кишечника, таких как болезнь Крона и язвенный колит .
Микофенолата мофетил — иммунодепрессант, используемый для предотвращения отторжения при трансплантации органов; он ингибирует синтез пуринов, блокируя инозинмонофосфатдегидрогеназу (IMPDH). [5] Метотрексат также косвенно ингибирует синтез пуринов, блокируя метаболизм фолиевой кислоты (он является ингибитором дигидрофолатредуктазы ) .
Аллопуринол – препарат, который ингибирует фермент ксантиноксидоредуктазу и, таким образом, снижает уровень мочевой кислоты в организме. Это может быть полезно при лечении подагры — заболевания, вызванного избытком мочевой кислоты, образующим кристаллы в суставах.
пуриновых Пребиотический синтез рибонуклеозидов
Чтобы понять, как возникла жизнь , необходимы знания о химических путях, которые позволяют формировать ключевые строительные блоки жизни в вероятных пребиотических условиях . Нам и др. [6] продемонстрировали прямую конденсацию пуриновых и пиримидиновых азотистых оснований с рибозой с образованием рибонуклеозидов в водных микрокапельках, что является ключевым этапом, ведущим к образованию РНК. Кроме того, Becker et al. представили возможный пребиотический процесс синтеза пуриновых рибонуклеозидов. [7]
жизни Биосинтез в трех сферах пуринов
Организмы во всех трех сферах жизни — эукариоты , бактерии и археи — способны осуществлять de novo биосинтез пуринов . Эта способность отражает необходимость пуринов для жизни. Биохимический путь синтеза очень похож у эукариот и бактерий, но более изменчив у архей. [8] Было установлено, что почти полный или полный набор генов, необходимых для биосинтеза пуринов, присутствует у 58 из 65 изученных видов архей. [8] Однако были также идентифицированы семь видов архей, у которых полностью или почти полностью отсутствовали гены, кодирующие пурин. По-видимому, виды архей, неспособные синтезировать пурины, способны приобретать экзогенные пурины для роста. [8] и, таким образом, подобны пуриновым мутантам эукариот, например пуриновым мутантам гриба Ascomycete Neurospora crassa , [9] которым также необходимы экзогенные пурины для роста.
См. также [ править ]
- Пуринергическая передача сигналов
- Модифицирующий течение болезни противоревматический препарат (БПВП)
Ссылки [ править ]
- ^ Антле В.Д., Лю Д., МакКеллар Б.Р., Каперелли К.А., Хуа М., Винс Р. (апрель 1996 г.). «Субстратная специфичность глицинамидрибонуклеотидсинтетазы куриной печени» . Журнал биологической химии . 271 (14): 8192–5. дои : 10.1074/jbc.271.14.8192 . ПМИД 8626510 .
- ^ Гаррет Р.Х., Гришэм К.М. (2016). Биохимия (6-е изд.). Cengage Обучение. стр. 666, 934. ISBN. 9781305577206 . OCLC 914290655 .
- ^ Ансари М.Ю., Экубал А., Дихит М.Р., Мансури Р., Рана С., Али В. и др. (февраль 2016 г.). «Установление корреляции между анализом in silico и in vitro против Leishmania HGPRT с ингибиторами». Международный журнал биологических макромолекул . 83 : 78–96. doi : 10.1016/j.ijbiomac.2015.11.051 . ПМИД 26616453 .
- ^ Панг Б., Макфалин Дж.Л., Бергис Н.Е., Донг М., Тагизаде К., Салливан М.Р. и др. (февраль 2012 г.). «Дефекты метаболизма пуриновых нуклеотидов приводят к существенному включению ксантина и гипоксантина в ДНК и РНК» . Труды Национальной академии наук Соединенных Штатов Америки . 109 (7): 2319–24. Бибкод : 2012PNAS..109.2319P . дои : 10.1073/pnas.1118455109 . JSTOR 41477470 . ПМК 3289290 . ПМИД 22308425 .
- ^ «Микофенолата Монография для профессионалов» . Наркотики.com . Архивировано из оригинала 21 апреля 2020 года . Проверено 28 октября 2019 г.
- ^ Нам И, Нам Х.Г., Заре Р.Н. (январь 2018 г.). «Абиотический синтез пуриновых и пиримидиновых рибонуклеозидов в водных микрокапельках» . Proc Natl Acad Sci США . 115 (1): 36–40. дои : 10.1073/pnas.1718559115 . ПМК 5776833 . ПМИД 29255025 .
- ^ Беккер С., Тома И., Дойч А., Герке Т., Майер П., Зипсе Х., Карелл Т. (май 2016 г.). «Высокопродуктивный, строго региоселективный путь образования пребиотических пуриновых нуклеозидов». Наука . 352 (6287): 833–6. дои : 10.1126/science.aad2808 . ПМИД 27174989 .
- ↑ Перейти обратно: Перейти обратно: а б с Браун А.М., Хупс С.Л., Уайт Р.Х., Сариски Калифорния (декабрь 2011 г.). «Биосинтез пуринов у архей: вариации на тему» . Биол Директ . 6:63 . дои : 10.1186/1745-6150-6-63 . ПМК 3261824 . ПМИД 22168471 .
- ^ Бернштейн Х (1961). «Соединения имидазола, накопленные пуриновыми мутантами Neurospora crassa ». Дж. Генерал Микробиол . 25 (1): 41–46. дои : 10.1099/00221287-25-1-41 .