фебуксостат
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Улорик, Аденурик и др. [1] |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а609020 |
| Данные лицензии |
|
| Беременность категория |
|
| Маршруты администрация | Через рот |
| код АТС | |
| Юридический статус | |
| Юридический статус |
|
| Фармакокинетические данные | |
| Биодоступность | ≥84% поглощено |
| Связывание с белками | 99,2% в альбумин |
| Метаболизм | через CYP1A1 , 1A2 , 2C8 , 2C9 , UGT1A1 , 1A8 , 1A9 [5] |
| Период полувыведения | ~5–8 часов |
| Экскреция | Моча (~49%, преимущественно в виде метаболитов, 3% в виде неизмененного препарата); фекалии (~45%, в основном в виде метаболитов, 12% в виде неизмененного препарата) |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| ИЮФАР/БПС | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.207.329 |
| Химические и физические данные | |
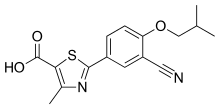
| Формула | С 16 Н 16 Н 2 О 3 С |
| Молярная масса | 316.38 g·mol −1 |
| 3D model ( JSmol ) | |
| | |
Фебуксостат под торговыми марками Uloric , продаваемый, среди прочего, , представляет собой лекарство, используемое в течение длительного времени для лечения подагры из-за высокого уровня мочевой кислоты . [6] Обычно его рекомендуют только людям, которые не могут принимать аллопуринол . [7] [8] такие лекарства, как НПВП, для предотвращения обострений подагры. При первоначальном применении часто рекомендуются [6] [8] Его принимают внутрь . [6]
Общие побочные эффекты включают проблемы с печенью, тошноту, боль в суставах и сыпь. [6] Серьезные побочные эффекты включают повышенный риск смерти по сравнению с аллопуринолом, синдром Стивенса-Джонсона и анафилаксию . [8] [7] Использование не рекомендуется во время беременности или кормления грудью . [8] Он ингибирует ксантиноксидазу , тем самым снижая выработку мочевой кислоты в организме. [6]
Фебуксостат был одобрен для медицинского применения в Европейском Союзе в 2008 году и в США в 2009 году. [9] [6] Общая версия была одобрена в 2019 году. [10] [11]
Медицинское использование
[ редактировать ]Фебуксостат используется для лечения хронической подагры и гиперурикемии . [12] Фебуксостат обычно рекомендуется только людям, которые не переносят аллопуринол. [13] Национальный институт здравоохранения и клинического мастерства пришел к выводу, что фебуксостат более эффективен, чем стандартные дозы аллопуринола , но не более эффективен, чем более высокие дозы аллопуринола. [12]

Побочные эффекты
[ редактировать ]Побочные эффекты, связанные с терапией фебуксостатом, включают тошноту, диарею, артралгию, головную боль, повышение уровня печеночных ферментов в сыворотке крови и сыпь. [14] [15]
заболеваниями в анамнезе В ноябре 2017 года FDA выпустило предупреждение о безопасности, в котором указывалось, что предварительные результаты клинических испытаний безопасности показали повышенный риск смерти от сердечно-сосудистых заболеваний при приеме фебуксостата по сравнению с аллопуринолом у людей с сердечно-сосудистыми . [16] FDA потребовало от компании Takeda провести это исследование безопасности, когда препарат был одобрен в 2009 году. На этикетках препарата фебуксостата уже есть предупреждения и меры предосторожности относительно сердечно-сосудистых событий, поскольку клинические испытания, проведенные до одобрения, показали более высокий уровень проблем с сердцем у пациентов, получавших лечение препаратом Фебуксостат. фебуксостат по сравнению с аллопуринолом. Эти проблемы включали сердечные приступы, инсульты и смерти, связанные с сердцем. В результате FDA потребовало проведения дополнительных клинических испытаний безопасности после того, как препарат был одобрен и появился на рынке, чтобы лучше понять эти различия, и это исследование недавно было завершено. [ когда? ] Исследование безопасности было проведено с участием более чем 6000 пациентов с подагрой, получавших фебуксостат или аллопуринол. Первичным исходом была комбинация смерти, связанной с сердцем, несмертельного сердечного приступа, несмертельного инсульта и состояния недостаточного кровоснабжения сердца, требующего срочного хирургического вмешательства. Предварительные результаты показывают, что в целом фебуксостат не увеличивает риск этих комбинированных явлений по сравнению с аллопуринолом. Однако, когда результаты оценивались отдельно, фебуксостат показал повышенный риск смертности от сердечно-сосудистых заболеваний и смерти от всех причин. [17]
Взаимодействие с лекарственными средствами
[ редактировать ]Фебуксостат противопоказан при одновременном применении теофиллина и химиотерапевтических средств , а именно азатиоприна и 6-меркаптопурина , поскольку он может повышать концентрацию этих препаратов в плазме крови и, следовательно, их токсичность. [14] [18]
Фармакология
[ редактировать ]Механизм действия
[ редактировать ]Фебуксостат является непуриновым селективным ингибитором ксантиноксидазы . [14] Он действует путем неконкурентной блокировки молибденового центра птерина , который является активным центром ксантиноксидазы. Ксантиноксидаза необходима для последовательного окисления гипоксантина и ксантина до мочевой кислоты. Таким образом, фебуксостат ингибирует ксантиноксидазу, тем самым снижая выработку мочевой кислоты. Фебуксостат ингибирует как окисленную, так и восстановленную формы ксантиноксидазы благодаря его прочному связыванию с сайтом птерина молибдена. [15]
Фармакокинетика
[ редактировать ]После перорального приема не менее 84% дозы фебуксостата всасывается в кишечнике, а максимальная концентрация в плазме крови достигается через 60–90 минут. При приеме вместе с жирной пищей концентрация фебуксостата в организме снижается; но это не считается клинически значимым. При попадании в кровоток 99,2% вещества связывается с белком плазмы альбумином , а 82–91% активных метаболитов - с белками плазмы. [5]

Фебуксостат имеет у человека три активных метаболита, которые образуются преимущественно рядом цитохрома Р450 ферментов печени ( CYP1A1 , 1A2 , 2C8 , 2C9 ). Один из них представляет собой дикарбоновую кислоту , два других — гидроксилированные производные. Они, как и исходный препарат, в дальнейшем глюкуронируются , главным образом, ферментами UGT1A1 , 1A8 и 1A9 . Фебуксостат и его метаболиты выводятся с мочой (49% общего количества вещества, включая 3% неизмененного фебуксостата, 30% глюкуронида фебуксостата, 13% активных метаболитов и их глюкуронидов и 3% неизвестных веществ) и с калом (45%, из них 12% неизмененного фебуксостата, 1% глюкуронида, 25% активных метаболитов и их глюкуронидов и 7% неизвестных веществ). Период полувыведения составляет пять-восемь часов. [5] [19]
История
[ редактировать ]
Фебуксостат был открыт учеными японской фармацевтической компании Teijin в 1998 году. [20] Тейджин сотрудничал с TAP Pharmaceuticals в США и Ipsen в Европе. [21] [22] [23]
Ipsen получила разрешение на продажу фебуксостата от Европейского агентства по лекарственным средствам в апреле 2008 года. [24] Компания Takeda получила одобрение FDA в феврале 2009 года. [25] [26] и Тейджин получили одобрение японских властей в 2011 году. [27] Ipsen передала эксклюзивную лицензию на свои европейские права компании Menarini в 2009 году. [28] Тейджин стал партнером Astellas для распространения в Китае и Юго-Восточной Азии. [29] [30]
Общество и культура
[ редактировать ]Экономика
[ редактировать ]В Великобритании NICE обнаружил, что фебуксостат имеет более высокое соотношение затрат и выгод, чем аллопуринол, и на этом основании рекомендовал фебуксостат в качестве препарата второй линии для людей, которые не могут использовать аллопуринол. [12]
В 2010 году, до того как он стал дженериком в США, он стоил около 160 долларов США в месяц, в отличие от аллопуринола, который стоил около 14 долларов в месяц. [31]
Торговые названия
[ редактировать ]Фебуксостат продается под названием «Аденурик» в Европе, Австралии, Новой Зеландии и Пакистане. В Пакистане он выпускается компанией SOLACE Pharmaceuticals, дочерней компанией SJG, Uloric в США, Goturic и Goutex в Латинской Америке, Feburic в Японии, Donifoxate в Египте, является дженериком в нескольких странах и доступен под многими названиями в этих странах. [1]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б «Международные названия фебуксостата» . Наркотики.com . Проверено 25 июня 2015 г.
- ^ «Использование фебуксостата (улорика) во время беременности» . Наркотики.com . 22 февраля 2019 года . Проверено 17 мая 2020 г.
- ^ «Список всех лекарств с предупреждениями о черном ящике, полученный FDA (используйте ссылки «Загрузить полные результаты» и «Просмотреть запрос»)» . nctr-crs.fda.gov . FDA . Проверено 22 октября 2023 г.
- ^ «Лекарства, отпускаемые по рецепту: регистрация новых химических веществ в Австралии, 2014 г.» . Управление терапевтических товаров (TGA) . 21 июня 2022 г. Проверено 10 апреля 2023 г.
- ^ Перейти обратно: а б с «Аденуровая кислота: EPAR – Информация о продукте» (PDF) . Европейское агентство по лекарственным средствам . 06.08.2019.
- ^ Перейти обратно: а б с д и ж «Монография фебуксостата для профессионалов» . Наркотики.com . Американское общество фармацевтов систем здравоохранения . Проверено 26 февраля 2019 г.
- ^ Перейти обратно: а б «Безопасность и доступность лекарств – FDA добавляет предупреждение в штучной упаковке о повышенном риске смерти при приеме лекарства от подагры Улорик (фебуксостат)» . FDA . 21 февраля 2019 года . Проверено 26 февраля 2019 г.
- ^ Перейти обратно: а б с д Британский национальный формуляр: BNF 76 (76-е изд.). Фармацевтическая пресса. 2018. с. 1087. ИСБН 9780857113382 .
- ^ «Аденурик | Европейское агентство лекарственных средств» . Европейское агентство по лекарственным средствам – Комиссия . 17 сентября 2018 года . Проверено 26 февраля 2019 г.
- ^ «Общая улориковая доступность» . Наркотики.com . Проверено 1 августа 2019 г.
- ^ «Фебуксостат Дженерик Улорик» . Проверено 15 апреля 2020 г.
- ^ Перейти обратно: а б с «Фебуксостат для лечения гиперурикемии у людей с подагрой (TA164). Глава 4. Рассмотрение доказательств» . Архивировано из оригинала 6 октября 2010 года.
- ^ «Фебуксостат для лечения гиперурикемии у людей с подагрой. Руководства и рекомендации» . www.nice.org.uk. 17 декабря 2008 г. Архивировано из оригинала 28 марта 2017 г. Проверено 28 марта 2017 г.
- ^ Перейти обратно: а б с «Улориковая этикетка» (PDF) . Управление по контролю за продуктами и лекарствами США. Февраль 2009 года.
- ^ Перейти обратно: а б Лав Б.Л., Бэрронс Р., Веверка А., Снайдер К.М. (июнь 2010 г.). «Уратснижающая терапия подагры: фокус на фебуксостате». Фармакотерапия . 30 (6): 594–608. дои : 10.1592/phco.30.6.594 . ПМИД 20500048 . S2CID 6617778 .
- ^ «Улорик (фебуксостат) – повышенный риск сердечно-сосудистых фатальных исходов» . Здоровье Канады. 4 ноября 2019 г.
- ^ Канцелярия комиссара. «Предупреждения о безопасности медицинских продуктов для человека — фебуксостат (торговая марка Uloric): Сообщение о безопасности лекарств — FDA для оценки повышенного риска смерти от сердечно-сосудистых заболеваний» . www.FDA.gov . Проверено 17 ноября 2017 г.
- ^ Мозаяни А, Раймон Л (2011). Справочник по взаимодействию лекарственных средств: Клиническое и судебно-медицинское руководство . Springer Science+Business Media . ISBN 978-1-61779-221-2 .
- ^ «Аденурик: EPAR – Отчет об общественной оценке» (PDF) . Европейское агентство по лекарственным средствам . 28 мая 2008 г.
- ^ «Фебуксостат Сторим» . Тейджин . Проверено 25 июня 2015 г.
- ^ Томлинсон Б. (ноябрь 2005 г.). «Фебуксостат (Тейджин/Ипсен/ТАП)». Текущее мнение об исследуемых препаратах . 6 (11): 1168–1178. ПМИД 16312139 .
- ^ Япсен Б. (17 августа 2006 г.). «FDA приостанавливает лечение подагры» . Чикаго Трибьюн .
- ^ Примечание. TAP Pharmaceuticals была предприятием совместным Abbott Laboratories и Takeda , которое было распущено в 2008 году, как указано в этом пресс-релизе: «Такеда и Abbott объявляют о планах создания совместного предприятия TAP» . Такеда .
- ^ «Аденурик (фебуксостат) получает разрешение на продажу в Европейском Союзе» (PDF) . Архивировано из оригинала (PDF) 26 марта 2009 года . Проверено 28 мая 2008 г.
- ^ «Улорик одобрен для лечения подагры» . Новости США и мировой отчет . Проверено 16 февраля 2009 г.
- ^ «Пресс-релиз: ULORIC (TMX-67, фебуксостат) получает одобрение FDA для лечения хронической гиперурикемии у пациентов с подагрой» . Тейджин и Такеда . 14 февраля 2009 г.
- ^ «Пресс-релиз: TMX-67 (фебуксостат), одобренный в Японии» . Тейджин . 21 января 2011 г. Архивировано из оригинала 26 июня 2015 г.
- ^ «Менарини выводит на рынок препарат Такеда/Ипсен для лечения подагры в 41 европейской стране» . Новости генной инженерии . Октябрь 2009 года.
- ^ «Teijin Pharma и Astellas Pharma заключают соглашение о правах на продажу TMX-67 в Китае и Гонконге» . Первое слово Фарма . 1 апреля 2010 г.
- ^ «Teijin Pharma заключает дистрибьюторское соглашение с Astellas Pharma на фебуксостат» . Взгляды на исследования . 11 августа 2011 г. Архивировано из оригинала 26 июня 2015 г.
- ^ Любовь БЛ (2010). «Фебуксостат (Улорик) при гиперурикемии и подагре» . Американский семейный врач . 81 (10): 1287 . Проверено 15 апреля 2020 г.