Углерод
 Графит (слева) и алмаз (справа), две аллотропы углерода. | |||||||||||||||||||||||||||||||
| Углерод | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Аллотропы | графит , алмаз и многое другое (см. Аллотропы углерода ) | ||||||||||||||||||||||||||||||
| Появление |
| ||||||||||||||||||||||||||||||
| Стандартный атомный вес А р °(С) | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Углерод в таблице Менделеева | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Атомный номер ( Z ) | 6 | ||||||||||||||||||||||||||||||
| Группа | группа 14 (углеродная группа) | ||||||||||||||||||||||||||||||
| Период | период 2 | ||||||||||||||||||||||||||||||
| Блокировать | p-блок | ||||||||||||||||||||||||||||||
| Электронная конфигурация | [ Он ] 2с 2 2р 2 | ||||||||||||||||||||||||||||||
| Электроны на оболочку | 2, 4 | ||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||
| Фаза в СТП | твердый | ||||||||||||||||||||||||||||||
| Точка сублимации | 3915 К (3642 °С, 6588 °F) | ||||||||||||||||||||||||||||||
| Плотность (около комнатной температуры ) | графит: 2,266 г/см 3 [3] [4] алмаз: 3,515 г/см 3 аморфный: 1,8–2,1 г/см 3 | ||||||||||||||||||||||||||||||
| Тройная точка | 4600 К, 10,800 кПа [5] [6] | ||||||||||||||||||||||||||||||
| Теплота плавления | графит: 117 кДж/моль | ||||||||||||||||||||||||||||||
| Молярная теплоемкость | графит: 8,517 Дж/(моль·К) алмаз: 6,155 Дж/(моль·К) | ||||||||||||||||||||||||||||||
| Атомные свойства | |||||||||||||||||||||||||||||||
| Стадии окисления | −4 , −3 , −2 , −1 , 0 , +1 , [7] +2 , +3 , [8] +4 [9] (слабокислотный оксид ) | ||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 2,55. | ||||||||||||||||||||||||||||||
| Энергии ионизации |
| ||||||||||||||||||||||||||||||
| Ковалентный радиус | сп 3 : 77 вечера сп 2 : 73 вечера сп: 18:00 | ||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 170 вечера | ||||||||||||||||||||||||||||||
| Другие объекты недвижимости | |||||||||||||||||||||||||||||||
| Естественное явление | первобытный | ||||||||||||||||||||||||||||||
| Кристаллическая структура | графит: простой шестиугольный ( hP4 ) | ||||||||||||||||||||||||||||||
| Константы решетки | а = 246,14 вечера с = 670,94 вечера (при 20 °С) [3] | ||||||||||||||||||||||||||||||
| Кристаллическая структура | ромб: гранецентрированный ромбовидный куб ( cF8 ) | ||||||||||||||||||||||||||||||
| Постоянная решетки | а = 356,707 вечера (при 20 °С) [3] | ||||||||||||||||||||||||||||||
| Тепловое расширение | алмаз: 0,8 мкм/(м⋅К) (при 25 °C) [10] | ||||||||||||||||||||||||||||||
| Теплопроводность | графит: 119–165 Вт/(м⋅К) алмаз: 900–2300 Вт/(м⋅К) | ||||||||||||||||||||||||||||||
| Электрическое сопротивление | графит: 7,837 мкОм⋅м [11] | ||||||||||||||||||||||||||||||
| Магнитный заказ | диамагнитный [12] | ||||||||||||||||||||||||||||||
| Молярная магнитная восприимчивость | алмаз: −5,9 × 10 −6 см 3 /моль [13] | ||||||||||||||||||||||||||||||
| Модуль Юнга | алмаз: 1050 ГПа [10] | ||||||||||||||||||||||||||||||
| Модуль сдвига | алмаз: 478 ГПа [10] | ||||||||||||||||||||||||||||||
| Объемный модуль | алмаз: 442 ГПа [10] | ||||||||||||||||||||||||||||||
| Скорость звука тонкого стержня | алмаз: 18 350 м/с (при 20 °C) | ||||||||||||||||||||||||||||||
| коэффициент Пуассона | алмаз: 0,1 [10] | ||||||||||||||||||||||||||||||
| Твердость по шкале Мооса | графит: 1–2 алмаз: 10 | ||||||||||||||||||||||||||||||
| Номер CAS |
| ||||||||||||||||||||||||||||||
| История | |||||||||||||||||||||||||||||||
| Открытие | Египтяне и шумеры [14] (3750 г. до н.э.) | ||||||||||||||||||||||||||||||
| Признан элементом | Антуан Лавуазье [15] (1789) | ||||||||||||||||||||||||||||||
| Изотопы углерода | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Углерод (от латинского carbo «уголь») — химический элемент ; он имеет символ C и атомный номер 6. Он неметаллический и четырехвалентный , что означает, что его атомы способны образовывать до четырех ковалентных связей из-за его валентной оболочки, содержащей 4 электрона. Он принадлежит к 14 группе периодической таблицы . [16] Углерод составляет около 0,025 процента земной коры. [17] три изотопа : В природе встречаются 12 С и 13 C является стабильным, в то время как 14 C — радионуклид , распадающийся с периодом полураспада 5700 лет. [18] Углерод — один из немногих элементов, известных с древности . [19]
Углерод — 15-й по распространенности элемент в земной коре и четвертый по массе элемент во Вселенной после водорода , гелия и кислорода . Обилие углерода, его уникальное разнообразие органических соединений и его необычная способность образовывать полимеры при температурах, обычно встречающихся на Земле, позволяют этому элементу служить общим элементом всей известной жизни . Это второй по распространенности элемент в организме человека по массе (около 18,5%) после кислорода. [20]
Атомы углерода могут связываться друг с другом разными способами, в результате чего образуются различные аллотропы углерода . Хорошо известные аллотропы включают графит , алмаз , аморфный углерод и фуллерены . Физические свойства углерода сильно различаются в зависимости от аллотропной формы. Например, графит непрозрачен и имеет черный цвет, а алмаз очень прозрачен . Графит достаточно мягок, чтобы образовывать полосы на бумаге (отсюда и его название, от греческого глагола «γράφειν», что означает «писать»), а алмаз — самый твердый из известных природных материалов. Графит является хорошим электропроводником, а алмаз имеет низкую электропроводность . В обычных условиях алмаз, углеродные нанотрубки и графен обладают самой высокой теплопроводностью среди всех известных материалов. Все аллотропы углерода при нормальных условиях представляют собой твердые вещества, при этом графит является наиболее термодинамически стабильной формой при стандартной температуре и давлении. Они химически устойчивы и требуют высокой температуры для реакции даже с кислородом.
Наиболее распространенная степень окисления углерода в неорганических соединениях — +4, а +2 встречается в монооксида углерода и переходных металлов карбонильных комплексах . Крупнейшими источниками неорганического углерода являются известняки , доломиты и углекислый газ , однако значительные его количества встречаются в органических отложениях угля , торфа , нефти и клатратах метана . Углерод образует огромное количество соединений , около двухсот миллионов из которых описаны и проиндексированы; [21] и все же это число составляет лишь часть числа теоретически возможных соединений в стандартных условиях.
Характеристики

Аллотропы углерода включают графит , одно из самых мягких известных веществ, и алмаз , самое твердое вещество, встречающееся в природе. Он легко связывается с другими небольшими атомами, включая другие атомы углерода, и способен образовывать множественные стабильные ковалентные связи с подходящими многовалентными атомами. Углерод является составным элементом подавляющего большинства всех химических соединений , около двухсот миллионов примеров которого описано в опубликованной химической литературе. [21] Углерод также имеет самую высокую точку сублимации среди всех элементов. При атмосферном давлении он не имеет точки плавления, так как его тройная точка составляет 10,8 ± 0,2 мегапаскаля (106,6 ± 2,0 атм; 1566 ± 29 фунтов на квадратный дюйм) и 4600 ± 300 К (4330 ± 300 ° C; 7820 ± 540 ° F). [5] [6] поэтому он сублимируется при температуре около 3900 К (3630 ° C; 6560 ° F). [23] [24] Графит гораздо более реакционноспособен, чем алмаз в стандартных условиях, несмотря на то, что он более термодинамически стабилен, поскольку его делокализованная пи-система гораздо более уязвима для атак. Например, графит можно окислить горячей концентрированной азотной кислотой при стандартных условиях до меллитовой кислоты C 6 (CO 2 H) 6 , которая сохраняет гексагональные звенья графита, разрушая при этом более крупную структуру. [25]
Углерод сублимируется в углеродной дуге, температура которой составляет около 5800 К (5530 °C или 9980 °F). Таким образом, независимо от своей аллотропной формы, углерод остается твердым при более высоких температурах, чем металлы с самой высокой температурой плавления, такие как вольфрам или рений . Несмотря на термодинамическую склонность к окислению, углерод сопротивляется окислению более эффективно, чем такие элементы, как железо и медь, которые при комнатной температуре являются более слабыми восстановителями.
в основном состоянии Углерод — шестой элемент с электронной конфигурацией 1s. 2 2 с 2 2р 2 , из которых четыре внешних электрона являются валентными электронами . Его первые четыре энергии ионизации: 1086,5, 2352,6, 4620,5 и 6222,7 кДж/моль намного выше, чем у более тяжелых элементов 14-й группы. Электроотрицательность углерода составляет 2,5, что значительно выше, чем у более тяжелых элементов группы 14 (1,8–1,9), но близко к большинству близлежащих неметаллов, а также к некоторым переходным металлам второго и третьего ряда . углерода Ковалентные радиусы обычно принимают равными 77,2 пм (C-C), 66,7 пм (C=C) и 60,3 пм (C≡C), хотя они могут варьироваться в зависимости от координационного числа и того, с чем связан углерод. Как правило, ковалентный радиус уменьшается с меньшим координационным числом и более высоким порядком связи. [26]
Соединения на основе углерода составляют основу всей известной жизни на Земле, а цикл углерод-азот-кислород обеспечивает небольшую часть энергии, производимой Солнцем, и большую часть энергии более крупных звезд (например, Сириуса ). Хотя он образует необычайное разнообразие соединений, большинство форм углерода сравнительно нереакционноспособны при нормальных условиях. При стандартной температуре и давлении он устойчив ко всем окислителям, кроме самых сильных. Не реагирует с серной кислотой , соляной кислотой , хлором и какими-либо щелочами . При повышенных температурах углерод реагирует с кислородом с образованием оксидов углерода и отбирает кислород у оксидов металлов, оставляя элементарный металл. Эта экзотермическая реакция используется в черной металлургии для выплавки железа и контроля содержания углерода в стали :
- Фе
33О
4 + 4 С (с) + 2 О
2 → 3 Fe (s) + 4 CO
2 (г) .
Углерод реагирует с серой с образованием сероуглерода , а также с паром в реакции уголь-газ, используемой при газификации угля :
- C (т) + ЧАС 2 О (г) → CO (г) + ЧАС 2(г) .
Углерод соединяется с некоторыми металлами при высоких температурах с образованием металлических карбидов, таких как карбид железа в стали и карбид вольфрама , широко используемый в качестве абразива и для изготовления твердых наконечников режущих инструментов.
Система аллотропов углерода охватывает ряд крайностей:
| Графит – один из самых мягких известных материалов. | Синтетический нанокристаллический алмаз — самый твердый из известных материалов. [27] |
| Графит — очень хорошая смазка, обладающая сверхсмазывающей способностью . [28] | Алмаз – идеальный абразив. |
| Графит является проводником электричества. [29] | Алмаз является отличным электроизолятором . [30] и имеет самое высокое электрическое поле пробоя среди всех известных материалов. |
| Некоторые формы графита используются для теплоизоляции (например, противопожарные перегородки и тепловые экраны), но некоторые другие формы являются хорошими теплопроводниками. | Алмаз – самый известный природный проводник тепла . |
| Графит непрозрачен . | Алмаз очень прозрачен. |
| Графит кристаллизуется в гексагональной системе . [31] | Алмаз кристаллизуется в кубической системе . |
| Аморфный углерод полностью изотропен . | Углеродные нанотрубки являются одними из наиболее анизотропных известных материалов. |
Аллотропы
Атомный углерод — очень недолговечный вид, и поэтому углерод стабилизируется в различных многоатомных структурах с разнообразными молекулярными конфигурациями, называемыми аллотропами . Три относительно хорошо известных аллотропа углерода — это аморфный углерод , графит и алмаз. Когда-то считавшиеся экзотическими, фуллерены в настоящее время широко синтезируются и используются в исследованиях; в их число входят бакиболлы , [32] [33] углеродные нанотрубки , [34] углеродные наноножки [35] и нановолокна . [36] [37] Также было обнаружено несколько других экзотических аллотропов, таких как лонсдейлит , [38] стеклоуглерод , [39] углеродная нанопена [40] и линейный ацетиленовый углерод (карбин). [41]
Графен представляет собой двумерный лист углерода, атомы которого расположены в гексагональной решетке. По состоянию на 2009 год графен оказался самым прочным материалом, когда-либо испытанным. [42] Процесс отделения его от графита потребует дальнейшего технологического развития, прежде чем он станет экономически выгодным для промышленных процессов. [43] В случае успеха графен можно будет использовать в конструкции космического лифта . Его также можно использовать для безопасного хранения водорода для использования в водородных двигателях автомобилей. [44]

Аморфная . форма представляет собой набор атомов углерода в некристаллическом, неправильном, стеклообразном состоянии, не удерживаемый в кристаллической макроструктуре Он присутствует в виде порошка и является основным компонентом таких веществ, как древесный уголь, ламповая сажа (сажа) и активированный уголь . При нормальном давлении углерод принимает форму графита, в котором каждый атом тригонально связан с тремя другими в плоскости, состоящей из сросшихся шестиугольных колец, как в ароматических углеводородах . [45] Полученная сетка является двумерной, а полученные плоские листы укладываются друг на друга и свободно соединяются слабыми силами Ван-дер-Ваальса . Это придает графиту мягкость и раскалывающие свойства (листы легко скользят друг по другу). Из-за делокализации одного из внешних электронов каждого атома с образованием π-облака графит проводит электричество , но только в плоскости каждого ковалентно связанного листа. Это приводит к более низкой объемной электропроводности углерода, чем для большинства металлов. Делокализация также объясняет энергетическую стабильность графита по отношению к алмазу при комнатной температуре.

При очень высоких давлениях углерод образует более компактный аллотроп — алмаз, плотность которого почти вдвое превышает плотность графита. связан Здесь каждый атом тетраэдрически с четырьмя другими, образуя трехмерную сеть сморщенных шестичленных колец атомов. Алмаз имеет ту же кубическую структуру , что и кремний и германий , и из-за прочности связей углерод-углерод он является самым твердым природным веществом, измеряемым по устойчивости к царапинам . Вопреки распространенному мнению, что «алмазы вечны» , они термодинамически нестабильны ( Δ f G ° (алмаз, 298 К) = 2,9 кДж/моль [46] ) при нормальных условиях (298 К, 10 5 Па) и теоретически должен превратиться в графит. [47] Но из-за высокого энергетического барьера активации переход в графит при нормальной температуре настолько медленный, что незаметен. Однако при очень высоких температурах алмаз превращается в графит, и алмазы могут сгореть при пожаре в доме. Левый нижний угол фазовой диаграммы углерода экспериментально не исследовался. Хотя вычислительное исследование с использованием методов теории функционала плотности привело к выводу, что при T → 0 К и p → 0 Па алмаз становится более стабильным, чем графит, примерно на 1,1 кДж / моль, [48] более поздние и окончательные экспериментальные и вычислительные исследования показывают, что графит более стабилен, чем алмаз при Т <400 К , без приложенного давления, на 2,7 кДж/моль при Т = 0 К и на 3,2 кДж/моль при Т = 298,15 К. [49] При некоторых условиях углерод кристаллизуется в виде лонсдейлита — гексагональной кристаллической решетки со всеми ковалентно связанными атомами и свойствами, подобными свойствам алмаза. [38]
Фуллерены представляют собой синтетические кристаллические образования с графитоподобной структурой, но вместо только плоских шестиугольных ячеек некоторые из ячеек, из которых образуются фуллерены, могут представлять собой пятиугольники, неплоские шестиугольники или даже семиугольники из атомов углерода. Таким образом, листы деформируются в сферы, эллипсы или цилиндры. Свойства фуллеренов (расщепленных на бакиболлы, бакитрубки и нанопочки) еще не полностью проанализированы и представляют собой интенсивную область исследований в области наноматериалов . Названия фуллерен и бакибол даны в честь Ричарда Бакминстера Фуллера , популяризатора геодезических куполов , напоминающих по структуре фуллерены. Баккиболы представляют собой довольно крупные молекулы, полностью состоящие из углеродных связей, связанных тригонально, образуя сфероиды (наиболее известным и простым является C 60 бакминстерфуллерен в форме футбольного мяча ). [32] Углеродные нанотрубки (бакитрубки) структурно похожи на бакиболлы, за исключением того, что каждый атом связан тригонально в изогнутом листе, который образует полый цилиндр . [33] [34] Впервые о нанопочках было сообщено в 2007 году. Они представляют собой гибридные материалы бакитрубки и бакибола (бакиболлы ковалентно связаны с внешней стенкой нанотрубки), которые сочетают в себе свойства обоих в единой структуре. [35]

Из других обнаруженных аллотропов углеродная нанопена представляет собой ферромагнитный аллотроп, открытый в 1997 году. Он состоит из кластерной сборки низкой плотности из атомов углерода, связанных вместе в рыхлую трехмерную паутину, в которой атомы соединены тригонально в шести- и семичленные кольца. Это одно из самых легких известных твердых тел с плотностью около 2 кг/м. 3 . [50] Точно так же стеклоуглерод содержит высокую долю закрытой пористости . [39] но в отличие от обычного графита графитовые слои не уложены друг на друга, как страницы в книге, а имеют более случайное расположение. Линейный ацетиленовый углерод [41] имеет химическую структуру [41] -(C≡C) п - . Углерод в этой модификации является линейным с sp- орбитальной гибридизацией и представляет собой полимер с чередующимися одинарными и тройными связями. Этот карбин представляет значительный интерес для нанотехнологий , поскольку его модуль Юнга в 40 раз превышает модуль Юнга самого твердого из известных материалов – алмаза. [51]
В 2015 году команда из Университета штата Северная Каролина объявила о разработке еще одного аллотропа, который они назвали Q-углеродом , созданного с помощью высокоэнергетического лазерного импульса малой длительности на аморфной углеродной пыли. Сообщается, что Q-углерод обладает ферромагнетизмом, флуоресценцией и твердостью, превосходящей алмазы. [52]
В паровой фазе часть углерода находится в форме высокореактивного двухатомного диуглерода ( С 2 ). В возбужденном состоянии этот газ светится зеленым.
возникновение


Углерод является четвертым по массе химическим элементом в наблюдаемой Вселенной после водорода, гелия и кислорода. Углерод в изобилии содержится на Солнце, звездах, кометах и в атмосферах большинства планет. [53] Некоторые метеориты содержат микроскопические алмазы, которые образовались, когда Солнечная система еще была протопланетным диском . [54] Микроскопические алмазы также могут образовываться под воздействием сильного давления и высокой температуры в местах ударов метеоритов. [55]
В 2014 году НАСА объявило о значительно обновленной базе данных для отслеживания полициклических ароматических углеводородов (ПАУ) во Вселенной. Более 20% углерода во Вселенной может быть связано с ПАУ — комплексными соединениями углерода и водорода без кислорода. [56] Эти соединения фигурируют в мировой гипотезе ПАУ , где предполагается, что они играют роль в абиогенезе и формировании жизни. ПАУ, по-видимому, образовались «через пару миллиардов лет» после Большого взрыва , широко распространены по всей Вселенной и связаны с новыми звездами и экзопланетами . [53]
Было подсчитано, что твердая Земля в целом содержит 730 частей на миллион углерода, из них 2000 частей на миллион в ядре и 120 частей на миллион в совокупности мантии и коры. [57] Поскольку масса Земли равна 5,972 × 10 24 кг , это будет означать 4360 миллионов гигатонн углерода. Это намного больше, чем количество углерода в океанах или атмосфере (ниже).
В сочетании с кислородом в углекислом газе углерод содержится в атмосфере Земли (около 900 гигатонн углерода — каждая ppm соответствует 2,13 Гт) и растворен во всех водоемах (около 36 000 гигатонн углерода). Углерод в биосфере оценивается в 550 гигатонн, но с большой неопределенностью, главным образом из-за огромной неопределенности в количестве наземных глубоко подземных бактерий . [58] Углеводороды (такие как уголь, нефть и природный газ) также содержат углерод. «Запасы» угля (а не «ресурсы») составляют около 900 гигатонн и, возможно, 18 000 Гт ресурсов. [59] Запасы нефти составляют около 150 гигатонн. Доказанные источники природного газа составляют около 175 × 10 12 кубических метров (содержащих около 105 гигатонн углерода), но исследования оценивают еще 900 × 10 12 кубических метров «нетрадиционных» месторождений, таких как сланцевый газ , представляющих около 540 гигатонн углерода. [60]
Углерод также содержится в гидратах метана в полярных регионах и под морями. По разным оценкам, это количество углерода составляет от 500 до 2500, [61] или 3000 Гт. [62]
По данным одного источника, в период с 1751 по 2008 год около 347 гигатонн углерода было выброшено в атмосферу в виде углекислого газа в результате сжигания ископаемого топлива. [63] Другой источник оценивает количество, поступившее в атмосферу за период с 1750 года, в 879 Гт, а общее количество, поступившее в атмосферу, море и на сушу (например, в торфяные болота ), составило почти 2000 Гт. [64]
Углерод входит в состав (около 12% по массе) очень крупных масс карбонатных пород ( известняка , доломита , мрамора и других). Уголь очень богат углеродом ( в антраците содержится 92–98%). [65] и является крупнейшим коммерческим источником минерального углерода, на долю которого приходится 4000 гигатонн или 80% ископаемого топлива . [66]
Что касается отдельных аллотропов углерода, то графит в больших количествах встречается в США (в основном в Нью-Йорке и Техасе ), России, Мексике, Гренландии и Индии. Природные алмазы встречаются в горной породе кимберлита , обнаруженной в древних вулканических «шеях» или «трубках». Большинство месторождений алмазов находится в Африке, особенно в Южной Африке, Намибии, Ботсване, Республике Конго и Сьерра-Леоне. Месторождения алмазов также обнаружены в Арканзасе , Канаде, Российской Арктике, Бразилии, а также в Северной и Западной Австралии. Сейчас алмазы добывают и со дна океана у мыса Доброй Надежды . Алмазы встречаются в природе, но около 30% всех промышленных алмазов, используемых в США, в настоящее время производятся.
Углерод-14 образуется в верхних слоях тропосферы и стратосферы на высотах 9–15 км в результате реакции, вызываемой космическими лучами . [67] тепловые нейтроны Возникают , которые сталкиваются с ядрами азота-14, образуя углерод-14 и протон. Таким образом, 1,5% × 10 −10 атмосферного углекислого газа содержит углерод-14. [68]
Богатые углеродом астероиды относительно преобладают во внешних частях пояса астероидов Солнечной системы. Ученые еще не брали образцы с этих астероидов. Астероиды могут быть использованы для гипотетической добычи углерода в космосе , что возможно в будущем, но в настоящее время технологически невозможно. [69]
изотопы
Изотопы углерода — это атомные ядра , содержащие шесть протонов плюс несколько нейтронов (от 2 до 16). У углерода есть два стабильных природных изотопа. [70] Изотоп углерода-12 ( 12 В) образует 98,93% углерода на Земле, а углерод-13 ( 13 В) образует оставшиеся 1,07%. [70] Концентрация 12 Содержание углерода в биологических материалах еще больше увеличивается, поскольку биохимические реакции дискриминируют 13 С. [71] В 1961 году Международный союз теоретической и прикладной химии (ИЮПАК) принял изотоп углерода-12 в качестве основы для атомного веса . [72] Идентификация углерода в экспериментах по ядерному магнитному резонансу (ЯМР) проводится с помощью изотопа. 13 С.
Углерод-14 ( 14 В) — природный радиоизотоп , созданный в верхних слоях атмосферы (нижней стратосфере и верхней тропосфере ) в результате взаимодействия азота с космическими лучами. [73] Он встречается на Земле в следовых количествах - 1 часть на триллион (0,0000000001%) или более, в основном ограничен атмосферой и поверхностными отложениями, особенно торфом и другими органическими материалами. [74] Этот изотоп распадается на 0,158 МэВ β − выброс . Из-за относительно короткого периода полураспада ( 5700 ± 30 лет) [18] 14 С практически отсутствует в древних породах. Сумма 14 C в атмосфере и в живых организмах почти постоянен, но в их телах после смерти предсказуемо снижается. Этот принцип используется при радиоуглеродном датировании , изобретенном в 1949 году и широко используемом для определения возраста углеродистых материалов возрастом до 40 000 лет. [75] [76]
Известно 15 изотопов углерода, самый короткоживущий из них — 8 C, который распадается за счет испускания протонов и имеет период полураспада 3,5 × 10 −21 с. [18] Экзотика 19 C имеет ядерное гало , что означает, что его радиус значительно больше, чем можно было бы ожидать, если бы ядро было сферой постоянной плотности. [77]
Формирование в звездах
Формирование атомного ядра углерода происходит внутри гигантской или сверхгигантской звезды посредством процесса тройного альфа . Это требует почти одновременного столкновения трех альфа-частиц (ядер гелия), поскольку продукты дальнейших реакций ядерного синтеза гелия с водородом или другим ядром гелия производят соответственно литий-5 и бериллий-8 , оба из которых крайне нестабильны и почти распадаются. мгновенно обратно в более мелкие ядра. [78] Процесс тройного альфа происходит в условиях температур более 100 мегакельвинов и концентрации гелия, которая была запрещена быстрым расширением и охлаждением ранней Вселенной, и поэтому во время Большого взрыва не образовалось значительного количества углерода.
Согласно современной теории физической космологии, углерод образуется в недрах звезд на горизонтальной ветви . [79] Когда массивные звезды умирают как сверхновые, углерод рассеивается в космосе в виде пыли. Эта пыль становится компонентным материалом для формирования звездных систем следующего поколения с аккрецированными планетами. [53] [80] Солнечная система — одна из таких звездных систем с обилием углерода, обеспечивающим существование жизни, какой мы ее знаем. Большинство ученых считают, что весь углерод в Солнечной системе и Млечном Пути происходит от умирающих звезд. [81] [82] [83]
Цикл CNO — это дополнительный механизм синтеза водорода, который питает звезды, в котором углерод действует как катализатор.
Вращательные переходы различных изотопных форм окиси углерода (например, 12 КО, 13 СО и 18 CO) обнаруживаются в субмиллиметровом диапазоне длин волн и используются при изучении вновь образующихся звезд в молекулярных облаках . [84]
Углеродный цикл
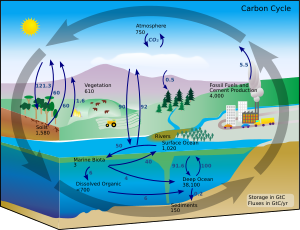
В земных условиях превращение одного элемента в другой происходит очень редко. Следовательно, количество углерода на Земле практически постоянно. Таким образом, процессы, в которых используется углерод, должны откуда-то его получать и где-то утилизировать. Пути прохождения углерода в окружающей среде образуют углеродный цикл . [85] Например, фотосинтезирующие растения извлекают углекислый газ из атмосферы (или морской воды) и превращают его в биомассу, как в цикле Кальвина — процессе фиксации углерода . [86] Часть этой биомассы поедается животными, а часть углерода выдыхается животными в виде углекислого газа. Углеродный цикл значительно сложнее этой короткой петли; например, некоторое количество углекислого газа растворено в океанах; если бактерии не потребляют его, мертвые растения или животные могут превратиться в нефть или уголь, которые при сжигании выделяют углерод. [87] [88]
Соединения
Органические соединения


Углерод может образовывать очень длинные цепочки взаимосвязанных углерод-углеродных связей , это свойство называется катенацией . Углерод-углеродные связи прочны и стабильны. Посредством цепной связи углерод образует бесчисленное количество соединений. Подсчет уникальных соединений показывает, что больше из них содержат углерод, чем нет. [89] Аналогичное утверждение можно сделать и в отношении водорода, поскольку большинство органических соединений содержат водород, химически связанный с углеродом или другим обычным элементом, например кислородом или азотом.
Простейшей формой органической молекулы является углеводород — большое семейство органических молекул, состоящих из атомов водорода, связанных с цепочкой атомов углерода. Углеводородная основная цепь может быть заменена другими атомами, известными как гетероатомы . Общие гетероатомы, которые появляются в органических соединениях, включают кислород, азот, серу, фосфор и нерадиоактивные галогены, а также металлы литий и магний. Органические соединения, содержащие связи с металлом, известны как металлоорганические соединения ( см. ниже ). Определенные группы атомов, часто включающие гетероатомы, встречаются в большом количестве органических соединений. Эти коллекции, известные как функциональные группы , определяют общие закономерности реакционной способности и позволяют систематически изучать и классифицировать органические соединения. Длина цепи, форма и функциональные группы влияют на свойства органических молекул. [90]
В большинстве стабильных соединений углерода (и почти во всех стабильных органических соединениях) углерод подчиняется правилу октетов и является четырехвалентным , что означает, что атом углерода образует в общей сложности четыре ковалентные связи (которые могут включать двойные и тройные связи). Исключения составляют небольшое количество стабилизированных карбокатионов (три связи, положительный заряд), радикалов (три связи, нейтральный), карбанионов (три связи, отрицательный заряд) и карбенов (две связи, нейтральный заряд), хотя эти виды гораздо чаще оказываются встречаются как нестабильные, реактивные промежуточные продукты.
Углерод встречается во всей известной органической жизни и является основой органической химии . В соединении с водородом он образует различные углеводороды, важные для промышленности в качестве хладагентов, смазочных материалов, растворителей, химического сырья для производства пластмасс и нефтехимии, а также в качестве ископаемого топлива.
В сочетании с кислородом и водородом углерод может образовывать множество групп важных биологических соединений, включая сахара, лигнаны , хитины , спирты, жиры, ароматические сложные эфиры , каротиноиды и терпены . С азотом образует алкалоиды , а с добавлением серы также образует антибиотики, аминокислоты и резиновые изделия. При добавлении фосфора к этим другим элементам он образует ДНК и РНК , носители химического кода жизни, и аденозинтрифосфат (АТФ), наиболее важную молекулу-переносчик энергии во всех живых клетках. [91] Норман Горовиц , руководитель миссий «Маринер» и «Викинг» на Марс (1965–1976), считал, что уникальные характеристики углерода делают маловероятным, что какой-либо другой элемент сможет заменить углерод, даже на другой планете, для создания биохимии, необходимой для жизни. [92]
Неорганические соединения
Обычно углеродсодержащие соединения, связанные с минералами или не содержащие связей с другими атомами углерода, галогенами или водородом, рассматривают отдельно от классических органических соединений; определение не является жестким, и классификация некоторых соединений может варьироваться от автора к автору (см. справочные статьи выше). К ним относятся простые оксиды углерода. Наиболее известным оксидом является диоксид углерода (CO 2 ). Когда-то это была основная составляющая палеоатмосферы , но сегодня она является второстепенным компонентом атмосферы Земли . [93] Растворяясь в воде, образует угольную кислоту ( H
22CO
3 ), но, как и большинство соединений с несколькими одинарными атомами кислорода на одном углероде, он нестабилен. [94] Однако через этот промежуточный продукт резонансно-стабилизированные карбонат- ионы образуются . Некоторыми важными минералами являются карбонаты, особенно кальцит . Сероуглерод ( CS
2 ) аналогично. [25] Тем не менее, из-за своих физических свойств и связи с органическим синтезом сероуглерод иногда классифицируют как органический растворитель.
Другой распространенный оксид — окись углерода (CO). Он образуется при неполном сгорании и представляет собой бесцветный газ без запаха. Каждая молекула содержит тройную связь и достаточно полярна , что приводит к тенденции к постоянному связыванию с молекулами гемоглобина, вытесняя кислород, который имеет более низкую аффинность связывания. [95] [96] Цианид (CN − ), имеет аналогичную структуру, но ведет себя во многом как галогенид -ион ( псевдогалоген ). Например, он может образовывать молекулу нитрида циана ((CN) 2 ), подобную двухатомным галогенидам. Аналогично, более тяжелый аналог цианида, циафид (CP − ), также считается неорганическим, хотя большинство простых производных очень нестабильны. Другими необычными оксидами являются субоксид углерода ( C
33О
2 ), [97] нестабильный монооксид диуглерода (C 2 O), [98] [99] триоксид углерода (CO 3 ), [100] [101] циклопентанпентон (C 5 O 5 ), [102] циклогексангексон (C 6 O 6 ), [102] и меллитовый ангидрид (C 12 O 9 ). Однако меллитовый ангидрид представляет собой тройной ациловый ангидрид меллитовой кислоты; более того, он содержит бензольное кольцо. Таким образом, многие химики считают его органическим.
С химически активными металлами, такими как вольфрам , углерод образует либо карбиды (C 4− ) или ацетилиды ( C 2−
2 ) для образования сплавов с высокими температурами плавления. Эти анионы также связаны с метаном и ацетиленом , очень слабыми кислотами. При электроотрицательности 2,5, [103] углерод предпочитает образовывать ковалентные связи . Некоторые карбиды имеют ковалентную решетку, например карборунд (SiC), напоминающий алмаз. Тем не менее, даже самые полярные и солеподобные карбиды не являются полностью ионными соединениями. [104]
Металлоорганические соединения
Металлоорганические соединения по определению содержат по крайней мере одну ковалентную связь углерод-металл. Существует широкий спектр таких соединений; К основным классам относятся простые алкилметаллические соединения (например, тетраэтилсвинец ), η 2 -алкеновые соединения (например, соль Цейзе ) и η 3 -аллильные соединения (например, димер хлорида аллилпалладия ); металлоцены, содержащие циклопентадиенильные лиганды (например, ферроцен ); и карбеновые комплексы переходных металлов . Существует множество карбонилов металлов и цианидов металлов (например, тетракарбонилникель и феррицианид калия ); некоторые исследователи считают карбонильные и цианидные комплексы металлов без других углеродных лигандов чисто неорганическими, а не металлоорганическими. Однако большинство химиков-металлооргаников считают металлокомплексы с любым углеродным лигандом, даже «неорганическим углеродом» (например, карбонилами, цианидами и некоторыми типами карбидов и ацетилидов), металлоорганическими по своей природе. Металлокомплексы, содержащие органические лиганды без ковалентной связи углерод-металл (например, карбоксилаты металлов), называются металлоорганическими соединениями.
Хотя считается, что углерод предпочитает образование четырех ковалентных связей, известны и другие экзотические схемы связывания. Карбораны представляют собой высокостабильные додекаэдрические производные [B 12 H 12 ] 2- блок, одна BH заменена на CH + . Таким образом, углерод связан с пятью атомами бора и одним атомом водорода. Катион [(Ph 3 PAu) 6 C] 2+ содержит октаэдрический углерод, связанный с шестью фосфин-золотыми фрагментами. Это явление связывают с аурофильностью золотых лигандов, которые обеспечивают дополнительную стабилизацию лабильных видов. [105] В природе железомолибденовый кофактор ( FeMoco ), ответственный за микробную фиксацию азота , также имеет октаэдрический углеродный центр (формально карбид C(-IV)) связанный с шестью атомами железа. В 2016 году было подтверждено, что, в соответствии с более ранними теоретическими предсказаниями, дикатион гексаметилбензола содержит атом углерода с шестью связями. Более конкретно, структурно дикатион можно описать формулой [MeC(η 5 -C 5 Me 5 )] 2+ , что делает его «органическим металлоценом », в котором MeC 3+ фрагмент связан с η 5 -С 5 Я 5 − фрагментируется через все пять атомов углерода кольца. [106]
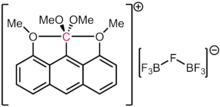
Важно отметить, что в рассмотренных выше случаях каждая из связей с углеродом содержит менее двух формальных электронных пар. Таким образом, формальное количество электронов этих видов не превышает октета. Это делает их гиперкоординированными, но не гипервалентными. Даже в случаях предполагаемых видов 10-C-5 (то есть углерода с пятью лигандами и формальным числом электронов десять), как сообщили Акиба и его коллеги, [107] Расчеты электронной структуры показывают, что количество электронов вокруг углерода все еще меньше восьми, как и в других соединениях с четырехэлектронной трехцентровой связью .
История и этимология

Английское название «углерод» происходит от латинского «carbo», обозначающего уголь и древесный уголь, [108] Отсюда также происходит французское charbon , что означает древесный уголь. На немецком, голландском и датском языках названия углерода — Kohlenstoff , koolstof и kulstof соответственно, что буквально означает «угольное вещество».
Углерод был обнаружен в доисторические времена и был известен в виде сажи и древесного угля самым ранним человеческим цивилизациям. Алмазы были известны, вероятно, еще в 2500 году до нашей эры в Китае, а углерод в форме древесного угля производился примерно во времена Римской империи с помощью той же химии, что и сегодня, путем нагревания древесины в пирамиде, покрытой глиной, чтобы исключить доступ воздуха. [109] [110]

В 1722 году Рене Антуан Фершо де Реомюр продемонстрировал, что железо превращается в сталь в результате поглощения некоторого вещества, теперь известного как углерод. [111] В 1772 году Антуан Лавуазье показал, что алмазы представляют собой разновидность углерода; когда он сжег образцы древесного угля и алмаза и обнаружил, что ни один из них не образует воды и что оба выделяют одинаковое количество углекислого газа на грамм. В 1779 году [112] Карл Вильгельм Шееле показал, что графит, который считался разновидностью свинца, на самом деле идентичен древесному углю, но с небольшой примесью железа, и что при окислении азотной кислотой он дает «воздушную кислоту» (так он называл углекислый газ). кислота. [113] В 1786 году французские ученые Клод Луи Бертолле , Гаспар Монж и К. А. Вандермонд подтвердили, что графит состоит в основном из углерода, окислив его кислородом почти так же, как Лавуазье сделал это с алмазом. [114] Снова осталось немного железа, которое, по мнению французских ученых, было необходимо для структуры графита. В своей публикации они предложили название карбон (лат. Carbonum ) для элемента графита, который выделялся в виде газа при горении графита. Затем Антуан Лавуазье включил углерод в свой учебник 1789 года как элемент. [113]
Новый аллотроп углерода фуллерен , открытый в 1985 году. [115] включает наноструктурированные формы, такие как бакиболы и нанотрубки . [32] Их первооткрыватели — Роберт Керл , Гарольд Крото и Ричард Смолли — получили Нобелевскую премию по химии в 1996 году. [116] Возобновившийся интерес к новым формам привел к открытию новых экзотических аллотропов, включая стеклоуглерод , и к пониманию того, что « аморфный углерод » не является строго аморфным . [39]
Производство
Графит
Коммерчески жизнеспособные природные месторождения графита встречаются во многих частях мира, но наиболее важные с экономической точки зрения источники находятся в Китае, Индии, Бразилии и Северной Корее. [ нужна ссылка ] Месторождения графита имеют метаморфическое происхождение, встречаются в сочетании с кварцем , слюдой и полевым шпатом в сланцах, гнейсах , метаморфизованных песчаниках и известняках в виде линз или жил , иногда толщиной до метра и более. Месторождения графита в Борроудейле , Камберленд , Англия, поначалу были настолько большими и чистыми, что до 19 века карандаши изготавливались путем распиливания блоков природного графита на полосы перед их помещением в древесину. Сегодня более мелкие месторождения графита получают путем дробления материнской породы и выплавления более легкого графита в воду. [117]
Существует три типа природного графита: аморфный, чешуйчатый или кристаллический чешуйчатый, прожилковый или кусковый. Аморфный графит имеет самое низкое качество и наиболее распространен. Вопреки науке, в промышленности термин «аморфный» означает очень маленький размер кристаллов, а не полное отсутствие кристаллической структуры. Аморфный используется для производства графитовых изделий с более низкой стоимостью и является самым дешевым графитом. Крупные месторождения аморфного графита обнаружены в Китае, Европе, Мексике и США. Чешуйчатый графит встречается реже и более высокого качества, чем аморфный; он встречается в виде отдельных пластин, кристаллизовавшихся в метаморфической породе. Чешуйчатый графит может стоить в четыре раза дороже аморфного. Чешуйки хорошего качества можно перерабатывать в расширяемый графит для различных целей, например, в качестве антипиренов . Крупнейшие месторождения находятся в Австрии, Бразилии, Канаде, Китае, Германии и на Мадагаскаре. Жилистый или кусковый графит — самый редкий, ценный и высококачественный вид природного графита. Он встречается в жилах вдоль интрузивных контактов в виде твердых глыб и в промышленных масштабах добывается только в Шри-Ланке. [117]
По данным Геологической службы США , мировое производство природного графита в 2010 году составило 1,1 миллиона тонн, из которых Китай внес 800 000 тонн, Индия 130 000 тонн, Бразилия 76 000 тонн, Северная Корея 30 000 тонн и Канада 25 000 тонн. Сообщалось, что в Соединенных Штатах не было добыто природного графита, но в 2009 году было произведено 118 000 тонн синтетического графита оценочной стоимостью 998 миллионов долларов. [117]
Алмаз

Цепочка поставок алмазов контролируется ограниченным числом влиятельных компаний, а также сильно сконцентрирована в небольшом количестве мест по всему миру (см. рисунок).
Лишь очень небольшая часть алмазной руды состоит из настоящих алмазов. Руда измельчается, при этом необходимо соблюдать осторожность, чтобы предотвратить разрушение более крупных алмазов в этом процессе, а затем частицы сортируются по плотности. Сегодня алмазы располагаются в богатой алмазами фракции плотности с помощью рентгеновской флуоресценции , после чего финальные этапы сортировки выполняются вручную. До того, как использование рентгеновских лучей стало обычным явлением, разделение осуществлялось с помощью смазочных лент; алмазы имеют более сильную тенденцию прилипать к жиру, чем другие минералы в руде. [118]
Исторически известно, что алмазы можно найти только в аллювиальных месторождениях на юге Индии. [119] Индия лидировала в мире по добыче алмазов с момента их открытия примерно в 9 веке до нашей эры. [120] до середины 18 века нашей эры, но коммерческий потенциал этих источников был исчерпан к концу 18 века, и в то время Индию затмила Бразилия, где в 1725 году были найдены первые неиндийские алмазы. [121]
Добыча алмазов коренных месторождений (кимберлитов и лампроитов) началась только в 1870-х годах после открытия месторождений алмазов в Южной Африке. Добыча со временем увеличивалась, и с этой даты в общей сложности было добыто более 4,5 миллиардов каратов. [122] Наиболее коммерчески выгодные месторождения алмазов находились в России, Ботсване, Австралии и Демократической Республике Конго. [123] К 2005 году Россия производила почти одну пятую мировой добычи алмазов (в основном на территории Якутии ; например, трубки «Мир» и «Удачная» ), но рудник Аргайл в Австралии, добывший 14 миллионов каратов в 2018 году. единственным крупнейшим источником стал [124] [125] Ожидается, что новые находки, канадские рудники в Дайавике и Экати , станут еще более ценными благодаря добыче камней ювелирного качества. [126]
В США алмазы были найдены в Арканзасе, Колорадо и Монтане. [127] В 2004 году в США произошло поразительное открытие микроскопического алмаза. [128] привело к массовому отбору проб кимберлитовых трубок в январе 2008 года в отдаленной части Монтаны. [129]
Приложения






Углерод необходим для всех известных живых систем, и без него жизнь в том виде, в котором мы ее знаем, не могла бы существовать (см. альтернативную биохимию ). Основное экономическое использование углерода, помимо продуктов питания и древесины, происходит в форме углеводородов, в первую очередь ископаемого топлива, метана и сырой нефти (нефти). Сырая нефть перегоняется на нефтеперерабатывающих заводах нефтехимической промышленности для производства бензина, керосина и других продуктов. Целлюлоза — это природный углеродсодержащий полимер, вырабатываемый растениями в виде древесины, хлопка, льна и конопли . Целлюлоза используется в первую очередь для поддержания структуры растений. К коммерчески ценным углеродным полимерам животного происхождения относятся шерсть, кашемир и шелк. Пластмассы изготавливаются из синтетических углеродных полимеров, часто с атомами кислорода и азота, включенными через равные промежутки в основную полимерную цепь. Сырьем для многих из этих синтетических веществ является сырая нефть.
Применение углерода и его соединений чрезвычайно разнообразно. Он может образовывать сплавы с железом, из которых наиболее распространена углеродистая сталь . Графит в сочетании с глинами образует «грифель», используемый в карандашах для письма и рисования. Он также используется в качестве смазки и пигмента, как формовочный материал при производстве стекла, в электродах для сухих батарей, при гальванике и гальванопластике , в щётках для электродвигателей и как замедлитель нейтронов в ядерных реакторах .
Древесный уголь используется в качестве материала для рисования в произведениях искусства, при приготовлении барбекю, выплавке железа и во многих других областях. Древесина, уголь и нефть используются в качестве топлива для производства энергии и отопления. Алмаз ювелирного качества используется в ювелирных изделиях, а технические алмазы используются в инструментах для сверления, резки и полировки металлов и камня. Пластмассы производятся из ископаемых углеводородов, а углеродное волокно , полученное пиролизом синтетических полиэфирных волокон, используется для армирования пластмасс с целью формирования современных легких композитных материалов.
Углеродное волокно производится пиролизом экструдированных и растянутых нитей полиакрилонитрила (ПАН) и других органических веществ. Кристаллографическая структура и механические свойства волокна зависят от типа исходного материала и последующей обработки. Углеродные волокна, изготовленные из ПАН, имеют структуру, напоминающую узкие нити графита, но термическая обработка может изменить структуру в непрерывный прокатанный лист. В результате получаются волокна с более высокой удельной прочностью на разрыв, чем у стали. [130]
Углеродная сажа используется в качестве черного пигмента в печатной краске, художественных масляных красках и акварельных красках, копировальной бумаге , автомобильных покрытиях, тушью и тонере для лазерных принтеров . Углеродная сажа также используется в качестве наполнителя в резиновых изделиях, таких как шины, и в пластикатах. Активированный уголь используется в качестве абсорбента и адсорбента в фильтрующем материале в таких разнообразных применениях, как противогазы, очистка воды и кухонные вытяжки , а также в медицине для поглощения токсинов, ядов или газов из пищеварительной системы. Углерод используется при химическом восстановлении при высоких температурах. Кокс используется для восстановления железной руды в железо (плавка). Цементация стали достигается путем нагрева готовых стальных деталей в углеродном порошке. Карбиды кремния бора , вольфрама , титана и . являются одними из самых твердых известных материалов и используются в качестве абразивов в режущих и шлифовальных инструментах Углеродные соединения составляют большую часть материалов, используемых в одежде, таких как натуральный и синтетический текстиль и кожа, а также почти все внутренние поверхности в искусственной среде, за исключением стекла, камня, гипсокартона и металла.
Бриллианты
Алмазная промышленность делится на две категории: одна занимается алмазами ювелирного качества , а другая — алмазами промышленного качества. Несмотря на то, что существует большая торговля обоими типами бриллиантов, эти два рынка функционируют совершенно по-разному.
В отличие от драгоценных металлов, таких как золото или платина, драгоценные алмазы не торгуются как товар. При продаже алмазов существует значительная наценка, а рынок перепродажи бриллиантов не очень активен.
Промышленные алмазы ценятся главным образом за их твердость и теплопроводность, при этом геммологические качества, такие как чистота и цвет, по большей части не имеют значения. Около 80% добытых алмазов (около 100 миллионов каратов или 20 тонн в год) непригодны для использования в качестве драгоценных камней и направляются для промышленного использования (известного как борт ) . [131] Синтетические алмазы , изобретенные в 1950-х годах, почти сразу же нашли промышленное применение; 3 миллиарда каратов (600 тонн ) синтетических алмазов. Ежегодно производится [132]
Преобладающее промышленное использование алмаза — огранка, сверление, шлифовка и полировка. Для большинства этих применений не требуются крупные алмазы; Фактически, большинство алмазов ювелирного качества, за исключением их небольшого размера, можно использовать в промышленных целях. Алмазы встраивают в наконечники сверл или пильные полотна или измельчают в порошок для использования при шлифовке и полировке. [133] Специализированные применения включают использование в лабораториях в качестве защитной оболочки для экспериментов под высоким давлением (см. Ячейку с алмазной наковальней ), высокопроизводительные подшипники и ограниченное использование в специализированных окнах. [134] [135] Благодаря продолжающемуся прогрессу в производстве синтетических алмазов становятся возможными новые применения. Большое волнение вызывает возможность использования алмаза в качестве полупроводника, подходящего для микрочипов , а также, благодаря его исключительной теплопроводности, в качестве радиатора в электронике. [136]
Меры предосторожности


Чистый углерод имеет чрезвычайно низкую токсичность для человека, и с ним можно безопасно обращаться в виде графита или древесного угля. Он устойчив к растворению или химическому воздействию даже в кислом содержимом пищеварительного тракта. Следовательно, попав в ткани организма, он, скорее всего, останется там на неопределенный срок. Углеродная сажа, вероятно, была одним из первых пигментов, которые стали использовать для татуировок, и у Эци Ледяного человека были обнаружены углеродные татуировки, которые сохранились при его жизни и в течение 5200 лет после его смерти. [137] Вдыхание угольной пыли или сажи (технического углерода) в больших количествах может быть опасным, раздражая ткани легких и вызывая застойную болезнь легких — пневмокониоз угольщиков . Алмазная пыль, используемая в качестве абразива, может быть вредной при проглатывании или вдыхании. Микрочастицы углерода образуются в выхлопных газах дизельных двигателей и могут накапливаться в легких. [138] В этих примерах вред может быть вызван загрязнителями (например, органическими химикатами, тяжелыми металлами), а не самим углеродом.
Углерод обычно малотоксичен для жизни на Земле; но углеродные наночастицы смертельны для дрозофилы . [139]
Углерод может гореть энергично и ярко в присутствии воздуха при высоких температурах. Большие скопления угля, которые оставались инертными в течение сотен миллионов лет в отсутствие кислорода, могут самопроизвольно возгораться под воздействием воздуха в отвалах угольных шахт, грузовых трюмах судов и угольных бункерах. [140] [141] и складские отвалы.
В ядерных приложениях, где графит используется в качестве замедлителя нейтронов , может произойти накопление энергии Вигнера с последующим внезапным спонтанным высвобождением. Отжиг до температуры как минимум 250 ° C может безопасно высвободить энергию, хотя при пожаре в Виндскейле процедура пошла не так, что привело к возгоранию других материалов реактора.
К большому разнообразию углеродных соединений относятся такие смертельные яды, как тетродотоксин , лектин рицин из семян клещевины Ricinus communis , цианид (CN − ) и окись углерода; и такие необходимые для жизни вещества, как глюкоза и белок.
См. также
Ссылки
- ^ «Стандартные атомные массы: углерод» . ЦИАВ . 2009.
- ^ Прохаска, Томас; Ирргехер, Йоханна; Бенефилд, Жаклин; Бёлке, Джон К.; Чессон, Лесли А.; Коплен, Тайлер Б.; Дин, Типинг; Данн, Филип Дж. Х.; Грёнинг, Манфред; Холден, Норман Э.; Мейер, Харро Эй Джей (04 мая 2022 г.). «Стандартные атомные веса элементов 2021 (Технический отчет ИЮПАК)» . Чистая и прикладная химия . дои : 10.1515/pac-2019-0603 . ISSN 1365-3075 .
- ^ Jump up to: Перейти обратно: а б с Арбластер, Джон В. (2018). Некоторые значения кристаллографических свойств элементов . Парк материалов, Огайо: ASM International. ISBN 978-1-62708-155-9 .
- ^ Лиде, Д.Р., изд. (2005). Справочник CRC по химии и физике (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 0-8493-0486-5 .
- ^ Jump up to: Перейти обратно: а б Хааланд, Д. (1976). «Тройное давление графит-жидкость-пар и плотность жидкого углерода». Карбон . 14 (6): 357–361. дои : 10.1016/0008-6223(76)90010-5 .
- ^ Jump up to: Перейти обратно: а б Савватимский, А (2005). «Измерения температуры плавления графита и свойств жидкого углерода (обзор за 1963–2003 гг.)». Карбон . 43 (6): 1115–1142. doi : 10.1016/j.carbon.2004.12.027 .
- ^ «Фурье-спектроскопия электронного перехода струйно-охлажденного свободного радикала CCI» (PDF) . Проверено 6 декабря 2007 г.
- ^ «Фурье-спектроскопия системы CP» (PDF) . Проверено 6 декабря 2007 г.
- ^ «Углерод: бинарные соединения» . Проверено 6 декабря 2007 г.
- ^ Jump up to: Перейти обратно: а б с д и Свойства алмаза , База данных Института Иоффе
- ^ «Свойства материала – Разные материалы» . www.nde-ed.org . Проверено 12 ноября 2016 г.
- ^ Магнитная восприимчивость элементов и неорганических соединений , в Справочнике по химии и физике, 81-е издание, CRC press.
- ^ Уэст, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Издательство компании Chemical Rubber Company. стр. E110. ISBN 978-0-8493-0464-4 .
- ^ «История углерода и углеродных материалов - Центр прикладных энергетических исследований - Университет Кентукки» . Caer.uky.edu . Проверено 12 сентября 2008 г.
- ^ Сенезе, Фред (9 сентября 2000 г.). «Кто открыл углерод?» . Фростбургский государственный университет . Проверено 24 ноября 2007 г.
- ^ «Углерод | Факты, использование и свойства» . Британская энциклопедия . Архивировано из оригинала 24 октября 2017 г.
- ^ «углерод» . Британская энциклопедия . 22 февраля 2024 г.
- ^ Jump up to: Перейти обратно: а б с Кондев, ФГ; Ван, М.; Хуанг, WJ; Наими, С.; Ауди, Г. (2021). «Оценка ядерных свойств NUBASE2020» (PDF) . Китайская физика C . 45 (3): 030001. doi : 10.1088/1674-1137/abddae .
- ^ «История углерода» . Архивировано из оригинала 1 ноября 2012 г. Проверено 10 января 2013 г.
- ^ Рис, Джейн Б. (31 октября 2013 г.). Кэмпбелл Биология (10-е изд.). Пирсон . ISBN 978-0-321-77565-8 .
- ^ Jump up to: Перейти обратно: а б Служба химических рефератов (2023 г.). «Реестр КАС» . Проверено 12 февраля 2023 г.
- ^ Дж. Х. Эггерт; и др. (8 ноября 2009 г.). «Температура плавления алмаза при сверхвысоком давлении» . Физика природы . 6 : 40–43. дои : 10.1038/nphys1438 .
- ^ Гринвилл Уиттакер, А. (1978). «Спорная тройная точка углерода твердое тело-жидкость-пар». Природа . 276 (5689): 695–696. Бибкод : 1978Natur.276..695W . дои : 10.1038/276695a0 . S2CID 4362313 .
- ^ Зазула, Дж. М. (1997). «О превращениях графита при высоких температуре и давлении, вызванных поглощением пучка БАК» (PDF) . ЦЕРН. Архивировано (PDF) из оригинала 25 марта 2009 г. Проверено 6 июня 2009 г.
- ^ Jump up to: Перейти обратно: а б Гринвуд и Эрншоу, стр. 289–292.
- ^ Гринвуд и Эрншоу, стр. 276–8.
- ^ Ирифунэ, Тецуо; Курио, Аяко; Сакамото, Шизуэ; Иноуэ, Тору; Сумия, Хитоши (2003). «Материалы: Сверхтвердый поликристаллический алмаз из графита». Природа . 421 (6923): 599–600. Бибкод : 2003Natur.421..599I . дои : 10.1038/421599b . ПМИД 12571587 . S2CID 52856300 .
- ^ Динвибель, Мартин; Верховен, Гертьян; Прадип, Намбудири; Френкен, Йост; Хеймберг, Дженнифер; Зандберген, Хенни (2004). «Сверхсмазывающая способность графита» (PDF) . Письма о физических отзывах . 92 (12): 126101. Бибкод : 2004PhRvL..92l6101D . doi : 10.1103/PhysRevLett.92.126101 . ПМИД 15089689 . S2CID 26811802 . Архивировано (PDF) из оригинала 17 сентября 2011 г.
- ^ Депре, Н.; Маклачан, DS (1988). «Анализ электропроводности графита. Проводимость графитовых порошков при прессовании». Журнал физики D: Прикладная физика . 21 (1): 101–107. Бибкод : 1988JPhD...21..101D . дои : 10.1088/0022-3727/21/1/015 . S2CID 250886376 .
- ^ Коллинз, AT (1993). «Оптические и электронные свойства полупроводникового алмаза». Философские труды Королевского общества А. 342 (1664): 233–244. Бибкод : 1993RSPTA.342..233C . дои : 10.1098/rsta.1993.0017 . S2CID 202574625 .
- ^ Делхес, П. (2001). Графит и прекурсоры . ЦРК Пресс. ISBN 978-90-5699-228-6 .
- ^ Jump up to: Перейти обратно: а б с Анвин, Питер. «Фуллерены (Обзор)» . Архивировано из оригинала 1 декабря 2007 г. Проверено 8 декабря 2007 г.
- ^ Jump up to: Перейти обратно: а б Эббесен, Т.В. , изд. (1997). Углеродные нанотрубки – получение и свойства . Бока-Ратон, Флорида: CRC Press. ISBN 978-0-8493-9602-1 .
- ^ Jump up to: Перейти обратно: а б Дрессельхаус, Массачусетс ; Дрессельхаус, Г.; Авурис, доктор философии , ред. (2001). Углеродные нанотрубки: синтез, структура, свойства и применение . Темы прикладной физики. Том. 80. Берлин: Шпрингер. ISBN 978-3-540-41086-7 .
- ^ Jump up to: Перейти обратно: а б Nasibulin, Albert G. ; Pikhitsa, P. V.; Jiang, H.; Brown, D. P.; Krasheninnikov, A. V.; Anisimov, A. S.; Queipo, P.; Moisala, A.; et al. (2007). "A novel hybrid carbon material" . Nature Nanotechnology . 2 (3): 156–161. Bibcode : 2007NatNa...2..156N . doi : 10.1038/nnano.2007.37 . PMID 18654245 . S2CID 6447122 .
- ^ Насибулин А.; Анисимов Антон С.; Пихица, Петр Васильевич; Цзян, Хуа; Браун, Дэвид П.; Чой, Мансу; Кауппинен, Эско И. (2007). «Исследования формирования НаноБуда». Письма по химической физике . 446 (1): 109–114. Бибкод : 2007CPL...446..109N . дои : 10.1016/j.cplett.2007.08.050 .
- ^ Виейра, Р; Леду, Марк-Жак; Фам-Хуу, Куонг (2004). «Синтез и характеристика углеродных нановолокон макроскопической формы, образованных каталитическим разложением C 2 H 6 /H 2 на никелевом катализаторе». Прикладной катализ А: Общие сведения . 274 (1–2): 1–8. doi : 10.1016/j.apcata.2004.04.008 .
- ^ Jump up to: Перейти обратно: а б Фрондел, Клиффорд; Марвин, Урсула Б. (1967). «Лонсдейлит, новый гексагональный полиморф алмаза». Природа . 214 (5088): 587–589. Бибкод : 1967Natur.214..587F . дои : 10.1038/214587a0 . S2CID 4184812 .
- ^ Jump up to: Перейти обратно: а б с Харрис, PJF (2004). «Фуллереновая структура коммерческого стеклоуглерода» (PDF) . Философский журнал . 84 (29): 3159–3167. Бибкод : 2004PMag...84.3159H . CiteSeerX 10.1.1.359.5715 . дои : 10.1080/14786430410001720363 . S2CID 220342075 . Архивировано из оригинала (PDF) 19 марта 2012 г. Проверено 6 июля 2011 г.
- ^ Роде, А.В.; Хайд, Северная Каролина; Гамалий, Е.Г.; Эллиман, Р.Г.; Маккензи, доктор медицинских наук; Балкок, С. (1999). «Структурный анализ углеродной пены, полученной в результате высокочастотной лазерной абляции». Прикладная физика A: Материаловедение и обработка . 69 (7): С755–С758. Бибкод : 1999ApPhA..69S.755R . дои : 10.1007/s003390051522 . S2CID 96050247 .
- ^ Jump up to: Перейти обратно: а б с Хейманн, Роберт Бертрам; Евсюков Сергей Е. и Каван Ладислав (28 февраля 1999 г.). Карбиновые и карбиноидные структуры . Спрингер. стр. 1–. ISBN 978-0-7923-5323-2 . Архивировано из оригинала 23 ноября 2012 года . Проверено 6 июня 2011 г.
- ^ Ли, К.; Вэй, X.; Кисар, Дж.В.; Хон, Дж. (2008). «Измерение упругих свойств и внутренней прочности монослойного графена». Наука . 321 (5887): 385–8. Бибкод : 2008Sci...321..385L . дои : 10.1126/science.1157996 . ПМИД 18635798 . S2CID 206512830 .
- Фил Шве (28 июля 2008 г.). «Самый прочный материал в мире» . Служба новостей Inside Science (пресс-релиз). Архивировано из оригинала 31 мая 2009 г.
- ^ Сандерсон, Билл (25 августа 2008 г.). «Самые трудные вещи, известные человечеству: «Дискавери» открывает дверь в космический лифт» . nypost.com. Архивировано из оригинала 6 сентября 2008 г. Проверено 9 октября 2008 г.
- ^ Цзинь, Чжун; Лу, Вэй; О'Нил, Кевин Дж.; Парилла, Филип А.; Симпсон, Лин Дж.; Киттрелл, Картер; Тур, Джеймс М. (22 февраля 2011 г.). «Наноинженерное пространство в графеновых листах для хранения водорода». Химия материалов . 23 (4): 923–925. дои : 10.1021/см1025188 . ISSN 0897-4756 .
- ^ Дженкинс, Эдгар (1973). Полиморфизм элементов и соединений . Тейлор и Фрэнсис. п. 30. ISBN 978-0-423-87500-3 . Архивировано из оригинала 23 ноября 2012 г. Проверено 1 мая 2011 г.
- ^ Россини, Флорида; Джессап, Р.С. (1938). «Тепло и свободная энергия образования углекислого газа и перехода между графитом и алмазом» . Журнал исследований Национального бюро стандартов . 21 (4): 491. doi : 10.6028/jres.021.028 .
- ^ «Мир углерода – интерактивная нановизуализация в науке и инженерном образовании (IN-VSEE)» . Архивировано из оригинала 31 мая 2001 г. Проверено 9 октября 2008 г.
- ^ Грочала, Войцех (01 апреля 2014 г.). «Алмаз: основное электронное состояние углерода при температурах, приближающихся к 0 К». Angewandte Chemie, международное издание . 53 (14): 3680–3683. дои : 10.1002/anie.201400131 . ISSN 1521-3773 . ПМИД 24615828 . S2CID 13359849 .
- ^ Уайт, Мэри Энн ; Кахваджи, Самер; Фрейтас, Вера Л.С.; Зиверт, Рико; Уэзерби, Джозеф А.; Рибейру да Силва, Мария DMC; Веревкин Сергей П.; Джонсон, Эрин Р.; Цванцигер, Йозеф В. (2021). «Относительная термическая стабильность алмаза и графита». Международное издание «Прикладная химия» . 60 (3): 1546–1549. дои : 10.1002/anie.202009897 . ISSN 1433-7851 . ПМИД 32970365 . S2CID 221888151 .
- ^ Шеве, Фил и Стейн, Бен (26 марта 2004 г.). «Углеродная нанопена — первый в мире магнит из чистого углерода» . Обновление новостей физики . 678 (1). Архивировано из оригинала 7 марта 2012 года.
- ^ Ицхаки, Лиор; Альтус, Эли; Баш, Гарольд; Хоз, Шмарьягу (2005). «Тверже алмаза: определение площади поперечного сечения и модуля Юнга молекулярных стержней». Энджью. хим. Межд. Эд . 44 (45): 7432–7435. дои : 10.1002/anie.200502448 . ПМИД 16240306 .
- ^ «Исследователи нашли новую фазу углерода, получили алмаз при комнатной температуре» . news.ncsu.edu (пресс-релиз). 2015-11-30. Архивировано из оригинала 6 апреля 2016 г. Проверено 06 апреля 2016 г.
- ^ Jump up to: Перейти обратно: а б с Гувер, Рэйчел (21 февраля 2014 г.). «Нужно отслеживать органические наночастицы по всей Вселенной? У НАСА есть для этого приложение» . НАСА . Архивировано из оригинала 6 сентября 2015 года . Проверено 22 февраля 2014 г.
- ^ Лауретта, Д.С.; Максуин, Хай (2006). Метеориты и ранняя Солнечная система II . Серия космических исследований. Издательство Университета Аризоны. п. 199. ИСБН 978-0-8165-2562-1 . Архивировано из оригинала 22 ноября 2017 г. Проверено 7 мая 2017 г.
- ^ Марк, Кэтлин (1987). Метеоритные кратеры . Издательство Университета Аризоны. ISBN 978-0-8165-0902-7 .
- ^ «Онлайн-база данных отслеживает органические наночастицы по всей Вселенной» . Научно-техническая газета . 24 февраля 2014. Архивировано из оригинала 18 марта 2015 года . Проверено 10 марта 2015 г.
- ^ Уильям Ф. Макдонаф. Состав Земли. Архивировано 28 сентября 2011 г. в Wayback Machine в Маевский, Евгениуш (2000). Термодинамика землетрясений и фазовые превращения в недрах Земли . Эльзевир Наука. ISBN 978-0-12-685185-4 .
- ^ Йинон Бар-Он; и др. (19 июня 2018 г.). «Распределение биомассы на Земле» . ПНАС . 115 (25): 6506–6511. Бибкод : 2018PNAS..115.6506B . дои : 10.1073/pnas.1711842115 . ПМК 6016768 . ПМИД 29784790 .
- ^ Фред Пирс (15 февраля 2014 г.). «Пожар в скважине: после гидроразрыва появляется уголь» . Новый учёный . 221 (2956): 36–41. Бибкод : 2014NewSc.221...36P . дои : 10.1016/S0262-4079(14)60331-6 . Архивировано из оригинала 16 марта 2015 г.
- ^ «Wonderfuel: Добро пожаловать в эпоху нетрадиционного газа». Архивировано 9 декабря 2014 г. в Wayback Machine Хелен Найт, New Scientist , 12 июня 2010 г., стр. 44–7.
- ↑ Запасы метана в океане «завышены». Архивировано 25 апреля 2013 г. в Wayback Machine , BBC, 17 февраля 2004 г.
- ^ «Лед в огне: следующее ископаемое топливо». Архивировано 22 февраля 2015 г. в Wayback Machine Фредом Пирсом , New Scientist , 27 июня 2009 г., стр. 30–33.
- ^ Рассчитано на основе файла global.1751_2008.csv в «Индекс /ftp/ndp030/CSV-FILES» . Архивировано из оригинала 22 октября 2011 г. Проверено 6 ноября 2011 г. из Информационно-аналитического центра углекислого газа .
- ^ Рэйчел Гросс (21 сентября 2013 г.). «Глубокий и промозглый, загадочный» . Новый учёный : 40–43. Архивировано из оригинала 21 сентября 2013 г.
- ^ Стефаненко Р. (1983). Технология добычи угля: теория и практика . Общество горной металлургии. ISBN 978-0-89520-404-2 .
- ^ Кастинг, Джеймс (1998). «Углеродный цикл, климат и долгосрочные последствия сжигания ископаемого топлива» . Последствия: природа и последствия изменения окружающей среды . 4 (1). Архивировано из оригинала 24 октября 2008 г.
- ^ «Образование углерода-14» . Архивировано из оригинала 1 августа 2015 года . Проверено 13 октября 2014 г.
- ^ Эйткен, MJ (1990). Научно-обоснованное датирование в археологии . Лонгман. стр. 56–58. ISBN 978-0-582-49309-4 .
- ^ Николс, Чарльз Р. «Испаряющиеся продукты из углеродистых астероидов» (PDF) . UAPress.Arizona.edu . Архивировано из оригинала (PDF) 2 июля 2016 года . Проверено 12 ноября 2016 г.
- ^ Jump up to: Перейти обратно: а б «Углерод – природные изотопы» . Периодическая таблица WebElements. Архивировано из оригинала 8 сентября 2008 г. Проверено 9 октября 2008 г.
- ^ Ганнес, Леонард З.; Дель Рио, Карлос Мартинес; Кох, Пол (1998). «Естественные вариации содержания стабильных изотопов и их потенциальное использование в физиологической экологии животных». Сравнительная биохимия и физиология – Часть A: Молекулярная и интегративная физиология . 119 (3): 725–737. дои : 10.1016/S1095-6433(98)01016-2 . ПМИД 9683412 .
- ^ «Официальные определения единиц СИ» . Архивировано из оригинала 14 октября 2007 г. Проверено 21 декабря 2007 г.
- ^ Боуман, С. (1990). Интерпретируя прошлое: радиоуглеродное датирование . Издательство Британского музея. ISBN 978-0-7141-2047-8 .
- ^ Браун, Том (1 марта 2006 г.). «Углерод совершает полный круг в Амазонке» . Ливерморская национальная лаборатория Лоуренса. Архивировано из оригинала 22 сентября 2008 года . Проверено 25 ноября 2007 г.
- ^ Либби, ВФ (1952). Радиоуглеродное датирование . Издательство Чикагского университета и ссылки в нем.
- ^ Вестгрен, А. (1960). «Нобелевская премия по химии 1960 года» . Нобелевский фонд. Архивировано из оригинала 25 октября 2007 г. Проверено 25 ноября 2007 г.
- ^ Уотсон, А. (1999). «Сияние в темные уголки ядерной кухни». Наука . 286 (5437): 28–31. дои : 10.1126/science.286.5437.28 . S2CID 117737493 .
- ^ Ауди, Жорж; Берсильон, Оливье; Блашо, Жан; Вапстра, Аалдерт Хендрик (1997). N UBASE « Оценка свойств ядра и распада » (PDF) . Ядерная физика А . 624 (1): 1–124. Бибкод : 1997НуФА.624....1А . дои : 10.1016/S0375-9474(97)00482-X . Архивировано из оригинала (PDF) 23 сентября 2008 г.
- ^ Остли, Дейл А. и Кэрролл, Брэдли В. (2007). Введение в современную звездную астрофизику . Сан-Франциско (Калифорния): Эддисон Уэсли. ISBN 978-0-8053-0348-3 .
- ^ Уиттет, Дуглас CB (2003). Пыль в галактической среде . ЦРК Пресс . стр. 45–46. ISBN 978-0-7503-0624-9 .
- ^ Бохан, Элиза; Динвидди, Роберт; Чаллонер, Джек; Стюарт, Колин; Харви, Дерек; Рэгг-Сайкс, Ребекка ; Крисп, Питер ; Хаббард, Бен; Паркер, Филипп; и др. (Писатели) (февраль 2016 г.). Большая История . Предисловие Дэвида Кристиана (1-е американское изд.). Нью-Йорк : ДК . стр. 10–11, 45, 55, 58–59, 63, 65–71, 75, 78–81, 98, 100, 102. ISBN. 978-1-4654-5443-0 . OCLC 940282526 .
- ^ «Мое тело действительно состоит из звездных материалов?» . НАСА . Май 2003 года . Проверено 17 марта 2023 г.
- ^ Фираке, Кабир (10 июля 2020 г.). «Объяснение: как звезды предоставили углерод, который делает жизнь возможной» . Индийский экспресс . Проверено 17 марта 2023 г.
- ^ Pikelʹner, Solomon Borisovich (1977). Star Formation . Springer. p. 38. ISBN 978-90-277-0796-3 . Архивировано из оригинала 23 ноября 2012 г. Проверено 6 июня 2011 г.
- ^ Маннион, стр. 51–54.
- ^ Маннион, стр. 84–88.
- ^ Фальковский, П.; Скоулз, Р.Дж.; Бойл, Э.; Канаделл, Дж.; Кэнфилд, Д.; Эльзер, Дж.; Грубер, Н.; Хиббард, К.; и др. (2000). «Глобальный углеродный цикл: проверка наших знаний о Земле как системе». Наука . 290 (5490): 291–296. Бибкод : 2000Sci...290..291F . дои : 10.1126/science.290.5490.291 . ПМИД 11030643 . S2CID 1779934 .
- ^ Смит, ТМ; Крамер, В.П.; Диксон, РК; Лиманс, Р.; Нилсон, Р.П.; Соломон, AM (1993). «Глобальный земной углеродный цикл» (PDF) . Загрязнение воды, воздуха и почвы . 70 (1–4): 19–37. Бибкод : 1993WASP...70...19S . дои : 10.1007/BF01104986 . S2CID 97265068 . Архивировано (PDF) из оригинала 11 октября 2022 г.
- ^ Берроуз, А.; Холман, Дж.; Парсонс, А.; Пиллинг, Г.; Прайс, Г. (2017). Химия3: Знакомство с неорганической, органической и физической химией . Издательство Оксфордского университета. п. 70. ИСБН 978-0-19-873380-5 . Архивировано из оригинала 22 ноября 2017 г. Проверено 7 мая 2017 г.
- ^ Маннион, стр. 27–51.
- ^ Маннион, стр. 84–91.
- ^ Норман Х. Горовиц (1986) В Утопию и обратно; поиск жизни в солнечной системе (серия «Астрономия») WH Freeman & Co (Sd), Нью-Йорк, ISBN 978-0-7167-1766-9
- ^ Левин, Джоэл С.; Аугустссон, Томми Р.; Натараджан, Мурали (1982). «Предбиологическая палеоатмосфера: стабильность и состав». Происхождение жизни и эволюция биосфер . 12 (3): 245–259. Бибкод : 1982OrLi...12..245L . дои : 10.1007/BF00926894 . ПМИД 7162799 . S2CID 20097153 .
- ^ Лортинг, Т .; и др. (2001). «Об удивительной кинетической стабильности угольной кислоты». Энджью. хим. Межд. Эд . 39 (5): 891–895. doi : 10.1002/(SICI)1521-3773(20000303)39:5<891::AID-ANIE891>3.0.CO;2-E . ПМИД 10760883 .
- ^ Холдейн Дж. (1895). «Действие углекислого газа на человека» . Журнал физиологии . 18 (5–6): 430–462. doi : 10.1113/jphysicalol.1895.sp000578 . ПМЦ 1514663 . ПМИД 16992272 .
- ^ Горман, Д.; Дрюри, А.; Хуанг, ЮЛ; Самес, К. (2003). «Клиническая токсикология окиси углерода». Токсикология . 187 (1): 25–38. дои : 10.1016/S0300-483X(03)00005-2 . ПМИД 12679050 .
- ^ «Соединения углерода: перекись углерода» . Архивировано из оригинала 7 декабря 2007 г. Проверено 3 декабря 2007 г.
- ^ Байес, К. (1961). «Фотолиз углекислого газа». Журнал Американского химического общества . 83 (17): 3712–3713. дои : 10.1021/ja01478a033 .
- ^ Андерсон диджей; Розенфельд, Р.Н. (1991). «Фотодиссоциация углекислого газа». Журнал химической физики . 94 (12): 7852–7867. Бибкод : 1991JChPh..94.7857A . дои : 10.1063/1.460121 .
- ^ Сабин, младший; Ким, Х. (1971). «Теоретическое исследование структуры и свойств углекислого газа». Письма по химической физике . 11 (5): 593–597. Бибкод : 1971CPL....11..593S . дои : 10.1016/0009-2614(71)87010-0 .
- ^ Молль Н.Г.; Беспорядок ДР; Томпсон В.Е. (1966). «Триоксид углерода: его производство, инфракрасный спектр и структура, изученные в матрице твердого CO 2 ». Журнал химической физики . 45 (12): 4469–4481. Бибкод : 1966ЖЧФ..45.4469М . дои : 10.1063/1.1727526 .
- ^ Jump up to: Перейти обратно: а б Фатиади, Александр Дж.; Исбелл, Гораций С.; Сагер, Уильям Ф. (1963). «Циклические полигидроксикетоны. I. Продукты окисления гексагидроксибензола (бензолгексола)» (PDF) . Журнал исследований Национального бюро стандартов . Раздел A. 67А (2): 153–162. дои : 10.6028/jres.067A.015 . ПМК 6640573 . ПМИД 31580622 . Архивировано из оригинала (PDF) 25 марта 2009 г. Проверено 21 марта 2009 г.
- ^ Полинг, Л. (1960). Природа химической связи (3-е изд.). Итака, Нью-Йорк: Издательство Корнельского университета. п. 93 . ISBN 978-0-8014-0333-0 .
- ^ Гринвуд и Эрншоу, стр. 297–301.
- ^ Шербаум, Франц; и др. (1988). « Аурофильность» как следствие релятивистских эффектов: дикатион гексакис(трифенилфосфанаурио)метана [(Ph 3 PAu) 6 C] 2+ ". Angew. Chem. Int. Ed. Engl. 27 (11): 1544–1546. doi : 10.1002/anie.198815441 .
- ^ Риттер, Стивен К. «Шесть связей с углеродом: подтверждено» . Новости химии и техники . Архивировано из оригинала 9 января 2017 г.
- ^ Ямасита, Макото; Ямамото, Йосуке; Акиба, Кин-я; Хашизуме, Дайсуке; Ивасаки, Фудзико; Такаги, Нозоми; Нагасе, Сигэру (1 марта 2005 г.). «Синтез и структура соединений гипервалентного пятикоординированного углерода и бора, несущих антраценовый скелет - выяснение гипервалентного взаимодействия на основе рентгеновского анализа и расчета DFT». Журнал Американского химического общества . 127 (12): 4354–4371. дои : 10.1021/ja0438011 . ISSN 0002-7863 . ПМИД 15783218 .
- ^ Краткий Оксфордский словарь английского языка, Oxford University Press
- ^ «Китайцы первыми применили алмаз» . Новости Би-би-си . 17 мая 2005 г. Архивировано из оригинала 20 марта 2007 г. Проверено 21 марта 2007 г.
- ^ Ван дер Крогт, Питер. «Карбоний / Углерод в элементимологии и элементах Multidict» . Архивировано из оригинала 23 января 2010 г. Проверено 6 января 2010 г.
- ^ Фершо де Реомюр, Р.-А. (1722). Искусство превращения кованого железа в сталь, а также искусство размягчения расплавленного железа или изготовления изделий из расплавленного железа, таких же законченных, как кованое железо (английский перевод 1956 года) . Париж, Чикаго.
- ^ «Карбон» . Канада соединяется. Архивировано из оригинала 27 октября 2010 г. Проверено 7 декабря 2010 г.
- ^ Jump up to: Перейти обратно: а б Сенезе, Фред (9 сентября 2000 г.). «Кто открыл углерод?» . Фростбургский государственный университет. Архивировано из оригинала 7 декабря 2007 г. Проверено 24 ноября 2007 г.
- ^ Джолитти, Федерико (1914). Цементация железа и стали . Книжная компания McGraw-Hill, Inc.
- ^ Крото, HW; Хит, младший; О'Брайен, Южная Каролина; Керл, РФ; Смолли, Р.Э. (1985). «C 60 : Бакминстерфуллерен». Природа . 318 (6042): 162–163. Бибкод : 1985Natur.318..162K . дои : 10.1038/318162a0 . S2CID 4314237 .
- ^ «Нобелевская премия по химии 1996 года «за открытие фуллеренов» » . Архивировано из оригинала 11 октября 2007 г. Проверено 21 декабря 2007 г.
- ^ Jump up to: Перейти обратно: а б с Ежегодник USGS Minerals: Графит, 2009 г. Архивировано 16 сентября 2008 г. в Wayback Machine и Графит: сводки минеральных товаров, 2011 г.
- ^ Харлоу, GE (1998). Природа алмазов . Издательство Кембриджского университета. п. 223. ИСБН 978-0-521-62935-5 .
- ^ Кателле, WR (1911). Алмаз . Компания Джона Лейна. п. 159. Обсуждение аллювиальных алмазов в Индии и других странах, а также самых ранних находок.
- ^ Болл, В. (1881). Алмазы, золото и уголь Индии . Лондон, Трубнер и Ко. Болл был геологом на британской службе. Глава I, стр. 1
- ^ Херши, JW (1940). Книга бриллиантов: их любопытные сведения, свойства, испытания и синтетическое производство . Кессинджер Паб Ко. с. 28. ISBN 978-1-4179-7715-4 .
- ^ Янсе, AJA (2007). «Мировое производство необработанных алмазов с 1870 года». Драгоценные камни и геммология . XLIII (лето 2007 г.): 98–119. дои : 10.5741/GEMS.43.2.98 .
- ^ Маршалл, Стивен; Шор, Джош (22 октября 2004 г.). «Бриллиантовая жизнь» . Партизанская новостная сеть. Архивировано из оригинала 9 июня 2008 г. Проверено 10 октября 2008 г.
- ^ Зимнисский, Павел (21 мая 2018 г.). «Ожидается, что в 2018 году мировые поставки алмазов снизятся на 3,4% до 147 млн каратов» . Kitco.com . Архивировано из оригинала 11 августа 2023 года . Проверено 9 ноября 2020 г.
- ^ Лоренц, В. (2007). «Аргайл в Западной Австралии: самая богатая алмазоносная трубка в мире; ее прошлое и будущее». Геммология, журнал Немецкого геммологического общества . 56 (1/2): 35-40.
- ^ Маннион, стр. 25–26.
- ^ «Микроскопический алмаз найден в Монтане» . Стандарт Монтаны . 17 октября 2004 г. Архивировано из оригинала 21 января 2005 г. Проверено 10 октября 2008 г.
- ^ Кук, Сара (19 октября 2004 г.). «Микроскопический алмаз, найденный в Монтане» . Livescience.com. Архивировано из оригинала 5 июля 2008 г. Проверено 12 сентября 2008 г.
- ^ «Дельта-Новости/Пресс-релизы/Публикации» . Дельтамин.com. Архивировано из оригинала 26 мая 2008 г. Проверено 12 сентября 2008 г.
- ^ Кантвелл, У.Дж.; Мортон, Дж. (1991). «Ударопрочность композиционных материалов – обзор». Композиты . 22 (5): 347–62. дои : 10.1016/0010-4361(91)90549-В .
- ^ Хольцапфель, Ч. (1856). Токарная обработка и механическая обработка . Чарльз Хольцапфель. Интернет-архив , заархивированный 26 марта 2016 г. в Wayback Machine.
- ^ «Статистика и информация о промышленных алмазах» . Геологическая служба США. Архивировано из оригинала 6 мая 2009 г. Проверено 5 мая 2009 г.
- ^ Коэльо, RT; Ямада, С.; Аспинуолл, Дания; Мудрый, MLH (1995). «Применение инструментальных материалов из поликристаллического алмаза (ПКА) при сверлении и рассверливании сплавов на основе алюминия, в том числе ММК». Международный журнал станков и производства . 35 (5): 761–774. дои : 10.1016/0890-6955(95)93044-7 .
- ^ Харрис, округ Колумбия (1999). Материалы для инфракрасных окон и куполов: свойства и характеристики . СПАЙ Пресс. стр. 303–334. ISBN 978-0-8194-3482-1 .
- ^ Нусинович, Г.С. (2004). Введение в физику гиротронов . Джу Пресс. п. 229. ИСБН 978-0-8018-7921-0 .
- ^ Сакамото, М.; Эндрис, Дж.Г.; Скифрес, ДР (1992). «Выходная мощность непрерывного излучения 120 Вт от монолитной матрицы лазерных диодов AlGaAs (800 нм), установленной на алмазном радиаторе». Электронные письма . 28 (2): 197–199. Бибкод : 1992ElL....28..197S . дои : 10.1049/эл:19920123 .
- ^ Дорфер, Леопольд; Мозер, М.; Шпиндлер, К.; Бахр, Ф.; Эгартер-Вигл, Э.; Дор, Г. (1998). «5200-летняя акупунктура в Центральной Европе?». Наука . 282 (5387): 242–243. Бибкод : 1998Sci...282..239D . дои : 10.1126/science.282.5387.239f . ПМИД 9841386 . S2CID 42284618 .
- ^ Дональдсон, К.; Стоун, В.; Клотер, А.; Ренвик, Л.; Макни, В. (2001). «Сверхмелкие частицы» . Профессиональная и экологическая медицина . 58 (3): 211–216. дои : 10.1136/oem.58.3.211 . ПМК 1740105 . ПМИД 11171936 .
- ↑ Углеродные наночастицы токсичны для взрослых плодовых мух, но безвредны для молодых. Архивировано 2 ноября 2011 г. в Wayback Machine ScienceDaily (17 августа 2009 г.).
- ^ «Пресс-релиз - Катастрофа Титаника: новая теория пальцами угольный пожар» . www.geosociety.org . Архивировано из оригинала 14 апреля 2016 г. Проверено 06 апреля 2016 г.
- ^ МакШерри, Патрик. «Пожар угольного бункера» . www.spanamwar.com . Архивировано из оригинала 23 марта 2016 г. Проверено 06 апреля 2016 г.
Библиография
- Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- Маннион, AM (12 января 2006 г.). Углерод и его приручение . Спрингер . стр. 1–319. ISBN 978-1-4020-3956-0 .
Внешние ссылки
- Углерод в наше время на BBC
- Углерод в Периодической таблице видео (Ноттингемский университет)
- Углерод на Британнике
- Обширная страница Carbon на asu.edu (архивировано 18 июня 2010 г.)
- Электрохимическое использование углерода (архивировано 9 ноября 2001 г.)
- Углерод — супервещь. Анимация со звуком и интерактивными 3D-моделями. (архивировано 9 ноября 2012 г.)


