Никель тетракарбонил
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Тетракарбонилникель | |||
| Другие имена Никель тетракарбонил Карбонил никеля (1:4) | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| 6122797 | |||
| ЧЭБИ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.033.322 | ||
| Номер ЕС |
| ||
| 3135 | |||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
| Число | 1259 | ||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
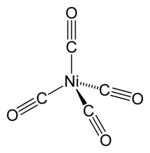
| Ni(CO) 4 | |||
| Молярная масса | 170.73 g/mol | ||
| Появление | бесцветная жидкость [1] | ||
| Запах | затхлый, [1] как кирпичная пыль | ||
| Плотность | 1,319 г/см 3 | ||
| Температура плавления | -17,2 ° C (1,0 ° F; 256,0 К) | ||
| Точка кипения | 43 ° С (109 ° F; 316 К) | ||
| 0,018 г/100 мл (10 °С) | |||
| Растворимость | смешивается с большинством органических растворителей растворим в азотной кислоте , царской водке | ||
| Давление пара | 315 мм рт.ст. (20 °С) [1] | ||
| Вязкость | 3,05 х 10 −4 Па с | ||
| Структура | |||
| Тетраэдрический | |||
| Тетраэдрический | |||
| ноль | |||
| Термохимия | |||
Стандартный моляр энтропия ( S ⦵ 298 ) | 320 Дж К −1 моль −1 | ||
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −632 кДж/моль | ||
Стандартная энтальпия горение (Δ c H ⦵ 298 ) | −1180 кДж/моль | ||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | Потенциальный профессиональный канцероген [2] | ||
| СГС Маркировка : | |||
    | |||
| Х225 , Х300 , Х301 , Х304 , Х310 , Х330 , Х351 , Х360Д , Х410 | |||
| P201 , P202 , P210 , P233 , P240 , P241 , P242 , P243 , P260 , P271 , P273 , P280 , P281 , P284 , P303+P361+P353 , P304+P340 , P308+P313 , P 310 , П320 , П370+П378 , П391 , П403+П233 , П403+П235 , П405 , П501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 4 ° С (39 ° F; 277 К) | ||
| 60 ° С (140 ° F; 333 К) | |||
| Взрывоопасные пределы | 2–34% | ||
| Летальная доза или концентрация (LD, LC): | |||
ЛК 50 ( средняя концентрация ) | 266 частей на миллион (кошка, 30 мин) 35 ppm (кролик, 30 мин) 94 ppm (мышь, 30 мин) 10 ppm (мышь, 10 мин) [3] | ||
LC Lo ( самый низкий из опубликованных ) | 360 частей на миллион (собака, 90 мин) 30 ppm (человек, 30 мин) 42 ppm (кролик, 30 мин) 7 частей на миллион (мышь, 30 мин) [3] | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
МЕХ (Допускается) | TWA 0,001 частей на миллион (0,007 мг/м 3 ) [1] | ||
РЕЛ (рекомендуется) | TWA 0,001 частей на миллион (0,007 мг/м 3 ) [1] | ||
IDLH (Непосредственная опасность) | Са [2 ppm] [1] | ||
| Паспорт безопасности (SDS) | КМГС 0064 | ||
| Родственные соединения | |||
Родственные карбонилы металлов |
| ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Карбонил никеля ( IUPAC название : тетракарбонилникель ) представляет собой металлоорганическое соединение никеля (0) с формулой Ni(CO) 4 . жидкость является основным карбонилом никеля . Эта бесцветная Это промежуточное соединение в процессе Монда очень высокой чистоты для производства никеля и реагент в металлоорганической химии , хотя процесс Монда вышел из общего использования из-за опасности для здоровья при работе с этим соединением. Карбонил никеля является одним из наиболее опасных веществ, когда-либо встречавшихся в химии никеля, из-за его очень высокой токсичности , сочетающейся с высокой летучестью и быстрой абсорбцией через кожу. [4]
Структура и связь
[ редактировать ]В тетракарбониле никеля степень окисления никеля равна нулю, поскольку связывающие электроны Ni-C исходят от атома C и по-прежнему принадлежат C в гипотетической ионной связи, которая определяет степени окисления. Формула соответствует правилу 18 электронов . Молекула тетраэдрическая , с четырьмя карбонильными ( монооксидами углерода ) лигандами . электронографические исследования, и было рассчитано, что расстояния Ni-C и C-O составляют 1,838 (2) и 1,141 (2) ангстрем соответственно. На этой молекуле были проведены [5]
Подготовка
[ редактировать ]Ni(CO) 4 был впервые синтезирован в 1890 году Людвигом Мондом путем прямой реакции металлического никеля с окисью углерода. [6] Эта новаторская работа предвосхитила существование многих других карбонильных соединений металлов, в том числе соединений ванадия , хрома , марганца , железа и кобальта . К концу XIX века его также стали применять в промышленности для очистки никеля. [7]
При 323 К (50 ° C; 122 ° F) окись углерода пропускают через примесный никель. Оптимальная скорость наблюдается при 130°С. [8]
Лабораторные маршруты
[ редактировать ]Ni(CO) 4 коммерчески недоступен. Его удобно получать в лаборатории путем карбонилирования коммерчески доступного бис(циклооктадиен)никеля(0) . [9] Его также можно получить восстановлением аммиачных растворов сульфата никеля дитионитом натрия в атмосфере CO. [10]
Реакции
[ редактировать ]
Термическое декарбонилирование
[ редактировать ]При умеренном нагревании Ni(CO) 4 разлагается на окись углерода и металлический никель. В сочетании с легким образованием CO и даже очень загрязненного никеля это разложение является основой процесса Монда для очистки никеля или нанесения покрытия на поверхности. Термическое разложение начинается при температуре около 180 °C (356 °F) и усиливается при более высокой температуре. [8]
Реакции с нуклеофилами и восстановителями
[ редактировать ]Как и другие карбонилы низковалентных металлов, Ni(CO) 4 подвержен атаке нуклеофилов. Атака может произойти в центре никеля, что приводит к смещению лигандов CO, или в CO. Таким образом, донорные лиганды, такие как трифенилфосфин, реагируют с образованием Ni(CO) 3 (PPh 3 ) и Ni(CO) 2 (PPh 3 ) 2 . бипиридин и родственные лиганды. Аналогично ведут себя [11] Монозамещение тетракарбонила никеля другими лигандами можно использовать для определения электронного параметра Толмана , меры способности отдавать или отбирать электроны данного лиганда.
Обработка гидроксидами дает такие кластеры, как [Ни5 ( СО) 12 ] 2− и [Ни6 ( СО) 12 ] 2− . Эти соединения также можно получить восстановлением карбонила никеля.
Таким образом, обработка Ni(CO) 4 углеродными нуклеофилами (Nu − ) приводит к образованию ацильных производных, таких как [Ni(CO) 3 C(O)Nu]] − . [12]
Реакции с электрофилами и окислителями
[ редактировать ]Карбонил никеля может окисляться . Хлор окисляет карбонил никеля до NiCl 2 , выделяя газ CO. Аналогично ведут себя и другие галогены. Эта реакция представляет собой удобный метод осаждения никелевой части токсичного соединения.
Реакции Ni(CO) 4 с алкил- и арилгалогенидами часто приводят к карбонилированным органическим продуктам. Винилгалогениды , такие как PhCH=CHBr, превращаются в ненасыщенные эфиры при обработке Ni(CO) 4 с последующей обработкой метоксидом натрия. Вероятно, такие реакции протекают и путем окислительного присоединения . Аллилгалогениды образуют соединения π-аллилникеля, такие как (аллил) 2 Ni 2 Cl 2 : [13] 2 Ni(CO) 4 + 2 ClCH 2 CH=CH 2 → Ni 2 ( μ -Cl) 2 ( η 3 - С 3 Н 5 ) 2 + 8 СО
Токсикология и соображения безопасности
[ редактировать ]Опасность Ni(CO) 4 гораздо выше, чем та, которую предполагает содержание в нем CO, что отражает воздействие никеля при его попадании в организм. Карбонил никеля может быть смертельным при попадании через кожу или, что более вероятно, при вдыхании из-за его высокой летучести. Его LC 50 при 30-минутном воздействии оценивается в 3 ppm , а концентрация, которая сразу же смертельна для человека, составит 30 ppm. Некоторые субъекты, подвергшиеся воздействию затяжек с концентрацией до 5 частей на миллион, описывали запах как затхлый или сажный, но поскольку соединение чрезвычайно токсично, его запах не является надежным предупреждением о потенциально смертельном воздействии. [14]
Пары Ni(CO) 4 могут самовоспламеняться . Пар быстро разлагается на воздухе, период полураспада около 40 секунд. [15]
Отравление карбонилом никеля характеризуется двухстадийным течением заболевания. Первый состоит из головных болей и болей в груди , продолжающихся несколько часов, за которыми обычно следует короткая ремиссия. Вторая фаза представляет собой химический пневмонит , который начинается обычно через 16 часов с симптомов кашля, одышки и сильной усталости. Они достигают наибольшей тяжести через четыре дня и могут привести к смерти от кардиореспираторного или острого повреждения почек . Выздоровление часто бывает чрезвычайно длительным, часто осложняется истощением, депрессией и одышкой при физической нагрузке. Постоянное повреждение дыхательных путей встречается редко. Канцерогенность . Ni(CO) 4 является предметом дискуссий, но предполагается, что она значительна
Он классифицируется как чрезвычайно опасное вещество в Соединенных Штатах, как это определено в разделе 302 Закона США о чрезвычайном планировании и праве общества на информацию (42 USC 11002), и на него распространяются строгие требования отчетности со стороны предприятий, которые производят, хранят, или использовать его в значительных количествах. [16]
В популярной культуре
[ редактировать ]«Реквием по живым» (1978), эпизод сериала « Куинси, штат Мэн» , показывает отравленного, умирающего криминального авторитета, который просит доктора Куинси провести вскрытие его еще живого тела. Куинси идентифицирует яд — карбонил никеля.
В новелле Морган» Аманда Гордона Р. Диксона « 1979 года оставшиеся жители преимущественно эвакуированной деревни сопротивляются оккупационным военным силам, направляя выхлопы плохо настроенного двигателя внутреннего сгорания на постоянно возобновляемую «кучу отходов» порошкообразного никеля за пределами дома. механический цех (под видом гражданского бизнеса) с целью ликвидации оккупантов ценой собственной жизни.
В главе 199 манги «Доктор Стоун» создается машина, которая очищает никель с помощью процесса Монда . Упоминается, что в результате этого процесса образуется «смертельный токсин» (карбонил никеля).
В романе «Дельта-v» вышедшего New York Times автора бестселлеров Дэниела Суареса, в 2019 году , команда из восьми частных горняков достигает околоземного астероида для извлечения летучих веществ (воды, CO 2 и т. д.) и металлов (железо, никель и кобальт); они хранятся в виде твердого карбонила для транспортировки обратно на околоземную орбиту и используются для изготовления космических кораблей на месте путем разложения в вакууме.
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж Карманный справочник NIOSH по химическим опасностям. «#0444» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Тетракарбонил никеля, канцерогенность
- ^ Jump up to: а б «Карбонил никеля» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Индекс Merck (7-е изд.). Мерк .
- ^ Хедберг, Л.; Иидзима, Т.; Хедберг, К. (1979). «Тетракарбонил никеля, Ni (CO) 4 . I. Молекулярная структура методом газовой электронной дифракции. II. Уточнение квадратичного силового поля». Журнал химической физики . 70 (7): 3224–3229. Бибкод : 1979JChPh..70.3224H . дои : 10.1063/1.437911 .
- ^ Монд, Л .; Лангер, К.; Квинке, Ф. (1890). «Действие угарного газа на никель» . Дж. Хим. Соц. Пер. 57 : 749–753. дои : 10.1039/CT8905700749 .
- ^ «Извлечение никеля из руд методом Монда» . Природа . 59 (1516): 63–64. 1898. Бибкод : 1898Natur..59...63. . дои : 10.1038/059063a0 .
- ^ Jump up to: а б Ласселлес, К.; Морган, LG; Николлс, Д.; Бейерсманн, Д. «Соединения никеля». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a17_235.pub2 . ISBN 978-3527306732 .
- ^ Джолли, PW (1982). «Тетракарбонил никеля». В Авеле, Эдвард В.; Стоун, Ф. Гордон А .; Уилкинсон, Джеффри (ред.). Комплексная металлоорганическая химия . Том. Я. Оксфорд: Пергамон Пресс. ISBN 0-08-025269-9 .
- ^ Ф. Зил (1963). «Карбонил никеля». В Г. Брауэре (ред.). Справочник по препаративной неорганической химии . Том. 2 (2-е изд.). Нью-Йорк: Академическая пресса. стр. 1747–1748.
- ^ Эльшенбройх, К.; Зальцер, А. (1992). Металлоорганические соединения: краткое введение (2-е изд.). Вайнхайм: Wiley-VCH . ISBN 3-527-28165-7 .
- ^ Пинхас, Арканзас (2003). «Тетракарбонилникель». Энциклопедия реагентов для органического синтеза . Джон Уайли и сыновья. дои : 10.1002/047084289X.rt025m . ISBN 0471936235 .
- ^ Земмельхак, МФ; Хелквист, премьер-министр (1972). «Реакция арилгалогенидов с галогенидами π-аллилникеля: металлилбензол» . Органические синтезы . 52 :115 ; Сборник томов , т. 6, с. 722 .
- ^ Совет по экологическим исследованиям и токсикологии (2008 г.). «Карбонил никеля: рекомендуемые уровни острого воздействия» . Рекомендуемые уровни острого воздействия для некоторых переносимых по воздуху химикатов . Том. 6. Издательство национальных академий . стр. 213–259. дои : 10.17226/12018 . ISBN 978-0-309-11213-0 . ПМИД 25032325 .
- ^ Стедман, Д.Х.; Хикаде, DA; Пирсон, Р. младший; Ялвак, ЭД (1980). «Карбонил никеля: разложение на воздухе и связанные с ним кинетические исследования». Наука . 208 (4447): 1029–1031. Бибкод : 1980Sci...208.1029S . дои : 10.1126/science.208.4447.1029 . ПМИД 17779026 . S2CID 31344783 .
- ^ «40 CFR: Приложение A к Части 355 — Список чрезвычайно опасных веществ и их пороговых плановых количеств» (PDF) (изд. от 1 июля 2008 г.). Государственная типография . Архивировано из оригинала (PDF) 25 февраля 2012 года . Проверено 29 октября 2011 г.
{{cite journal}}: Для цитирования журнала требуется|journal=( помощь )
Дальнейшее чтение
[ редактировать ]- Ши, З. (1991). «Карбонил никеля: токсичность и здоровье человека». Наука об общей окружающей среде . 148 (2–3): 293–298. дои : 10.1016/0048-9697(94)90406-5 . ПМИД 8029705 .
- Сандерман, ФРВ (1989). «Паломничество в архивы токсикологии никеля». Анналы клинической и лабораторной науки . 19 (1): 1–16. ПМИД 2644888 .
- Армит, HW (1907). «Токсикология карбонила никеля. Часть I» . Журнал гигиены . 7 (4): 525–551. дои : 10.1017/S0022172400033507 . ПМК 2236193 . ПМИД 20474327 .
- Армит, HW (1908). «Токсикология карбонила никеля. Часть II» . Журнал гигиены . 8 (5): 565–610. дои : 10.1017/S0022172400015989 . ПМК 2167169 . ПМИД 20474374 .
- Барселу, генеральный директор; Барселу, Дональд (1999). «Никель». Клиническая токсикология . 37 (2): 239–258. дои : 10.1081/CLT-100102423 . ПМИД 10382559 .