Этонитазен
 | |
 | |
| Клинические данные | |
|---|---|
| код АТС |
|
| Юридический статус | |
| Юридический статус |
|
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| ИЮФАР/БПС | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ХЭМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.011.827 |
| Химические и физические данные | |
| Формула | С 22 Н 28 Н 4 О 3 |
| Молярная масса | 396.491 g·mol −1 |
| 3D model ( JSmol ) | |
| | |
Этонитазен , также известный как EA-4941 или CS-4640 , [ 2 ] представляет собой опиоид бензимидазола , о котором впервые сообщалось в 1957 году. [ 3 ] Было показано, что его эффективность примерно в 1000–1500 раз выше, чем у морфина на животных. [ 4 ] [ нужен лучший источник ]
Поскольку он характеризуется сильным потенциалом зависимости и склонностью вызывать глубокую депрессию дыхания , он не используется у людей. Однако он полезен на животных моделях для исследований зависимости , особенно тех, которые требуют, чтобы животные выпили или проглотили агент, поскольку он не такой горький, как соли опиатов, такие как сульфат морфина . [ нужна ссылка ]
Синтез
[ редактировать ]Этонитазен и родственные ему опиоидные агонисты бензимидазолы были открыты в конце 1950-х годов. [ 5 ] [ 6 ] [ 7 ] [ 8 ] [ 9 ] [ 10 ] группой швейцарских исследователей, работающих в фармацевтической фирме CIBA (ныне Novartis ). Одним из первых соединений, исследованных швейцарской командой, был 1-(β-диэтиламиноэтил)-2-бензилбензимидазол, который, как было обнаружено, обладал 10% обезболивающей активностью морфина при тестировании в биоанализах на грызунах. Это открытие побудило группу начать всестороннее систематическое исследование 2-бензилбензимидазолов и установить взаимосвязь между структурой и активностью этого нового семейства анальгетиков. Для получения этих соединений были разработаны два общих синтетических метода.
Первый метод заключался в конденсации о-фенилендиамина с пара- этоксифенилацетонитрилом с образованием 2-бензилбензимидазола. Затем бензимидазол алкилируют желаемым 1-хлор-2-диалкиламиноэтаном, образуя конечный продукт. Эта конкретная процедура оказалась наиболее полезной для получения бензимидазолов, у которых отсутствуют заместители в бензольных кольцах. Схема этого метода представлена ниже. [ 11 ]
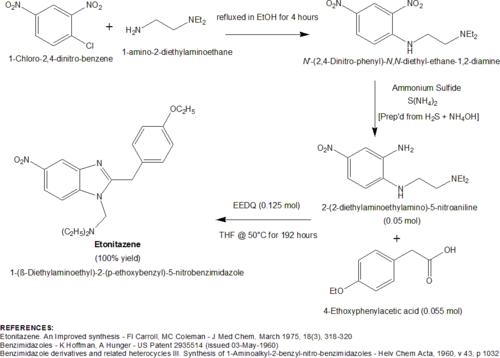
Самый универсальный синтез. [ 6 ] разработанная швейцарской командой, сначала включала алкилирование 1 2,4-динитрохлорбензола -амино-2-диэтиламиноэтаном с образованием N-(β-диэтиламиноэтил)-2,4-динитроанилина [также известного как N'-(2,4-динитрофенил) -N,N-диэтилэтан-1,2-диамин]. 2-нитрозаместитель о Затем соединение 2,4-динитроанилина селективно восстанавливают до соответствующего первичного амина , используя сульфид аммония в качестве восстановителя . Сульфид аммония можно получить in situ путем добавления концентрированного водного гидроксида аммония с последующим насыщением раствора газообразным сероводородом . Промежуточное соединение, образующееся в результате селективного восстановления 2-нитрозаместителя, 2-(β-Диэтиламиноэтиламино)-5- нитроанилина , затем подвергается реакции с гидрохлоридной солью иминоэтилового эфира 4-этоксифенилацетонитрила ( также известного как п-этоксибензилцианид). ). Иминоэфир, гидрохлорид этилового эфира 2-(4-этоксифенил)ацетимидовой кислоты , получают растворением 4-замещенного бензилцианида в смеси безводного этанола. и хлороформ , а затем насыщают этот раствор сухим газообразным хлористым водородом . Реакция 2-(β-диалкиламиноалкиламина)-5-нитроанилина с HCl-солью иминоэтилового эфира приводит к образованию этонитазена. Эта процедура особенно полезна при получении 4-, 5-, 6- и 7-нитробензимидазолов. Варьируя выбор замещенного иминоэфира фенилуксусной кислоты, можно получить соединения с разнообразными заместителями в бензольном кольце во 2-положении. Схема этого конкретного синтеза применительно к получению этонитазена показана ниже. [ 5 ]
Особенно новый высокопроизводительный синтез этонитазена был разработан Ф. И. Кэрроллом и М. К. Коулманом в середине 1970-х годов. [ 12 ] Авторам было поручено приготовить большие количества этонитазена, но они обнаружили, что традиционный синтез недостаточен. Проблема обычного синтеза заключалась в лабильности реагента иминоэфира, этилового эфира 2-(4-этоксифенил)ацетимидовой кислоты (полученного путем взаимодействия 4-этоксифенилацетонитрила с этанольной HCl). Иминоэфир требовал использования безводных условий реакции, и его было неудобно получать в больших количествах. Это побудило авторов экспериментировать с использованием реагента сочетания EEDQ (N-этоксикарбонил-2-этокси-1,2-дигидрохинолин), чтобы ускорить конденсацию 2-(2-диэтиламиноэтиламино)-5-нитроанилина с 4-этоксифенилуксусная кислота. Авторы обнаружили, что когда эту конденсацию проводили в присутствии 2 или более молярных эквивалентов EEDQ (добавленных порциями в 3 этапа) в ТГФ при 50 °C в течение 192 часов (8 дней), почти количественный выход (100%) Получен этонитазен. Помимо впечатляющего улучшения выхода по сравнению с традиционной процедурой, процедура обработки была значительно упрощена, поскольку хинолин , диоксид углерода и этанол Единственными образовавшимися побочными продуктами были . Схема этой процедуры представлена ниже.
Публикация 2011 года [ 13 ] [Дж. Орг. Chem., 2011, 76(23), 9577-9583] южнокорейской группы описали новый однореакторный синтез замещенных и незамещенных 2-бензилбензимидазолов, который можно легко адаптировать для получения этонитазена. Трехкомпонентный синтез прямого предшественника этонитазена, 2-(4-этоксибензил)-5-нитро-1H-бензимидазола, состоит из 2-бром- или 2-йод-5-нитрофениламина (1,0 молярного эквивалента), 4-замещенный бензальдегид (1,2 экв.) и азид натрия (2 экв.). 2-Гало-5-нитрофениламин для оптимальной активности требует наличия бром- или йод-группы. 2-Хлорфениламины совершенно нереакционноспособны. Помимо этих трех компонентов, реакцию оптимизировали в присутствии 0,05 молярного эквивалента (5 моль%) катализатора - хлорида меди(I) и 5 моль% лиганда ТМЭДА ( тетраметилэтилендиамин ). После нагревания этих компонентов при 120°C в течение 12 часов в ДМСО прямой предшественник этонитазена, 2-(4-этоксибензил)-5-нитро-1H-бензимидазол, образовывался с выходом примерно 80-90%. Затем вторичный аминный азот 2-(4-этоксибензил)-5-нитро-1H-бензимидазола алкилировали (2-хлорэтил)диэтиламином с образованием этонитазена. [ 11 ] Схема этого синтеза представлена ниже.
Аналоги
[ редактировать ]Известен ряд аналогов, причем единственным другим широко известным соединением, появившимся в результате первоначальных исследований 1950-х годов, является клонитазен , который намного слабее, чем этонитазен (примерно в 3 раза сильнее морфина). ряд дизайнерских Совсем недавно, примерно в конце 2018 года , на незаконных рынках по всему миру начал появляться аналогов, причем наиболее известными соединениями являются метонитазен , изотонитазен и этазен , хотя другие продолжают появляться. [ 14 ] [ 15 ]
Из этих аналогов только этонитазен и клонитазен прямо перечислены в конвенциях ООН и поэтому контролируются во всем мире. Остальное будет незаконным только в таких странах, как США, Австралия и Новая Зеландия, где действуют законы, эквивалентные Федеральному закону об аналогах . В Соединенных Штатах этонитазен входит в список контролируемых наркотических веществ Списка I с номером DEA ASCCN 9624 и 25 граммами ( 7 ⁄ 8 унций) производственная квота по состоянию на 2022 год.
Незаконное производство
[ редактировать ]Ограничено незаконное производство и продажа этонитазена. Обнаруженный на московском нелегальном рынке наркотиков в 1998 году, его преимущественно курили в сигаретах со шнурком. [ 16 ] Химик из Morton Thiokol синтезировал это соединение для собственных нужд. [ 17 ] Препарат был произведен в России в 1996 году и продавался как «Китайский карлик». Препарат привел к неподтверждённому количеству смертей из-за его неопределённой эффективности. [ 18 ] Похоже, что он имеет крутую кривую зависимости от дозы и непредсказуемую фармакокинетику, особенно при инъекциях, аналогично некоторым другим сильнодействующим опиоидам, таким как декстроморамид , что может сделать этонитазен особенно опасным по сравнению с опиоидами аналогичной активности, такими как фентанил . [ 19 ]
См. также
[ редактировать ]- Этазен (деснитроэтонитазен)
Ссылки
[ редактировать ]- ^ Анвиса (31 марта 2023 г.). «ПДК № 784 – Перечни наркотических средств, психотропных веществ, прекурсоров и других веществ, находящихся под особым контролем» [Постановление Коллегии Коллегии № 784 784 - Списки наркотических, психотропных веществ, прекурсоров и других веществ, находящихся под особым контролем] (на бразильском португальском языке). Официальный вестник Союза (опубликовано 4 апреля 2023 г.). Архивировано из оригинала 03 августа 2023 г. Проверено 16 августа 2023 г.
- ^ Кинг Дж.В., Кливленд Дж.П., Леннокс У.Дж. (ноябрь 1991 г.). Уильямс Дж.Д., Ривз П.Дж. (ред.). Синтез и биологическая активность 2-(альфа-гидрокси-пара-алкоксибензила) и 2-алкоксиариламиноаналогов этонитазена (CS-4640) . Материалы научной конференции Центра химических исследований, разработок и инженерии армии США по исследованиям химической защиты. Абердинский испытательный полигон, Мэриленд: Центр исследований, разработок и инженерии Эджвуда, Абердинский испытательный полигон, Мэриленд.
- ^ Патент США 2935514 , Хоффманн К., Хангер А., Кебрле Дж., Росси А., «Бензимидазолы», опубликован 19 сентября 1957 г., выдан 3 мая 1960 г., передан компании Ciba Pharmaceutical Products Inc., Саммит, Нью-Джерси.
- ^ Виклер А., Мартин В.Р., Пескор Ф.Т., Идс К.Г. (октябрь 1963 г.). «Факторы, регулирующие пероральное потребление опиоида (этонитазена) крысами, зависимыми от морфия». Психофармакология . 5 (1): 55–76. дои : 10.1007/BF00405575 . ПМИД 14082382 . S2CID 38073529 .
- ^ Перейти обратно: а б Хунгер А., Кебрле Дж., Росси А., Хоффманн К. (октябрь 1957 г.). «[Синтез анальгетически активных производных бензимидазола с основными замещениями]» [Синтез анальгетически активных производных бензимидазола с основными замещениями]. Эксперименты . 13 (10): 400–401. дои : 10.1007/BF02161116 . ПМИД 13473817 . S2CID 32179439 .
- ^ Перейти обратно: а б Росси А., Голод А., Кебрле Дж., Хоффманн К. (1960). Конденсация о-фенилендиамина с α-арилом и γ-арилом ацетоацетатом» «Производные бензимидазола и родственные гетероциклы IV. -ацетоацетатом. Helvetica Chimica Acta (на немецком языке). 43 (4): 1046–1056. дои : 10.1002/hlca.19600430413 .
- ^ Росси А., Голод А., Кебрле Дж., Хоффманн К. (1960). «Производные бензимидазола и родственные им гетероциклы V. Конденсация о-фенилендиамина с алифатическими и алициклическими β- кетоэфирами». Helvetica Chimica Acta (на немецком языке). 43 (5): 1298–1313. дои : 10.1002/hlca.19600430515 .
- ^ Голод А., Кебрле Дж., Росси А., Хоффманн К. (1960). «Производные бензимидазола и родственные гетероциклы VI. Синтез эфиров и амидов фенил-[1-аминоалкилбензимидазолил-(2)]уксусной кислоты» [Производные бензимидазола и родственные гетероциклы VI. Синтез эфиров и амидов фенил-[1-аминоалкилбензимидазолил-(2)]уксусной кислоты. Helvetica Chimica Acta (на немецком языке). 43 (6): 1727–1733. дои : 10.1002/hlca.19600430634 .
- ^ Голод А., Кебрле Дж., Росси А., Хоффманн К. (1961). «Производные бензимидазола и родственные гетероциклены VII. Синтез новых 2-аминобензимидазолов» [Производные бензимидазола и родственные гетероциклы VII. Синтез нового 2-аминобензимидазола. Helvetica Chimica Acta (на немецком языке). 44 (5): 1273–1282. дои : 10.1002/hlca.19610440513 .
- ^ Гросс Ф., Турриан Х. (октябрь 1957 г.). «[Производные бензимидазола с сильным обезболивающим действием]» [Производные бензимидазола с сильным обезболивающим действием]. Эксперименты . 13 (10): 401–403. дои : 10.1007/BF02161117 . ПМИД 13473818 . S2CID 6824038 .
- ^ Перейти обратно: а б Голод А., Кебрле Дж., Росси А., Хоффманн К. (1960). «Производные бензимидазола и гетероциклен. II. Синтез 1-аминоалкил-2-бензилбензимидазолена» [Производные бензимидазола и родственные гетероциклы II. Синтез 1-аминоалкил-2-бензилбензимидазолов. Helvetica Chimica Acta (на немецком языке). 43 (3): 800–809. дои : 10.1002/hlca.19600430323 .
- ^ Кэрролл Ф.И., Коулман М.С. (март 1975 г.). «Этонитазен. Улучшенный синтез». Журнал медицинской химии . 18 (3): 318–320. дои : 10.1021/jm00237a024 . ПМИД 237125 .
- ^ Ким Ю, Кумар М.Р., Пак Н, Хо Ю, Ли С (декабрь 2011 г.). «Медь-катализируемый, однореакторный, трехкомпонентный синтез бензимидазолов путем конденсации и образования связи CN». Журнал органической химии . 76 (23): 9577–9583. дои : 10.1021/jo2019416 . ПМИД 22034860 .
- ^ Бланкарт П., Каннаерт А., Ван Уйтфанге К., Хульпиа Ф., Деконинк Э., Ван Каленберг С., Стоув С. (апрель 2020 г.). «Отчет о новом новом классе сильнодействующих опиоидов бензимидазола НПВ: химическая и функциональная характеристика изотонитазена in vitro» . Тестирование и анализ наркотиков . 12 (4): 422–430. дои : 10.1002/dta.2738 . ПМИД 31743619 . S2CID 208187034 .
- ^ Вандепут М., Ван Ютфанге К., Лэйл Н., Жермен Д.С., Юла Д., Стоув С. (12 ноября 2020 г.). «Синтез, химическая характеристика и оценка активности мю-опиоидных рецепторов новой группы нитазеновых новых синтетических опиоидов» . Автореа . дои : 10.22541/au.160520665.59016513/v1 . S2CID 234646245 .
- ^ Sorokin VI, Ponkratov KV, Drozdov MA (1999). "Etonitazene Encountered in Moscow". Microgram . 32 (9): 239–244.
- ^ Риви П. (3 июня 2003 г.). «Химику предъявлено обвинение по делу о наркотиках» . Новости Дезерета . Солт-Лейк-Сити. Архивировано из оригинала 7 марта 2014 года.
- ^ "Этонитазен (etonitazene) - описание препарата" [Etonitazene (etonitazene) - a description of the drug] (in Russian). Social Services LLC. Archived from the original on 23 March 2019.
- ^ Кишиока С., Ко MC, Вудс Дж. Х. (май 2000 г.). «Дилтиазем усиливает анальгетический, но не респираторный депрессивный эффект морфина у макак-резус». Европейский журнал фармакологии . 397 (1): 85–92. дои : 10.1016/s0014-2999(00)00248-x . ПМИД 10844102 .