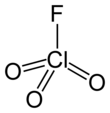
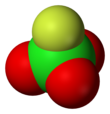
Перхлорилфторид
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Перхлорилфторид | |||
| Другие имена Оксифторид хлора, Перхлорфторид, оксид хлора и фтора, триоксихлорфторид, фторид хлорной кислоты | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.028.660 | ||
| Номер ЕС |
| ||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| ClO 3 Ф | |||
| Молярная масса | 102.4496 g/mol | ||
| Появление | Бесцветный газ | ||
| Запах | сладкий запах | ||
| Плотность | 1,434 г/см 3 | ||
| Температура плавления | -147,8 ° C (-234,0 ° F; 125,3 К) | ||
| Точка кипения | -46,7 ° C (-52,1 ° F; 226,5 К) | ||
| Критическая точка ( T , P ) | 95,2 ° C (203,4 ° F; 368,3 К), 53 стандартных атмосферы (5400 кПа; 780 фунтов на квадратный дюйм) [1] | ||
| 0,06 г/100 мл (20 °С), медленный гидролиз | |||
| Давление пара | 10,5 атм (20 °С) [2] | ||
| Вязкость | 3,91 х 10 −3 Па.с (@ точка плавления) | ||
| Структура | |||
| Тетраэдрический [3] : 373 | |||
| Термохимия | |||
Стандартный моляр энтропия ( S ⦵ 298 ) | 278,97 Дж/(моль*К) | ||
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | -21,42 кДж/моль [4] : 380 | ||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | окисляющие, токсичные. Некоррозионный. | ||
| NFPA 704 (огненный алмаз) | |||
| 3 ч/млн | |||
| Летальная доза или концентрация (LD, LC): | |||
ЛК 50 ( средняя концентрация ) | 385 частей на миллион (крыса, 4 часа) 451 частей на миллион (собака, 4 часа) [5] | ||
LC Lo ( самый низкий из опубликованных ) | 2000 м.д. (крыса, 40 мин) 451 частей на миллион (собака, 4 часа) [5] | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
ПЭЛ (допустимо) | СВВ 3 ppm (13,5 мг/м 3 ) [2] | ||
РЕЛ (рекомендуется) | СВВ 3 ppm (14 мг/м 3 ) ST 6 ppm (28 мг/м 3 ) [2] | ||
IDLH (Непосредственная опасность) | 100 частей на миллион [2] | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Перхлорилфторид [6] представляет собой химически активный газ с химической формулой ClO
3 Ф. Имеет характерный сладкий запах [7] это похоже на бензин и керосин. Он токсичен и является сильным окислителем и фторирующим агентом . Это фторид кислоты хлорной .
Несмотря на небольшую энтальпию образования (Δ f H ° = -5,2 ккал/моль (-22 кДж/моль)), он кинетически стабилен и разлагается только при 400 °С. [3] : 380 Однако он весьма реакционноспособен по отношению к восстановителям и анионам, при этом атом хлора действует как электрофил . [3] : 382 Он реагирует взрывоопасно с восстановителями, такими как амиды металлов , гидриды металлов и т. д. [7] Его гидролиз в воде происходит очень медленно, в отличие от гидролиза хлорилфторида .
Синтез и химия
[ редактировать ]Перхлорилфторид получают главным образом путем фторирования перхлоратов . Первоначальные синтезы в начале 1950-х годов использовали газообразный фтор или фториды и анодное окисление в качестве фторирующих агентов, но они дают взрывоопасные газовые смеси. [8] Обычным фторатором в современных синтезах является пентафторид сурьмы : [3] : 372–373
- ClO −
4 + 3 ВФ + 2 СбФ
5 → ClO
3 Ф + Ч
33О +
+ 2 СбФ −
6
Альтернативно, перхлорат калия реагирует с избытком серной фтористой кислоты с образованием бисульфата калия и перхлорилфторида: [8]
- KClO 4 + HFSO 3 → KHSO 4 + FClO 3
ClO
3 F реагирует со спиртами с образованием алкилперхлоратов , которые являются чрезвычайно чувствительными к ударам взрывчатыми веществами. [9] В присутствии кислоты Льюиса ее можно использовать для введения –ClO.
3 группируется в ароматические кольца посредством электрофильного ароматического замещения . [10]
Приложения
[ редактировать ]Перхлорилфторид используется в органической химии как мягкий фторирующий агент. [3] : 383 Это был первый промышленно значимый электрофильный фторирующий агент, используемый с 1960-х годов для производства фторированных стероидов . [9] В присутствии трихлорида алюминия он также использовался в качестве реагента электрофильного перхлорилирования ароматических соединений. [11]
Перхлорилфторид был исследован как высокоэффективный окислитель жидкого ракетного топлива . [12] По сравнению с пентафторидом хлора и пентафторидом брома он имеет значительно меньший удельный импульс , но не склонен к коррозии резервуаров. Не требует криогенного хранения. Химик ракетного топлива Джон Друри Кларк сообщил в своей книге «Зажигание!» что перхлорилфторид полностью смешивается с полностью галогенными окислителями, такими как трифторид хлора и пентафторид хлора , и такая смесь обеспечивает необходимый кислород для правильного сжигания углеродсодержащего топлива. [13] Его также можно использовать в пламенной фотометрии в качестве источника возбуждения. [14]
Безопасность
[ редактировать ]Перхлорилфторид токсичен, его ПДК составляет 3 ppm . [15] Это сильный раздражитель легких и глаз, способный вызвать ожоги на открытых участках кожи. Его уровень IDLH составляет 100 ppm. [16] Симптомы воздействия включают головокружение, головные боли, обмороки и цианоз . Воздействие токсичных уровней вызывает тяжелое воспаление дыхательных путей и отек легких . [12]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Будавари, Сьюзен, изд. (1989). «7297. Перхлорилфторид». Индекс Merck — Энциклопедия химических веществ, лекарств и биологических препаратов . Рэуэй , Нью-Джерси : Merck. п. 1231. ИА147021.
- ^ Jump up to: а б с д Карманный справочник NIOSH по химическим опасностям. «#0490» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Jump up to: а б с д и Гарри Юлиус Эмелеус ; А.Г. Шарп (1976). Успехи неорганической химии и радиохимии, Том 18 . Академическая пресса. ISBN 0-12-023618-4 .
- ^ Чейз, МВт (2018). «Перхлорилфторид». Интернет-книга NIST по химии, SRD 69 . стр. 1–1951.
- ^ Jump up to: а б «Перхлорилфторид» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Лаборатория химической науки и технологий. «Перхлорилфторид» . Национальный институт стандартов и технологий . Проверено 28 ноября 2009 г.
- ^ Jump up to: а б Джаред Ледгард (2007). Подготовительное руководство по взрывчатым веществам (3-е изд.). Лулу.com. п. 77. ИСБН 978-0-615-14290-6 .
- ^ Jump up to: а б Кларк 2018 , с. 80.
- ^ Jump up to: а б Пер Кирш (2004). Современная фторорганическая химия: синтез, реакционная способность, применение . Вайли-ВЧ. п. 74. ИСБН 3-527-30691-9 .
- ^ Питер Бернар Дэвид Де ла Мар (1976). Электрофильное галогенирование: пути реакций, включающие атаку электрофильных галогенов на ненасыщенные соединения . Архив Кубка. п. 63. ИСБН 0-521-29014-7 .
- ^ Инман, CE; Эстерлинг, RE; Тычковский, Э.А. (1 октября 1958 г.). «Реакции перхлорилфторида с органическими соединениями. I. Перхлорилирование ароматических соединений1». Журнал Американского химического общества . 80 (19): 5286–5288. дои : 10.1021/ja01552a069 . ISSN 0002-7863 .
- ^ Jump up to: а б Джон Берк Салливан; Гэри Р. Кригер (2001). Клиническое здоровье окружающей среды и токсическое воздействие (2-е изд.). Липпинкотт Уильямс и Уилкинс. п. 969. ИСБН 0-683-08027-Х .
- ^ Кларк, Джон Друри (23 мая 2018 г.). Зажигание!: Неофициальная история жидкого ракетного топлива . Издательство Университета Рутгерса. п. 302. ИСБН 978-0-8135-9918-2 . ОСЛК 281664 .
- ^ Шмаух, GE; Серфасс, Э.Дж. (1958). «Использование перхлорилфторида в пламенной фотометрии». Прикладная спектроскопия . 12 (3): 98–102. Бибкод : 1958ApSpe..12...98S . дои : 10.1366/000370258774615483 . S2CID 95615583 .
- ^ Национальный институт безопасности и гигиены труда. «Карманный справочник NIOSH по химическим опасностям» . Центры по контролю и профилактике заболеваний . Проверено 31 октября 2013 г.
- ^ Национальный институт охраны труда. «Документация по концентрациям, непосредственно опасным для жизни и здоровья (IDLH)» . Центры по контролю и профилактике заболеваний . Проверено 31 октября 2013 г.