Пентафторид хлора
| |||
 | |||
| Идентификаторы | |||
|---|---|---|---|
3D model ( JSmol ) | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.033.734 | ||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| КлФ 5 | |||
| Молярная масса | 130.445 g mol −1 | ||
| Появление | бесцветный газ | ||
| Плотность | 4,5 кг/м 3 (г/л) | ||
| Температура плавления | -103 ° C (-153 ° F; 170 К) | ||
| Точка кипения | -13,1 ° C (8,4 ° F; 260,0 К) | ||
| Гидролизуется | |||
| Структура | |||
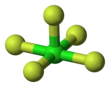
| Квадратно-пирамидальный | |||
| Термохимия | |||
Стандартный моляр энтропия ( S ⦵ 298 ) | 310,73 Дж.К. −1 моль −1 | ||
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −238,49 кДж моль −1 | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Пентафторид хлора представляет собой межгалогенное соединение формулы ClF 5 . Этот бесцветный газ является сильным окислителем, который когда-то был кандидатом в окислители для ракет. Молекула имеет квадратно-пирамидальную структуру с C4v симметрией . [1] что подтверждается его высоким разрешением 19 Спектр ЯМР F. [2] Впервые он был синтезирован в 1963 году. [3]
Подготовка
[ редактировать ]Некоторые из самых ранних исследований препарата были засекречены. [4] [5] Впервые он был получен путем фторирования при трифторида хлора высоких температурах и высоких давлениях: [4]
- ClF 3 + F 2 → ClF 5
- ClF + 2F 2 → ClF 5
- Cl 2 + 5F 2 → 2ClF 5
- CsClF 4 + F 2 → CsF + ClF 5
NiF 2 катализирует эту реакцию. [6]
Некоторые фториды металлов, MClF 4 (т.е. KClF 4 , RbClF 4 , CsClF 4 ), реагируют с F 2 с образованием ClF 5 и соответствующего фторида щелочного металла. [5]
Реакции
[ редактировать ]В сильно экзотермической реакции ClF 5 реагирует с водой с образованием фторида хлорила и фторида водорода : [7]
- КФ
5 + 2 ч
2 О → ClO
2 Ф + 4 ВЧ
Это также сильный фторирующий агент. При комнатной температуре он легко реагирует со всеми элементами (включая «инертные» элементы, такие как платина и золото ), за исключением благородных газов , азота , кислорода и фтора . [2]
Использование
[ редактировать ]Ракетное топливо
[ редактировать ]Пентафторид хлора когда-то рассматривался как окислитель для ракет. Как метательное топливо он имеет более высокий максимальный удельный импульс , чем ClF 3 , но с такими же трудностями в обращении. [4] Из-за опасного характера пентафторида хлора его еще не использовали в крупномасштабных ракетных двигательных установках.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . п. 833. ИСБН 978-0-08-037941-8 .
- ^ Jump up to: а б Пилипович Д.; Майя, В.; Лоутон, Э.А.; Бауэр, Х.Ф.; Шихан, DF; Огимати, Нью-Йорк; Уилсон, РД; Гундерлой, ФК; Бедвелл, В.Е. (1967). «Пентафторид хлора. Получение и свойства». Неорганическая химия . 6 (10): 1918. doi : 10.1021/ic50056a036 .
- ^ Смит Д.Ф. (1963). «Пентафторид хлора». Наука . 141 (3585): 1039–1040. Бибкод : 1963Sci...141.1039S . дои : 10.1126/science.141.3585.1039 . ПМИД 17739492 . S2CID 39767609 .
- ^ Jump up to: а б с Кларк, Джон Друри (23 мая 2018 г.). Зажигание!: Неофициальная история жидкого ракетного топлива . Издательство Университета Рутгерса. стр. 87–88. ISBN 978-0-8135-9918-2 .
- ^ Jump up to: а б Смит Д.Ф. (1963). «Пентафторид хлора». Наука . 141 (3585): 1039–1040. Бибкод : 1963Sci...141.1039S . дои : 10.1126/science.141.3585.1039 . ПМИД 17739492 . S2CID 39767609 .
- ^ Шмальц А, Жемва Б, Сливник Ю, Лутар К (1981). «О синтезе пентафторида хлора». Журнал химии фтора . 17 (4): 381–383. дои : 10.1016/S0022-1139(00)81783-2 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . п. 834. ИСБН 978-0-08-037941-8 .