Соединения фтора

Фтор образует множество химических соединений, в которых он всегда принимает степень окисления -1. С другими атомами фтор образует либо полярные ковалентные связи, либо ионные связи. Чаще всего ковалентные связи с участием атомов фтора являются одинарными , хотя существуют по крайней мере два примера связи более высокого порядка. [2] Фторид может действовать как мостиковый лиганд между двумя металлами в некоторых сложных молекулах. Молекулы, содержащие фтор, также могут иметь водородную связь (более слабую мостиковую связь с некоторыми неметаллами). [3] Химия фтора включает неорганические соединения, образованные водородом, металлами, неметаллами и даже благородными газами; а также разнообразный набор органических соединений. [примечание 1] Для многих элементов (но не для всех) наивысшая известная степень окисления может быть достигнута во фториде. Для одних элементов это достигается исключительно во фториде, для других исключительно в оксиде; а для третьих (элементов определенных групп) высшие степени окисления оксидов и фторидов всегда равны. [4]
Дифтор
[ редактировать ]В то время как отдельный атом фтора имеет один неспаренный электрон, молекулярный фтор (F 2 ) имеет все электроны спаренными. Это делает его диамагнитным (слегка отталкиваемым магнитами) с магнитной восприимчивостью -1,2×10. −4 ( SI ), что близко к теоретическим предсказаниям. [5] Напротив, двухатомные молекулы соседнего элемента кислорода с двумя неспаренными электронами на молекулу являются парамагнитными (притягиваются к магнитам). [6]
| Х | ХХ | ХХ | ВХ 3 | АлХ 3 | СХ 4 |
|---|---|---|---|---|---|
| Ф | 159 | 574 | 645 | 582 | 456 |
| кл. | 243 | 428 | 444 | 427 | 327 |
| Бр | 193 | 363 | 368 | 360 | 272 |
| я | 151 | 294 | 272 | 285 | 239 |
Связь фтор-фтор молекулы дифтора относительно слаба по сравнению со связями более тяжелых молекул дигалогена. Энергия связи значительно слабее, чем у молекул Cl 2 или Br 2 и аналогична легко расщепляемым связям кислород-кислород пероксидов или связям азот-азот гидразинов . [8] Ковалентный радиус фтора около 71 пикометра, обнаруженный в молекулах F 2 , значительно больше, чем у других соединений из-за этой слабой связи между двумя атомами фтора. [9] Это результат сравнительно большого электронного и межъядерного отталкивания в сочетании с относительно небольшим перекрытием связывающих орбиталей, возникающим из-за малого размера атомов. [10]
Молекула F 2 обычно описывается как имеющая ровно одну связь (другими словами, порядок связи 1), обеспеченный одним p-электроном на атом, как и другие молекулы галогена X 2 . Однако p-электронные орбитали более тяжелых галогенов частично смешиваются с орбиталями d-орбиталей, что приводит к увеличению эффективного порядка связей; например, хлор имеет порядок связи 1,12. [11] Электроны фтора не могут проявлять этот d-характер, поскольку не существует таких d-орбиталей, близких по энергии к валентным орбиталям фтора . [11] Это также помогает объяснить, почему связь в F 2 слабее, чем в Cl 2 . [10]
Реактивность
[ редактировать ]Реакции с элементарным фтором часто бывают внезапными или взрывными. Многие вещества, которые обычно считаются нереакционноспособными, такие как стальной порошок, осколки стекла и асбестовые волокна, легко разрушаются холодным газообразным фтором. Дерево и даже вода горят пламенем под воздействием струи фтора без необходимости использования искры. [12] [13]
| Внешние видео | |
|---|---|
Реакция фтора с цезием , видео Королевского института. (Оба видео сняты в лаборатории фтора Университета Лестера.) |
Реакции элементарного фтора с металлами требуют разнообразных условий, зависящих от металла. Часто металл (например, алюминий, железо или медь) необходимо измельчать в порошок, поскольку многие металлы пассивируются , образуя защитные слои фторида металла, которые сопротивляются дальнейшему фторированию. [7] Щелочные металлы могут реагировать с фтором взрывоопасно, тогда как щелочноземельные металлы реагируют не так агрессивно. Благородные металлы рутений, родий, палладий, платина и золото реагируют наименее легко, требуя чистого газообразного фтора при температуре 300–450 ° C (575–850 ° F). [14]
Фтор реагирует с водородом взрывоопасно , подобно щелочным металлам. [15] Галогены . легко реагируют с газообразным фтором [16] как и тяжелый благородный газ радон . [17] Более легкие благородные газы ксенон и криптон могут вступать в реакцию с фтором при особых условиях, тогда как аргон подвергается химическим превращениям только с фтористым водородом . [18] Азот с его очень стабильными тройными связями требует электрического разряда и высоких температур для прямого соединения с фтором. [19] Фтор реагирует с аммиаком с образованием азота и фторида водорода .
Химические характеристики, эффекты присутствия в молекуле
[ редактировать ]В химии фтора преобладает его сильная тенденция присоединять электрон. Это самый электроотрицательный элемент, а элементарный фтор является сильным окислителем. Удаление электрона из атома фтора требует так много энергии, что не известно ни одного известного реагента, способного окислить фтор до какой-либо положительной степени окисления . [20]
фтора Следовательно, единственная общая степень окисления — −1. Оно отличается от этого значения у элементарного фтора, атомы которого связаны друг с другом и, следовательно, находятся в степени окисления 0, а также у нескольких многоатомных ионов: очень нестабильных анионов F. −
2 и Ф −
3 с промежуточными степенями окисления существуют при очень низких температурах и разлагаются при температуре около 40 К. [21] (В очень редких случаях фтор может существовать в нулевой степени окисления, отличной от элементарной формы, а именно, в AuF 7 и в кластере SF 6. + с атомами гелия [22] ). Кроме того, Ф +
Было предсказано, что катион 4 и несколько родственных видов будут стабильными. [23]
Фтор образует соединения со всеми элементами, кроме неона и гелия . В частности, он образует бинарные соединения , называемые фторидами , со всеми указанными элементами, кроме аргона . Все элементы до эйнштейния , элемента 99, были проверены, за исключением астата и франция . [24] Известно также, что фтор образует соединения с менделевием , элементом 101, [25] резерфордий , элемент 104, [26] и сиборгий , элемент 106. [27]
В результате своего небольшого размера и высокой плотности отрицательного заряда фторид-анион является самым «твердым» основанием (т. е. имеет низкую поляризуемость ). Из-за этого фториды в кристаллах реальных солей часто имеют более высокие эффективные заряды, чем оксиды того же металла, хотя формальный заряд кислорода в два раза больше, чем у фтора. [ нужна ссылка ]
Как часть молекулы, это часть с большим индуктивным эффектом . В последнем случае существенно повышается кислотность молекулы: в результате анион, образовавшийся после отдачи протона, становится стабильным. Рассмотрим уксусную кислоту и ее моно- , ди- и трифторуксусные производные и их значения pK a (4,74, 2,66, 1,24 и 0,23). [примечание 2] ); [28] другими словами, трифторпроизводное в 33 800 раз сильнее кислоты, чем уксусная. [29] Фтор является основным компонентом самой сильной из известных кислот с нейтральным зарядом, фторсурьмяной кислоты ( H
2 ФСбФ
6 ). [30] Есть свидетельства существования еще более сильной кислоты, называемой золотофтористоводородной кислотой ( H
2 ФАуФ
6 ), но оно не оказалось изолируемым. [31]
В молекуле, состоящей из центрального атома и присоединенного к нему фтора, межмолекулярная связь не очень прочная. Более того, плотные отрицательные шарики, которыми являются фторы, отталкиваются друг от друга. Следовательно, прочность межмолекулярной связи падает еще больше, что приводит к низкой температуре плавления высоких фторидов. [ нужна ссылка ]
фтороводород
[ редактировать ]| HF и H 2 O Сходство | |
 |  |
| Точки кипения галогеноводородов (синий) и халькогенидов водорода (красный): HF и H 2 O нарушают тенденции из-за водородных связей . | Температура замерзания смесей HF/H 2 O: стрелками указаны соединения в твердом состоянии. |
Фтор соединяется с водородом, образуя соединение (HF), называемое фтороводородом или, особенно в случае водных растворов, плавиковой кислотой. Тип связи HF — один из немногих, способных образовывать водородные связи (создавать дополнительные кластерные ассоциации с подобными молекулами). Это влияет на различные особенности свойств фтористого водорода. В некотором смысле это вещество ведет себя больше как вода, также очень склонная к образованию водородных связей, чем один из других галогеноводородов, таких как HCl . [32] [33] [34]
Водородные связи между молекулами HF приводят к высокой вязкости в жидкой фазе и более низкому, чем ожидалось, давлению в газовой фазе. Фторид водорода не кипит до 20 ° C, в отличие от более тяжелых галогеноводородов, которые кипят от -85 ° C до -35 ° C (от -120 ° F до -30 ° F). HF смешивается с водой (растворяется в любой пропорции), в то время как другие галогениды водорода имеют большие интервалы растворимости в воде. Фтороводород и вода также образуют несколько соединений в твердом состоянии, в первую очередь соединение 1: 1, которое не плавится до -40 ° C (-40 ° F), что на 44 градуса Цельсия (79 градусов по Фаренгейту) выше точки плавления. чистого HF. [35]
В отличие от других галоидоводородных кислот, таких как соляная кислота , фтороводород представляет собой лишь слабую кислоту в водном растворе с константой диссоциации кислоты (pK a ), равной 3,19. [36] Слабость HF как водной кислоты парадоксальна, учитывая, насколько полярна связь HF, гораздо более полярная, чем связь в HCl, HBr или HI. Объяснение такого поведения сложное, оно связано с различными тенденциями к образованию кластеров HF, воды и фторид-иона, а также с термодинамическими проблемами. [примечание 3] свойство, называемое гомоконъюгацией При больших концентрациях обнаруживается . HF начинает принимать ионы фтора, образуя многоатомные ионы (такие как бифторид , HF −
2 ) и протоны, что значительно увеличивает кислотность соединения. [38] Плавиковая кислота также является самой сильной из галоидоводородных кислот в уксусной кислоте и подобных растворителях. [39] Его скрытый потенциал кислотности также проявляется в том факте, что он протонирует такие кислоты, как соляная, серная или азотная. [40] Несмотря на свою слабость, плавиковая кислота очень коррозионна и разъедает даже стекло (только гидратированное). [38]
Сухой фтористый водород легко растворяет фториды низковалентных металлов. Некоторые молекулярные фториды также растворяются в HF. Многие белки и углеводы растворяются в сухом HF и извлекаются из него. Большинство нефторидных неорганических химикатов реагируют с HF, а не растворяются. [41]
Фториды металлов
[ редактировать ]Фториды металлов весьма отличаются от галогенидов других металлов и имеют отличительную структуру. Во многих отношениях фториды металлов больше похожи на оксиды , часто имеющие схожие связи и кристаллические структуры. [42]
Благодаря своей высокой электроотрицательности фтор стабилизирует металлы в более высоких степенях окисления с высоким соотношением M:галогениды. Известны многочисленные нейтральные по заряду пента- и гексафториды, тогда как аналогичные хлориды и бромиды встречаются реже. Молекулярные бинарные фториды часто летучие и представляют собой твердые вещества. [43] жидкости, [44] или газы [45] при комнатной температуре.
Растворимость фторидов сильно варьируется, но имеет тенденцию уменьшаться по мере увеличения заряда иона металла. Растворенные фториды образуют основные растворы. [46]
| Фториды элементов переходных металлов 25–29 | ||||
 |  |  |  |  |
| Фторид марганца(II) | Фторид железа(III) | Фторид кобальта(II) | Никель(II) фторид | Фторид меди(II) |
Фториды металлов с низкой степенью окисления
[ редактировать ]
Щелочные металлы образуют монофториды . Все они растворимы и имеют структуру хлорида натрия (каменной соли) . [47] Поскольку фторид-анион является основным, многие фториды щелочных металлов образуют бифториды с формулой MHF 2 . Среди других монофторидов только серебро(I) [48] и таллий(I) [49] фториды хорошо охарактеризованы. Оба очень растворимы, в отличие от других галогенидов этих металлов.
В отличие от монофторидов дифториды могут быть растворимыми или нерастворимыми. Некоторые дифториды переходных металлов, например меди(II) и никеля(II) , растворимы. [48] Щелочноземельные металлы образуют дифториды . нерастворимые [48] Напротив, хлориды щелочноземельных металлов легко растворимы. [48]
Многие из дифторидов принимают структуру флюорита, названную в честь фторида кальция (а также принятую некоторыми диоксидами металлов, такими как CeO 2 , UO 2 , ThO 2 и т. д.), которая окружает каждый катион металла 8 фторидами. Некоторые дифториды принимают рутиловую структуру , названную в честь формы диоксида титана, а также принятую некоторыми диоксидами других металлов. Структура тетрагональная и помещает атомы металла в октаэдрическую координацию.
Дифторид бериллия отличается от других дифторидов. В целом бериллий имеет тенденцию к ковалентной связи , гораздо большую, чем другие щелочноземельные металлы, а его фторид частично ковалентен (хотя все же более ионный, чем другие его галогениды). BeF 2 имеет много общего с SiO 2 (кварц), твёрдым веществом с преимущественно ковалентной сеткой . BeF 2 имеет тетраэдрически координированный металл и образует стекла (трудно кристаллизуется). В кристаллическом состоянии фторид бериллия имеет ту же кристаллическую структуру при комнатной температуре, что и кварц, а также имеет много общих структур при более высоких температурах.
Дифторид бериллия хорошо растворим в воде. [48] в отличие от других щелочноземельных металлов. (Хотя они являются сильно ионными, они не растворяются из-за особенно сильной энергии решетки флюорита.) Однако BeF 2 имеет гораздо более низкую электропроводность в растворе или в расплавленном состоянии, чем можно было бы ожидать, если бы он был ионным. [50] [51] [52] [53]
| Порядок и беспорядок в дифторидах | |
 |  |
| Структура флюорита, принятая многими дифторидами. | Неупорядоченная структура бериллиевого стекла (эскиз в двух измерениях) |
Многие металлы образуют трифториды , такие как железо, висмут, редкоземельные элементы и металлы в алюминиевых и скандиевых столбцах периодической таблицы. Трифториды многих редких земель, а также висмута имеют YF3 структуру . Трифториды плутония, самария (при высокой температуре) и лантана принимают структуру LaF 3 . Трифториды железа и галлия имеют структуру FeF 3 , подобную триоксиду рения . Только ScF 3 является кубическим (ReO 3 ) при температуре окружающей среды; Этот материал также обладает необычным свойством отрицательного теплового расширения , что означает, что он сжимается при нагревании в довольно широком диапазоне температур.

Трифторид золота имеет структуру связанных квадратов –AuF 4 –, которые выстраиваются в спираль (спиральную цепочку). [54] В отличие от явно ионного трифторида золота, его трихлорид и трибромид представляют собой летучие димерные молекулы. [55] Трифторид алюминия представляет собой твердое вещество с высокой температурой плавления, которое представляет собой мономер в газовой фазе, в то время как другие его тригалогениды представляют собой легкоплавкие летучие молекулы или линейные полимерные цепи, которые образуют димеры в газовой фазе. [56] Ни один трифторид не растворяется в воде, но некоторые из них растворимы в других растворителях. [57]
Тетрафториды . демонстрируют смесь ионных и ковалентных связей Цирконий, гафний и многие актиниды образуют тетрафториды с ионной структурой, которая помещает катион металла в 8-координатную квадратную антипризму . [58] [59] Температура плавления составляет около 1000 °C. [60]
Тетрафториды титана и олова являются полимерами с температурой плавления ниже 400 °C. (Напротив, их тетрахлориды являются молекулярными и жидкими при комнатной температуре.) Тетрафторид ванадия имеет структуру, аналогичную структуре олова. [61] и диспропорционирует при 100–120 ° C с трифторидом и пентафторидом.
Тетрафториды иридия, платины, палладия и родия имеют одну и ту же структуру, которая не была известна до 1975 года. Они имеют октаэдрически координированные атомы металлов с четырьмя общими и двумя неподеленными фторами. Точки плавления, если они известны, ниже 300 °C.
Тетрафторид марганца — нестабильное твердое вещество, разлагающееся даже при комнатной температуре. [62] Из двух аллотропов только один, α-MnF 4 известен . В этом соединении марганец образует октаэдры –MnF 6 –, которые разделяют мостиковые фторы, образуя кольца –Mn 4 F 20 –, которые затем дополнительно соединяются в трех измерениях. [63]
| Некоторые тетрафторидные структуры | ||
 |  |  |
| ZrF 4 , обычная тетрафторидная структура. | Полимерная структура SnF 4 | –Mn 4 F 20 – кольцо MnF 4 |
Фториды металлов с высокой степенью окисления
[ редактировать ]Пента- и высшие фториды металлов являются молекулярными и, следовательно, по крайней мере в некоторой степени летучими.
Ванадий , ниобий и тантал образуют пентафториды как их нейтральный фторид с самым высоким зарядом. Пентафторид ванадия — единственный нелетучий высокозарядный фторид металла, при этом ванадий является центром –VF 6 – октаэдров. Пентафториды ниобия и тантала имеют в своей структуре одинаковые тетраэдры, с той разницей, что они образуют тетра- (а не полимерные) молекулы. [64]
Самый высокий фторид висмута представляет собой летучую пента-форму, которая является мощным фторирующим агентом. В твердом состоянии он полимерен, состоит из линейных цепочек октаэдров, разделяющих аксиальные фториды. Пятивалентный висмут в сочетании с щелочными металлами может образовывать гексафторвисмутат [BiF 6 ] − , при реакции с донором фторида, либо сильным (например, NaF [65] [66] ) или нет (например, XeF 4 [67] ).
Многие металлы, образующие гексафториды, также могут образовывать пентафториды. Например, уран , имеющий хорошо известный гексафторид , также образует две разные пентафторидные структуры . Форма при комнатной температуре (альфа) имеет ту же линейную цепную структуру, что и пентафторид висмута. Как молекулярная (газовая) разновидность UF 5 имеет квадратно-пирамидальную структуру.
| Строение пентафторида висмута (или альфа-урана). | |
| Структура цепи (XF 5 ) n ; Х=Би, У. | Упаковка цепей |
Металлы, которые образуют хорошо изученные гексафториды, включают девять металлов в центре периодической таблицы ( молибден , технеций , рутений , родий , вольфрам , рений , осмий , иридий и платина ), а также элементы 92–94: уран , нептуний и плутоний . При комнатной температуре гексафторид вольфрама представляет собой газ. Гексафторид молибдена и гексафторид рения являются жидкостями. Остальное — летучие твердые вещества.

металлов Гексафториды являются окислителями из-за их склонности к выделению фтора: например, гексафторид платины был первым соединением, окисляющим молекулярный кислород. [68] и ксенон. [69] Полоний также образует гексафторид , но он недостаточно изучен. [70]
Рений — единственный металл, который, как известно, связывается с семью фторидами , что является рекордом по количеству заряженных лигандов для соединения металла с нейтральным зарядом. [71] Гептафторид рения имеет молекулярную геометрию пятиугольной бипирамиды . Расчеты показывают, что неизвестный в настоящее время, но, возможно, возможный гептафторид иридия [72] (отчет об обобщении готовится [73] ), гептафторид технеция, [74] и гептафторид осмия [75] также будет иметь эту структуру.
Впервые об октафториде осмия было сообщено в 1913 году, но в 1958 году было показано, что это соединение на самом деле представляет собой гексафторид осмия. [76] Теоретическое исследование 1993 года предсказало очень слабые связи в октафториде осмия и показало, что их будет трудно когда-либо обнаружить экспериментально. Исследование предсказало, что в случае его создания OsF 8 будет иметь связи Os–F двух разных длин. [77]

Фториды неметаллов
[ редактировать ]Бинарные фториды неметаллов являются летучими соединениями. Они показывают большую разницу между периодом 2 и другими фторидами. Например, элементов периода 2 фториды никогда не превышают октет в своих атомах. ( Бор является исключением из-за его специфического положения в периодической таблице.) Однако элементы с более низким периодом могут образовывать гипервалентные молекулы , такие как пентафторид фосфора или гексафторид серы . [78] Реакционная способность таких веществ сильно различается - гексафторид серы инертен, а трифторид хлора чрезвычайно реакционноспособен, - но есть некоторые тенденции, основанные на расположении таблицы Менделеева.
Трифторид бора представляет собой плоскую молекулу. Он имеет только шесть электронов вокруг центрального атома бора (и, следовательно, неполный октет), но он легко принимает основание Льюиса , образуя аддукты с молекулами или ионами, содержащими неподеленную пару, такими как аммиак или другой ион фтора, который может отдать еще два электрона. для завершения октета. [79] Монофторид бора — необычная молекула с более высокой связью BF. Порядок связи описан как 1,4 (промежуточный между одинарной и двойной связью). Он изоэлектронен N 2 . [80]

Тетрафторид кремния , подобно тетрафториду углерода и тетрафториду германия , имеет молекулярную тетраэдрическую структуру. [81] SiF 4 устойчив к нагреванию и электрической искре, но реагирует с водой (даже с влажным воздухом), металлами и щелочами, проявляя при этом слабый кислотный характер. [82] Реакции с магнийорганическими соединениями, спиртами, аминами и аммиаком дают аддуктивные соединения. [82] Кремнефтористоводородная кислота , производное SiF 4 , в водном растворе является сильной кислотой (безводная форма не существует). [83]
Пниктогены (столбец таблицы Менделеева азота) демонстрируют очень схожие тенденции в реакционной способности и кислотности высших фторидов (пентафторидов) и наиболее распространенных (трифторидов), причем указанное свойство увеличивается по группе: NF 3 устойчив к гидролизу, [84] PF 3 очень медленно гидролизуется во влажном воздухе. [85] тогда как AsF 3 полностью гидролизуется. [84] SbF 3 гидролизуется лишь частично из-за усиления ионного характера связи с фтором. Соединения представляют собой слабые основания Льюиса, за NF 3 . исключением [84] Пентафториды фосфора [85] и мышьяк [86] гораздо более реакционноспособны, чем их трифториды; Пентафторид сурьмы является настолько сильной кислотой, что удерживает титул сильнейшей кислоты Льюиса. [86] Неизвестно, что азот образует пентафторид , хотя катион тетрафтораммония ( NF +
4 ) содержит азот в формальной степени окисления +5. [87] Монофторид азота является метастабильным веществом, которое наблюдалось в лазерных исследованиях. Он изоэлектронен O 2 и, что необычно, как и BF, имеет более высокий порядок связи, чем фтор с одинарной связью. [2] [88]

Халькогены . (столбец таблицы Менделеева кислорода) в чем-то похожи: тетрафториды S, Se и Te гидролизуются и являются кислыми по Льюису Тетрафториды серы и селена являются молекулярными, а TeF 4 — полимером. [89] Гексафториды являются результатом прямого фторирования элементов (сравните: других гексагалогенидов этих элементов даже не существует). Их реакционная способность увеличивается с увеличением атомного номера: SF 6 чрезвычайно инертен, SeF 6 менее благороден (например, реагирует с аммиаком при 200 °C (400 °F)), а TeF 6 легко гидролизуется с образованием оксокислоты. [89] Самый высокий фторид кислорода - это дифторид кислорода, [89] но фтор теоретически (по состоянию на 2012 год) может окислить его до уникально высокой степени окисления +4 во фторкатионе: OF. +
3 . [90] Кроме того, встречаются несколько фторидов халькогенов, которые содержат более одного халькогена (O 2 F 2 , [91] С 2 Ф 10 , [92] и т. д.).
Хорошо изученные более тяжелые галогены (хлор, бром и йод) образуют моно-, три- и пентафториды: XF, XF 3 и XF 5 . Из нейтральных +7 разновидностей только гептафторид йода . известен [93] Хотя гептафториды хлора и брома неизвестны, соответствующие катионы ClF +
6 и БрФ +
6 , являются чрезвычайно сильными окислителями. [94] Астат недостаточно изучен, и хотя есть сообщения о нелетучем монофториде астата, [95] его существование обсуждается. [96] Многие из фторидов галогенов являются мощными фтораторами. Особого внимания заслуживает трифторид хлора — он легко фторирует асбест и тугоплавкие оксиды — и может быть даже более реакционноспособным, чем пентафторид хлора . При промышленном использовании ClF 3 требует особых мер предосторожности, аналогичных мерам предосторожности в отношении газообразного фтора, из-за его коррозионной активности и опасности для человека. [97] [98]
Суперкислоты
[ редактировать ]Некоторые важные неорганические кислоты содержат фтор. Обычно они очень прочные из-за высокой электроотрицательности фтора. Одна из таких кислот, фторсурьмяная кислота (HSbF 6 ), является самой сильной из известных кислот с нейтральным зарядом. [30] Дисперсия заряда на анионе влияет на кислотность сольватированного протона (в виде H
22F +
): Соединение имеет чрезвычайно низкий pK a, равный -28, и составляет 10 квадриллионов (10 16 ) раз сильнее, чем чистая серная кислота. [30] Фторантимоновая кислота настолько сильна, что протонирует инертные соединения, такие как углеводороды. Американский химик венгерского происхождения Джордж Ола получил Нобелевскую премию по химии 1994 года за исследование таких реакций. [99]
Соединения благородных газов
[ редактировать ]Благородные газы обычно нереакционноспособны, поскольку они заполнили электронные оболочки. До 1960-х годов о химической связи с благородным газом не было известно. В 1962 году Нил Бартлетт обнаружил, что гексафторид платины реагирует с ксеноном. Он назвал полученное им соединение ксенона гексафторплатинатом , но с тех пор выяснилось, что продукт представляет собой смесь, возможно, монофтороксенил(II) пентафторплатината, [XeF] + [ПтФ 5 ] − , монофтороксенил(II)ундекафтордиплатинат, [XeF] + [Часть 2 F 11 ] − и трифтордиксенил(II) гексафторплатинат, [Xe 2 F 3 ] + [ПтФ 6 ] − . [100] Фторирование ксенона, проведенное Бартлеттом, получило высокую оценку. [101] Позже, в 1962 году, было обнаружено, что ксенон напрямую реагирует с фтором с образованием ди- и тетрафторидов. С тех пор сообщалось о других фторидах благородных газов.

Бинарные соединения ксенона включают дифторид ксенона , тетрафторид ксенона и гексафторид ксенона . [102] Ксенон образует несколько оксифторидов, таких как оксидифторид ксенона, XeOF 2 , при гидролизе тетрафторида ксенона. [103] Его более легкий сосед криптон также образует хорошо изученные соединения, например дифторид криптона . Тетрафторид криптона был обнаружен в 1963 году. [104] но впоследствии выяснилось, что это была ошибочная идентификация; сейчас это соединение, по-видимому, очень сложно синтезировать (хотя даже гексафторид может существовать). [105]
В соответствии с периодическими тенденциями радон более активен по отношению к фтору. дифторид радона . Заявлен [95] Более легкие благородные газы (от гелия до аргона) не образуют стабильных бинарных фторидов.
Высшие степени окисления: фтор по сравнению с кислородом
[ редактировать ]| Самый высокий уровень фторида и оксида рутения | |
 | 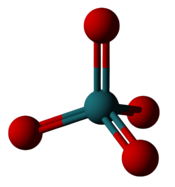 |
| Гексафторид рутения : шесть фторов окружают рутений, но имеют степень окисления только +6. | Четырехокись рутения : четыре атома кислорода окружают рутений, образуя степень окисления +8. |
Элементы часто имеют высшую степень окисления в форме бинарного фторида. Некоторые элементы проявляют свою высшую степень окисления только в нескольких соединениях, одним из которых является фторид; а высшая известная степень окисления некоторых элементов наблюдается исключительно во фториде.
Для групп 1–5, 13–16 (кроме азота) высшие степени окисления оксидов и фторидов всегда равны. Различия наблюдаются только по хрому, группам 7–10, меди, ртути и благородным газам. Фторирование позволяет некоторым элементам достигать относительно низких [примечание 4] высшие степени окисления, которых иначе трудно достичь. Например, для криптона не известен бинарный оксид, но дифторид криптона хорошо изучен. [106] В то же время для некоторых других элементов определенные очень высокие степени окисления известны только для соединений на основе кислорода, но не для соединений на основе фтора. Для ранее упомянутых летучих оксидов нет соответствующих гепта- или октафторидов, за исключением рения. (Например, октафторид рутения вряд ли когда-либо будет синтезирован, [107] даже а тетраоксид рутения нашел промышленное применение. [108] ) Основная проблема, мешающая фтору образовывать высшие состояния в ковалентных гепта- и октафторидах, состоит в том, что вокруг одного атома трудно присоединить такое большое количество лигандов; в аналогичных оксидах число лигандов уменьшено вдвое. [109] [примечание 5] Однако октафторид-анионы, такие как октафториодат ( IF −
8 ), октафторцирконат ( ZrF 4−
8 ) и октафтороксенат ( XeF 2−
8 ) анионы хорошо известны.
Высшие степени окисления могут быть необычны для повседневной жизни или даже промышленного использования. Например, синтез тетрафторида ртути , первого соединения, достигшего степени окисления выше +2 для элемента группы 12 , разрывает заполненную 5d-оболочку, снова показывая значимость релятивистских эффектов на тяжелые элементы и разжигая дискуссию. о том, являются ли ртуть , кадмий и цинк переходными металлами, [110] происходит при криогенных температурах, а соединение разлагается при температуре твердого азота. [111] Еще более нестабильный редкий вид кобальта (V), CoF. +
Катион 4 наблюдался только в газовой фазе (без взаимодействия с другими атомами, поэтому не было продемонстрировано стабильности в какой-либо химической среде). [107] Причина существования таких нестабильных видов сложна, но ее можно резюмировать следующим образом на примере гипотетического NF.
Молекула 5 : Согласно современным расчетам, пять атомов фтора и один атом азота теоретически могут располагаться по-разному, например NF
3 и Ф
2 , НФ •
4 и Ф
• , НФ
5 и т. д. НФ
3 + Ф
2 система имеет наименьшую энергию (наиболее устойчивая). Однако, если НФ
5 молекула должна была пройти через высокоэнергетическое переходное состояние, из которого она могла бы распасться на две молекулы. Но поскольку переходное состояние имеет более высокую энергию, чем шестиатомная молекула, необходимо будет добавить разницу энергий, чтобы достичь переходного состояния и, таким образом, обеспечить распад. Эта энергия называется барьером активации реакции. (Второй режим распада имеет аналогичное положение.) Таким образом, если было добавлено мало энергии (низкие температуры), то соединение могло бы существовать; однако синтез представляет собой серьезную проблему (еще не решенную). [112]
Фтор оксокислоты
[ редактировать ]С фтором очень трудно образовать оксокислоты из-за того, что на присоединение каждого дополнительного атома кислорода к фтору потребуется много энергии на моль из-за его исключительной электроотрицательности.
Единственная известная оксокислота фтора — гипофтористая кислота ( HOF ). При температуре ниже -117°C он выглядит как белое твердое вещество и бледно-желтая жидкость при температуре выше этой температуры. HOF сам по себе стабилен только до 0 ° C и быстро разлагается при температуре выше этой, становясь взрывоопасным при комнатной температуре. Несмотря на то, что HOF часто встречается в качестве кратковременного промежуточного продукта при окислении воды фтором, его все же можно стабильно изолировать в виде твердого вещества, и это единственная гипогалоидная кислота, которая, как известно, способна это делать. Сопряженное с ним основание - анион гипофторита ( OF −
), могут образовывать определенные стабильные соединения, такие как гипофторит лития ( LiOF ) и трифторметилгипофторит ( CF
3 ИЗ ).
плавиковая кислота ( HFO
2 ), плавиковая кислота ( HFO
3 ) и перфтористая кислота ( HFO
4 ) определены как гораздо более нестабильные, чем гипофтористая кислота, и до сих пор не обнаружены.
Фторорганические соединения
[ редактировать ]Химическая связь углерод -фтор фторорганических соединений является самой прочной связью в органической химии. [113] Наряду с низкой поляризуемостью молекул это важнейшие факторы, способствующие высокой стабильности фторорганических соединений. [114]
Связь углерод-фтор в более мелких молекулах образуется тремя основными способами: фтор заменяет галоген или водород или присоединяется через кратную связь. Прямая реакция углеводородов с газообразным фтором может быть опасной реактивностью, поэтому, возможно, придется понизить температуру даже до -150 ° C (-240 ° F). [115] «Твердые носители фтора», соединения, которые могут выделять фтор при нагревании, особенно трифторид кобальта . [116] Вместо него можно использовать фтористый водород. После реакции размер молекул существенно не меняется, так как элементы имеют очень близкие радиусы Ван-дер-Ваальса. [114] Прямое фторирование становится еще менее важным, когда речь идет о реакциях галогенорганических соединений или ненасыщенных соединений, или когда перфторуглерод требуется электролиз на основе HF ). (тогда обычно используется [117] Напротив, фторполимеры образуются в результате полимеризации свободных радикалов; другие методы, используемые для углеводородных полимеров, не работают с фтором таким образом. [118]
Диапазон фторорганических соединений разнообразен, что отражает присущую органической химии сложность . Существует огромное количество малых молекул с различной степенью замещения фтора, а также множество полимеров — исследования в конкретных областях обусловлены коммерческой ценностью их применения. [119]
 | 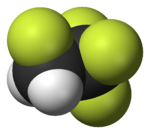 | 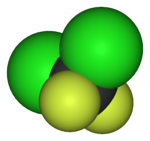 |  | 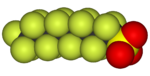 |  |
|---|---|---|---|---|---|
| Фторметан (метил фторид), используемый в обработка полупроводников | 1,1,1,2-Тетрафторэтан (R-134a), ГФУ | Дихлордифторметан (хладагент R-12), ХФУ | Трифторметансульфокислота кислота (трифликовая кислота), суперкислота | Перфтороктансульфокислота кислота , фторсодержащее поверхностно-активное вещество (изображен анион) | Раздел политетрафторэтилен (Тефлон) полимер |
Малые молекулы
[ редактировать ]Монофторалканы (алканы, в которых один водород заменен на фтор) могут быть химически и термически нестабильными, но растворимы во многих растворителях; но по мере того, как вместо водорода появляется больше фтора, стабильность увеличивается, а температуры плавления и кипения, а также растворимость уменьшаются. По мере увеличения плотности и вязкости диэлектрическая проницаемость, поверхностное натяжение и показатели преломления падают. [120]
Частично фторированные алканы представляют собой гидрофторуглероды (ГФУ). Замещение других галогенов в сочетании с фтором приводит к образованию хлорфторуглеродов ( ХФУ) или бромфторуглеродов (БФУ) и т.п. (если сохраняется некоторое количество водорода, ГХФУ и т.п.). Свойства зависят от количества и идентичности атомов галогена. В общем, температура кипения еще больше повышается при сочетании атомов галогенов, поскольку различные размеры и заряды разных галогенов обеспечивают большее межмолекулярное притяжение. [121] Как и фторуглероды, хлорфторуглероды и бромфторуглероды не являются огнеопасными: они не имеют углеродно-водородных связей , которые могут вступать в реакцию, и выделяющиеся галогениды тушат пламя. [121]

Когда все атомы водорода заменяются фтором для получения перфторалканов, обнаруживается большая разница. Такие соединения чрезвычайно стабильны, и только натрий в жидком аммиаке атакует их в стандартных условиях. Они также очень нерастворимы, и лишь немногие органические растворители способны их растворить. [120]
Однако, если перфторуглерод содержит двойные или тройные связи (перфторалкены или -алкины ) , он очень реагирует на принятие лиганда и даже менее стабилен, чем соответствующие углеводороды. [122] Дифторацетилен , который разлагается даже при жидкого азота . температуре [123] является ярким примером. Если такая молекула асимметрична, то атаке подвергается более фторированный углерод, так как он удерживает положительный заряд, обусловленный связями C–F, и слабо экранируется. [122] (аналогично тому, как ненасыщенные углеводороды, атакованные HF, присоединяют водород к более богатому водородом атому по правилу Марковникова [124] ).
Перфторированные соединения , в отличие от перфторуглеродов, — это термин, используемый для молекул, которые могут быть перфторуглеродами — только атомы углерода и фтора — за исключением наличия дополнительной функциональной группы (хотя существует другое определение). [125] ). Они обладают большинством свойств перфторуглеродов (инертность, стабильность, несмачиваемость и нерастворимость в воде и маслах, скользкость и т. д.), [126] но может отличаться из-за свойств функциональных групп, хотя перфторуглеродный хвост отличается по свойствам, специфичным для группы, по сравнению со свойствами соединений с углеводородным хвостом.
Перфторалкансульфоновые кислоты также очень отличаются своей кислотностью. Производное сульфоновой кислоты, трифторметансульфоновая кислота , по силе сравнимо с хлорной кислотой . [127] Эти соединения снижают поверхностную энергию; по этой причине они, особенно перфтороктансульфоновая кислота (ПФОС, ранее являвшаяся активным компонентом марки Scotchgard), нашли промышленное применение в качестве поверхностно-активных веществ. [127]
Если перфторированное соединение имеет фторированный хвост, а также несколько нефторированных атомов углерода (обычно два) рядом с функциональной группой, его называют фтортеломером ( такие молекулы коммерчески рассматриваются как перфторированные), но такие молекулы имеют большую промышленную ценность, чем хим. Конец цепи аналогичным образом может быть присоединен к различным функциональным группам (через гидрированный концевой углерод), таким как гидроксил, приводящий к образованию фтортеломерных спиртов, сульфонат, приводящий к образованию фтортеломерных сульфонатов, и т. д. [126]
Полимеры
[ редактировать ]Фторполимеры во многом схожи с молекулами меньшего размера; добавление фтора в полимер влияет на свойства так же, как и в малые молекулы (повышение химической стабильности, температуры плавления, снижение горючести, растворимости и т. д.). Однако каждый фторполимер имеет свои характерные свойства. [118]
Простейшим фторопластом является политетрафторэтилен (ПТФЭ, тефлон марки DuPont), который представляет собой простой линейно-цепной полимер с повторяющейся структурной единицей : –CF 2 –. Основа ПТФЭ состоит из одинарных углеродных связей в длинной цепи, причем все боковые связи связаны с фтором. Он не содержит атомов водорода и может рассматриваться как перфторированный аналог полиэтилена (структурная единица: –CH 2 –). ПТФЭ обладает высокой химической и термической стабильностью, как и ожидалось от перфторуглерода, намного прочнее, чем полиэтилен. Его устойчивость к силам Ван-дер-Ваальса делает ПТФЭ единственной известной поверхностью, к которой геккон не может прилипнуть. [128] Соединение, однако, лишено способности трансформироваться при плавлении, что не является проблемой для различных производных ПТФЭ, а именно FEP ( фторированный этиленпропилен , с некоторыми фторами, замененными на группу –CF 3 ) или PFA ( перфторалкокси , некоторые фторы заменены на группу –CF 3 ). –OCF 3 ). Они разделяют большинство свойств с ПТФЭ, но все же есть различия, а именно максимальная температура использования (самая высокая для негибкого ПТФЭ). [129]
Существуют и другие фторопласты, кроме перфторированных. Поливинилиденфторид (ПВДФ, структурная единица: –CF 2 CH 2 –), является аналогом ПТФЭ с вдвое меньшим содержанием фтора. ПВФ ( поливинилфторид , структурная единица: –CH 2 CHF–) содержит четверть фтора по сравнению с ПТФЭ. Несмотря на это, он все же обладает многими свойствами более фторированных соединений. [130] ПХТФЭ ( полихлортрифторэтилен , структурная единица: –CF 2 CFCl–) – еще одно важное соединение. Он отличается от ПТФЭ тем, что четверть фтора заменена хлором, однако это отличие обеспечивает еще большую твердость, сопротивление ползучести и стойкость к влаге. [130]
Умеренное фторирование полиэтилена не приводит к тому, что весь пластик теряет водород в пользу фтора; При этом воздействует только тонкий слой (максимум 0,01 мм). Это чем-то похоже на пассивацию металла: объемные свойства не затрагиваются, но свойства поверхности, в первую очередь, обеспечивают большую пароизоляцию . Таким образом, они являются более дешевой альтернативой перфторопластам, если важна только поверхность. [131]

Нафион – структурно сложный полимер. Он имеет PTFE-подобную основную цепь, но также содержит боковые цепи перфторэфира, которые заканчиваются группами сульфоновой кислоты (–SO 2 OH). Он также обладает большой химической стабильностью, хотя точные свойства зависят от морфологии. Однако из-за сложной химической структуры его также относительно легко превратить в иономер (проявляет проводимость) путем добавления катионов, таких как Na. + или путем превращения в сульфоновую кислоту, а не в данный сульфонилфторид. Проводимость обусловлена тем, что основная углеродная цепь отделяется от боковых цепей, образуя полярные и неполярные области. Эта форма также очень гигроскопична. [132]
Фторэластомеры, как и другие эластомеры (искусственные каучуки), состоят из неупорядоченных полимерных цепей, соединенных в трех измерениях. Основными проблемами при производстве фторэластомеров являются сшивка (реакция нереакционноспособных полимеров), а также удаление HF, образующегося во время отверждения . Существует три основных семейства фторэластеров. ВДФ/ГФП представляет собой сополимерную систему винилиденфторида и (не менее 20%) гексафторпропилена. ТФЭ/пропилен — еще одна копимерная система с лучшей химической стойкостью к некоторым растворителям. ТФЭ/ПМВЭ (перфторметилвиниловый эфир) представляет собой сополимерную систему, образующую перфторированный фторэластомер. [133]
См. также
[ редактировать ]Примечания
[ редактировать ]- ^ В этой статье металлоиды не рассматриваются отдельно от металлов и неметаллов, но среди элементов они ближе к ним. Например, германий считается металлом, а кремний — неметаллом. Сурьма включена для сравнения среди неметаллов, хотя по химическому составу она ближе к металлам, чем к неметаллам. Благородные газы рассматриваются отдельно от неметаллов ; Водород обсуждается в разделе «Фтороводород» , а углерод — в разделе «Органические соединения» . P-блока Элементы периода 7 не изучались и поэтому не включены.
- ^ Меньшие цифры означают большую кислотность; Обратите внимание, что масштаб логарифмический.
- ^ Более подробное объяснение см. В цитировании. [37]
- ^ Не существует общей линии, в которой степени окисления являются «относительно низкими» или «относительно высокими», они зависят от конкретных элементов (и определяются только для элементов с наибольшим количеством оксидов и фторидов, находящихся в разных степенях окисления); в целом +7 и +8 — высокие, а +4 и ниже — низкие. Состояния +5 и +6 зависят от свойств элемента, таких как атомный радиус; для маленького атома азота +5 здесь «высоко», но для более крупных палладия и платины +6 все еще «низко».
- ^ Отметим, что, кроме молекулярной, другие формы высших фторидов не считаются возможными. Крайне маловероятно, что такие соединения будут полностью ионными из-за больших энергий шестого, седьмого и восьмого окисления всех элементов, что делает реакции, которые могут привести к образованию таких соединений, крайне неблагоприятными (хотя возможный октафторид осмия может быть в основном ионным). [77] ).
Цитаты
[ редактировать ]- ^ Кальдераццо, Фаусто (2010). «Галоид-мостиковые полимеры двухвалентных металлов с донорными лигандами – Структура и свойства» . Обзоры координационной химии . 254 (5–6): 537–554. дои : 10.1016/j.ccr.2009.08.007 .
- ^ Перейти обратно: а б Харбисон, GS (2002). «Электрическая дипольная полярность основного и низколежащие метастабильные возбужденные состояния НФ». Журнал Американского химического общества . 124 (3): 366–367. дои : 10.1021/ja0159261 . ПМИД 11792193 .
- ^ Смарт, Брюс Э.; Татлоу, Дж. К. (1994). Фторорганическая химия: принципы и коммерческое применение . Спрингер. п. 515. ИСБН 978-0306446108 .
- ^ Ридель, С.; Каупп, М. (2009). «Высшие состояния окисления элементов переходных металлов». Обзоры координационной химии . 253 (5–6): 606–624. дои : 10.1016/j.ccr.2008.07.014 .
- ^ Ченг, Х.; Фаулер, Делавэр; Хендерсон, ПБ; Хоббс, JP; Паскалони, MR (1999). «О магнитной восприимчивости фтора». Журнал физической химии А. 103 (15): 2861–2866. Бибкод : 1999JPCA..103.2861C . дои : 10.1021/jp9844720 .
- ^ Маккей, Маккей и Хендерсон 2002 , с. 72.
- ^ Перейти обратно: а б Гринвуд и Эрншоу 1998 , с. 804.
- ^ Макомбер, Роджер С. (1996). Органическая химия . Том. 1. Университетские научные книги. п. 230. ИСБН 978-0-935702-90-3 . Проверено 26 июля 2011 г.
- ^ Гемат РАН (2009). Вода . Том. 42. Уротекст. стр. 707–709. ISBN 9781903737125 .
- ^ Перейти обратно: а б Гринвуд и Эрншоу 1998 , с. 801.
- ^ Перейти обратно: а б Akhmetov, N. S. (2001). Общая и неорганическая химия [ Общая и неорганическая химия ] (на русском языке) (4-е изд.). Академик [Академик]. п. 317. ИСБН 978-5-06-003363-2 .
- ^ Жакко и др. 2005 , с. 2.
- ^ Нельсон, Юджин В. (1947). « Плохой человек стихий» . Популярная механика . 88 (2): 106–108, 260.
- ^ Лидин, Молочко и Андреева 2000 , стр. 442–455.
- ^ Гринвуд и Эрншоу 1998 , стр. 844.
- ^ Жакко и др. 2005 , с. 3.
- ^ Питцер, Кеннет С. (1975). «Фториды радона и элемента 118» . Журнал Химического общества, Chemical Communications (18): 760b–761. дои : 10.1039/C3975000760B .
- ^ Хрящев Леонид; Петтерссон, Мика; Рунеберг, Нино; Лунделл, Ян; Рясянен, Маркку (2000). «Стабильное соединение аргона». Природа . 406 (6798): 874–876. Бибкод : 2000Natur.406..874K . дои : 10.1038/35022551 . ПМИД 10972285 . S2CID 4382128 .
- ^ Lidin, Molochko & Andreeva 2000 , p. 252.
- ^ Мур, Джон В.; Станицкий, Конрад Л.; Юрс, Питер К. (2010). Основы химии: Молекулярная наука . Cengage Обучение. п. 156. ИСБН 978-0-495-39079-4 . Проверено 7 мая 2011 г.
- ^ Wiberg, Wiberg & Holleman 2001 , с. 422.
- ^ Альбертини, Симон; Бергмейстер, Стефан; Лаймер, Феликс; Мартини, Пол; Грубер, Элизабет; Заппа, Фабио; Ончак, Милан; Шайер, Пол; Эхт, Олоф (22 апреля 2021 г.). «SF 6 +: Стабилизация переходных ионов в нанокаплях гелия» . Журнал физической химии . 12 (17): 4112–4117. doi : 10.1021/acs.jpclett.1c01024 . ISSN 1948-7185 . ПМЦ 8154854 . ПМИД 33886323 .
- ^ Шлёдер, Т.; Ридель, С. (2012). «Исследование гетеродимерных и гомодимерных катион-радикалов ряда: [F 2 O 2 ] + , [F 2 Cl 2 ] + , [Cl 2 O 2 ] + , [Ф 4 ] + и [Cl 4 ] + ". RSC Advances . 2 (3): 876–881. Bibcode : 2012RSCAd...2..876S . doi : 10.1039/C1RA00804H .
- ^ Янг, JP; Хайре, Р.Г.; Петерсон-младший; Энсор, Д.Д.; Товарищ, РЛ (1981). «Химические последствия радиоактивного распада. 2. Спектрофотометрическое исследование врастания берклия-249 и калифорния-249 в галогениды эйнштейния-253». Неорганическая химия . 20 (11): 3979–3983. дои : 10.1021/ic50225a076 .
- ^ Хулет, ЭК (1967). «Менделевий: двухвалентность и другие химические свойства». Наука . 158 (3800): 486–8. Бибкод : 1967Sci...158..486H . дои : 10.1126/science.158.3800.486 . ПМИД 17749069 . S2CID 19645593 .
- ^ Крац, СП (2003). «Критическая оценка химических свойств трансактинидных элементов (Технический отчет ИЮПАК)» . Чистая и прикладная химия . 75 (1): 103. doi : 10.1351/pac200375010103 . S2CID 5172663 .
- ^ Кан, Бернд (2007). Радиоаналитическая химия . ISBN 978-0-387-34122-4 . Проверено 4 мая 2011 г.
- ^ Зигемунд и др. 2005 , с. 29.
- ^ «Кислоты и основания» . Askthenerd.com. 2011 . Проверено 18 августа 2012 г.
- ^ Перейти обратно: а б с Ола, Джордж А. (2005). «Переходя условные границы за полвека исследований». Журнал органической химии . 70 (7): 2413–2429. дои : 10.1021/jo040285o . ПМИД 15787527 .
- ^ Хван, IC; Зеппельт, К. (2001). «Пентафторид золота: структура и сродство к фторид-ионам. Эта работа была поддержана Немецким исследовательским фондом и Fond der Chemischen Industrie». Международное издание «Прикладная химия» . 40 (19): 3690–3693. doi : 10.1002/1521-3773(20011001)40:19<3690::AID-ANIE3690>3.0.CO;2-5 . ПМИД 11592224 .
- ^ Полинг, Лайнус А. (1960). Природа химической связи и строение молекул и кристаллов: Введение в современную структурную химию . Издательство Корнельского университета. стр. 454–464 . ISBN 978-0-8014-0333-0 .
- ^ Аткинс, Питер; Джонс, Лоретта (2008). Химические принципы: поиски понимания . WH Freeman & Co., стр. 184–185. ISBN 978-1-4292-0965-6 .
- ^ Эмсли, Джон (1981). «Скрытая сила водорода» . Новый учёный . 91 (1264): 291–292. Архивировано из оригинала 22 июля 2023 года . Проверено 25 декабря 2012 г.
- ^ Гринвуд и Эрншоу 1998 , стр. 812–816.
- ^ Wiberg, Wiberg & Holleman 2001 , с. 425.
- ^ Кларк, Джим. «Кислотность галогеноводородов» . Проверено 4 сентября 2011 г.
- ^ Перейти обратно: а б Чемберс, К.; Холлидей, АК (1975). Современная неорганическая химия (Промежуточный текст) (PDF) . Группа Баттерворта. стр. 328–329. Архивировано из оригинала (PDF) 23 марта 2013 г. Проверено 3 мая 2013 г.
- ^ Ханнан, Генри Дж. (1975). Справочник технического специалиста по составу промышленных и бытовых чистящих средств . Лулу.com. п. 31. ISBN 9780615156019 .
- ^ Ханнан, Генри Дж. (2010). Курс химии для IIT-JEE 2011 . Тата МакГроу Хилл Образовательная Частная Лимитед. стр. 15–22. ISBN 9780070703360 .
- ^ Гринвуд и Эрншоу 1998 , стр. 816–819.
- ^ Гринвуд и Эрншоу 1998 , стр. 819.
- ^ Как и 2004 г. , стр. 4–76.
- ^ Как и 2004 г. , стр. 4–71.
- ^ Как и 2004 г. , стр. 4–92.
- ^ Окстоби, Дэвид В.; Гиллис, Х. Пэт; Кэмпион, Алан (2012). Принцип современной химии . Cengage Обучение. п. 693. ИСБН 9780840049315 .
- ^ Эгеперс и др. 2005 , «Соединения фтора неорганические», стр. 25–27.
- ^ Перейти обратно: а б с д и Сторер, Фрэнк Хамфрис (1864). Первые очертания словаря растворимости химических веществ . Кембридж. стр. 278–80. ISBN 978-1-176-62256-2 .
- ^ Реми, Генрих (1956). Трактат по неорганической химии: Введение и основные группы таблицы Менделеева . Издательство Эльзевир. п. 383.
- ^ Эмелеус и Шарп 1983 , стр. 256–277.
- ^ Уолш, Кеннет А. (1 января 2009 г.). Химия и обработка бериллия . АСМ Интернешнл. стр. 99–102, 118–119. ISBN 978-0-87170-721-5 .
- ^ Маккей, Маккей и Хендерсон 2002 , с. 243–244.
- ^ Герц, Раймонд К. (1987). «Общая аналитическая химия бериллия» . В Койле, Фрэнсис Т. (ред.). Химический анализ металлов: симпозиум . АСТМ. стр. 74–75. ISBN 978-0-8031-0942-1 .
- ^ ФВБ Эйнштейн; PR Рао; Джеймс Троттер; Нил Бартлетт (1967). «Кристаллическая структура трифторида золота». Журнал Химического общества A: Неорганическое, физическое, теоретическое . 4 : 478–482. дои : 10.1039/J19670000478 .
- ^ Wiberg, Wiberg & Holleman 2001 , с. 1286.
- ^ Wiberg, Wiberg & Holleman 2001 , с. 1047.
- ^ Соболев, Борис Петрович (2001). Трифториды редкоземельных металлов: Введение в материаловедение кристаллов многокомпонентных фторидов металлов . Институт каталонских исследований. п. 51. ИСБН 978-84-7283-610-5 .
- ^ Керн, С.; Хейворд, Дж.; Робертс, С.; Ричардсон, Дж.В.; Ротелла, Ф.Дж.; Содерхольм, Л.; Корт, Б.; Тинкл, М.; Уэст, М.; Хойсингтон, Д.; Ландер, Джорджия (1994). «Температурное изменение структурных параметров в тетрафторидах актинидов» . Журнал химической физики . 101 (11): 9333–9337. Бибкод : 1994ЖЧФ.101.9333К . дои : 10.1063/1.467963 .
- ^ Браун, Пол Л.; Момпеан, Федерико Дж.; Перроне, Джейн; Ильмассен, Мириам (2005). Химическая термодинамика циркония . Профессиональное издательство Персидского залива. п. 144. ИСБН 978-0-444-51803-3 .
- ^ Как и 2004 г. , стр. 4–60, -76, -92, -96.
- ^ Беккер, С.; Мюллер, Б.Г. (1990). «Тетрафториды ванадия». Международное издание «Прикладная химия» на английском языке . 29 (4): 406–407. дои : 10.1002/anie.199004061 .
- ^ Браун, Дэвид; Кантерфорд, Дж. Х.; Колтон, Рэй (2009). Галогениды переходных элементов: Галогениды переходных металлов первого ряда, Р. Колтон и Дж. Х. Кантерфорд . Уайли. п. 213 . Проверено 6 июня 2012 г.
- ^ Накадзим, Цуёси; Жемва, Борис; Трессо, Ален (2009). Усовершенствованные неорганические фториды: синтез, характеристика и применение (1-е изд.). Эльзевир. п. 111 . ISBN 978-0444720023 .
- ^ Эмелеус и Шарп 1983 , с. 105.
- ^ Брюниг, Ханс Иоахим. «Соединения висмута» . Энциклопедия химической технологии Кирка-Отмера, том 4 . Джон Уайли и сыновья. п. 22. Архивировано из оригинала 19 июля 2013 г. Проверено 9 сентября 2017 г.
- ^ Wiberg, Wiberg & Holleman 2001 , с. 770.
- ^ Сузуки, Хитоми; Матано, Ёсихиро (2001). Висмуторганическая химия . Эльзевир. п. 8 . ISBN 978-0-444-20528-5 .
- ^ Бартлетт, Нил; Ломанн, Д.Х. (1962). «Диоксигенил гексафторплатинат (V), O 2 + [ПтФ 6 ] − «. Труды Химического общества (3): 115. doi : 10.1039/PS9620000097 .
- ^ Бартлетт, Нил (1962). «Ксенон гексафторплатинат (V) Xe + [ПтФ 6 ] − «. Труды Химического общества (6): 218. doi : 10.1039/PS9620000197 .
- ^ Wiberg, Wiberg & Holleman 2001 , с. 594.
- ^ Фогт, Т.; Фитч, АН; Кокрофт, Дж. К. (1994). «Кристаллическая и молекулярная структура гептафторида рения». Наука . 263 (5151): 1265–67. Бибкод : 1994Sci...263.1265V . дои : 10.1126/science.263.5151.1265 . ПМИД 17817431 . S2CID 20013073 .
- ^ Баварский университет Юлиуса Максимилиана в Вюрцбурге, 2006 , с. 93.
- ^ Технический университет Берлина (2012). «Прогнозирование новых соединений и новых степеней окисления» . Проверено 24 мая 2012 г.
- ^ Ридель, С.; Каупп, М. (2009). «Высшие степени окисления элементов переходных металлов». Обзоры координационной химии . 253 (5–6): 606–624. дои : 10.1016/j.ccr.2008.07.014 .
- ^ Баварский университет Юлиуса Максимилиана в Вюрцбурге, 2006 , с. 102.
- ^ Вайншток, Бернард; Мальм, Джон Г. (сентябрь 1958 г.). «Гексафторид осмия и его идентичность с ранее описанным октафторидом». Журнал Американского химического общества . 80 (17): 4466–4468. дои : 10.1021/ja01550a007 .
- ^ Перейти обратно: а б Велдкамп, Ахим; Френкинг, Гернот (1993). «Квантово-механическое ab initio исследование соединений переходных металлов OsO 4 , OsO 3 F 2 , OsO 2 F 4 , OsOF 6 и OsF 8 ». Химические отчеты . 126 (6): 1325–1330. дои : 10.1002/cber.19931260609 .
- ^ Нури, Стефан; Сильви, Бернар; Гиллеспи, Рональд Дж. (2002). «Химическая связь в гипервалентных молекулах: актуально ли правило октетов?» (PDF) . Неорганическая химия . 41 (8): 2164–2172. дои : 10.1021/ic011003v . ПМИД 11952370 . Проверено 23 мая 2012 г.
- ^ Гринвуд и Эрншоу 1998 , стр. 198–199.
- ^ Мартини, Р.Дж.; Бултема, Джей Джей; ван дер Валь, Миннесота; Беркхарт, Б.Дж.; ван дер Гринд, окружной прокурор; де Кок, РЛ (2011). «Порядок связи и химические свойства BF, CO и N 2 » (PDF) . Журнал химического образования . 88 (8): 1094–1097. Бибкод : 2011ЖЧЭд..88.1094М . дои : 10.1021/ed100758t .
- ^ Эллис, Брайан Дэвид (2001). Научный эссенциализм . Издательство Кембриджского университета. п. 69. ИСБН 978-0521800945 .
- ^ Перейти обратно: а б Эгеперс и др. 2005 , с. 28.
- ^ Эгеперс и др. 2005 , с. 30.
- ^ Перейти обратно: а б с Рагхаван, PS (1998). Понятия и проблемы неорганической химии . Издательство Дискавери. стр. 164–165. ISBN 9788171414185 .
- ^ Перейти обратно: а б Эгеперс и др. 2005 , с. 37.
- ^ Перейти обратно: а б Норман, Николас К. (1998). Химия мышьяка, сурьмы и висмута . Спрингер. п. 97. ИСБН 978-0751403893 .
- ^ Кристе, КО; Уилсон, WW (1986). «Синтез и характеристика НФ +
4 БрФ −
4 и НФ +
4 БрФ
4 Ох −
". Неорганическая химия . 25 (11): 1904–1906. doi : 10.1021/ic00231a038 . - ^ Дэвис, Стивен Дж.; Роулинз, Уилсон Т.; Пайпер, Лоуренс Г. (1989). «Ставочный коэффициент для H + NF(a 1 Δ) реакция» (PDF) . Журнал физической химии . 93 (3): 1078–1082. doi : 10.1021/j100340a013 .
- ^ Перейти обратно: а б с Мурти, К. Парамешвара (2008). Университет химии, Том 1 . Нью Эйдж Интернэшнл. стр. 180–182, 206–208. ISBN 978-8122407426 .
- ^ Кроуфорд, М.; Клапотке, ТМ (1999). «Катион трифтороксония, OF +
3 ". Журнал химии фтора . 99 (2): 151–156. doi : 10.1016/S0022-1139(99)00139-6 . - ^ Гринвуд и Эрншоу 1998 , стр. 639.
- ^ Гринвуд и Эрншоу 1998 , стр. 686.
- ^ Wiberg, Wiberg & Holleman 2001 , с. 435.
- ^ Wiberg, Wiberg & Holleman 2001 , с. 436.
- ^ Перейти обратно: а б Питцер, Кеннет Сэнборн, изд. (1993). Молекулярная структура и статистическая термодинамика: Избранные статьи Кеннета С. Питцера . Том. 1. Мировая научная. п. 111. ИСБН 978-9810214395 .
- ^ Гмелин, Леопольд (3 июля 1985 г.). Справочник Гмелина по неорганической химии: Ат-Астат (8-е изд.). Издательство Спрингер. п. 224. ИСБН 9783540935162 .
- ^ Гринвуд и Эрншоу 1998 , стр. 828–830.
- ^ Патнаик, Прадьот (2007). Подробный справочник по опасным свойствам химических веществ . Джон Уайли и сыновья. стр. 478–479. ISBN 9780471714583 .
- ^ «Нобелевская премия по химии 1994 года» . nobelprize.org . Проверено 22 декабря 2008 г.
- ^ Wiberg, Wiberg & Holleman 2001 , стр. 392–393.
- ^ Новости химии и техники , цитируется по Майкл Барнс. «Нил Бартлетт, заслуженный профессор химии, умирает в 75 лет» . Отдел новостей Калифорнийского университета. Архивировано из оригинала 22 октября 2011 г. Проверено 24 декабря 2011 г.
- ^ Wiberg, Wiberg & Holleman 2001 , с. 438.
- ^ Wiberg, Wiberg & Holleman 2001 , с. 400.
- ^ Гросс, А.В.; Киршенбаум, А.Д.; Стренг, АГ; Стренг, Л.В. (1963). «Тетрафторид криптона: получение и некоторые свойства». Наука . 139 (3559): 1047–1048. Бибкод : 1963Sci...139.1047G . дои : 10.1126/science.139.3559.1047 . ПМИД 17812982 .
- ^ Диксон, Д.А.; Ван, TH; Грант, диджей; Петерсон, Калифорния; Кристе, КО; Шробильген, Г.Дж. (2007). «Теплообразование фторидов криптона и прогнозы стабильности KrF 4 и KrF 6 на основе расчетов электронной структуры высокого уровня». Неорганическая химия . 46 (23): 10016–10021. дои : 10.1021/ic701313h . ПМИД 17941630 .
- ^ Wiberg, Wiberg & Holleman 2001 , с. 398.
- ^ Перейти обратно: а б Ридель, С.; Каупп, М. (2009). «Высшие степени окисления элементов переходных металлов». Обзоры координационной химии . 253 (5–6): 606–624. дои : 10.1016/j.ccr.2008.07.014 .
- ^ «Технический паспорт 320 Тетроксид рутения 0,5% водный раствор» (PDF) . Polysciences, Inc. 2000. с. 1. Архивировано из оригинала (PDF) 18 августа 2011 года . Проверено 28 декабря 2012 г.
- ^ Баварский университет Юлиуса Максимилиана в Вюрцбурге, 2006 , с. 34.
- ^ Дженсен, Уильям Б. (2008). «Является ли ртуть теперь переходным элементом?» . Журнал химического образования . 85 (9): 1182–1183. Бибкод : 2008JChEd..85.1182J . дои : 10.1021/ed085p1182 .
- ^ Ван, Сюэфан; Эндрюс, Лестер; Ридель, Себастьян; Каупп, Мартин (2007). «Ртуть — переходный металл: первые экспериментальные доказательства существования HgF 4 ». Ангеванде Хеми . 119 (44): 8523–8527. Бибкод : 2007AngCh.119.8523W . дои : 10.1002/ange.200703710 .
- ^ Льюарс 2008 , стр. 60–61.
- ^ О'Хаган, Д. (2008). «Понимание фторорганической химии. Знакомство со связью C – F». Обзоры химического общества . 37 (2): 308–319. дои : 10.1039/b711844a . ПМИД 18197347 .
- ^ Перейти обратно: а б Зигемунд и др. 2005 , с. 2.
- ^ Зигемунд и др. 2005 , с. 4.
- ^ Жакко и др. 2005 , с. 13.
- ^ Зигемунд и др. 2005 , стр. 3–5.
- ^ Перейти обратно: а б Карлсон и Скмигель 2005 , с. 3.
- ^ Окадое, Такаши (2009). «Обзор истории фторорганической химии с точки зрения материальной промышленности» (PDF) . Труды Японской академии, серия B. 85 (8): 276–289. Бибкод : 2009PJAB...85..276O . дои : 10.2183/pjab.85.276 . ПМЦ 3621566 . ПМИД 19838009 .
- ^ Перейти обратно: а б Зигемунд и др. 2005 , стр. 7–8.
- ^ Перейти обратно: а б Сукорник, Б. (1989). «Потенциально приемлемые заменители хлорфторуглеродов». Международный журнал теплофизики . 10 (3): 553–561. Бибкод : 1989IJT....10..553S . дои : 10.1007/BF00507978 . S2CID 128953494 .
- ^ Перейти обратно: а б Зигемунд и др. 2005 , с. 18.
- ^ Урбен, Питер (2006). Справочник Бретерика по реактивным химическим опасностям (7-е изд.). Сурендра Кумар. п. 269. ИСБН 9780123725639 .
- ^ Зигемунд и др. 2005 , с. 5.
- ^ Мендичино, Л. (1999). Экологические проблемы в электронной и полупроводниковой промышленности . Электрохимическое общество. п. 116. ИСБН 9781566772303 .
- ^ Перейти обратно: а б Неппер, Томас П.; Ланге, Фрэнк Т. (2011). Полифторированные химикаты и продукты трансформации . Спрингер. п. 27 . ISBN 9783642218712 .
- ^ Перейти обратно: а б Зигемунд и др. 2005 , с. 32.
- ^ Калифорнийский университет в Беркли . «Исследование адгезии гекконов» . Архивировано из оригинала 14 октября 2007 года . Проверено 29 апреля 2011 г.
- ^ Карлсон и Скмигель 2005 , стр. 3–4.
- ^ Перейти обратно: а б Карлсон и Скмигель 2005 , с. 4.
- ^ Харитонов А.П.; Тэге, Р.; Ферье, Г.; Пивень, Н.П. (2005). «Кинетика и механизм прямого фторирования полиэтиленов» (PDF) . Surface Coatings International Часть B: Операции с покрытиями . 88 (3): 201–212. дои : 10.1007/BF02699574 . S2CID 94554719 . Архивировано из оригинала (PDF) 15 мая 2013 г. Проверено 3 мая 2013 г.
- ^ Роудс, Дэвид Уолтер (2008). Исследование нафиона широкополосной диэлектрической спектроскопией . п. 2. ISBN 9780549785408 .
- ^ Мартин, Джон Уилсон (2007). Краткая энциклопедия строения материалов . Эльзевир. стр. 187–194. ISBN 978-0-08-045127-5 .
Индексированные ссылки
[ редактировать ]- Баварский университет Юлиуса Максимилиана в Вюрцбурге (2006 г.). Высшие состояния окисления 5d-переходных металлов: квантово-химическое исследование (PDF) (Отчет). Химическое общество . Проверено 20 июня 2011 г.
- Эмелеус, HJ; Шарп, АГ (1983). Достижения неорганической химии и радиохимии (27-е изд.). Академическая пресса. ISBN 978-0-12-023627-5 .
- Гринвуд, штат Нью-Йорк; Эрншоу, А. (1998). Химия элементов (2-е изд.). Баттерворт Хайнеманн. ISBN 978-0-7506-3365-9 .
- Льюарс, Эррол Г. (2008). Чудеса моделирования: вычислительное ожидание появления новых молекул . Спрингер. ISBN 978-1-4020-6972-7 .
- Лиде, Дэвид Р. (2004). Справочник по химии и физике (84-е изд.). ЦРК Пресс. ISBN 978-0-8493-0566-5 .
- Lidin, P. A.; Molochko, V. A.; Andreeva, L. L. (2000). Химические свойства неорганических веществ [ Химические свойства неорганических веществ ] (на русском языке). Химия. ISBN 978-5-7245-1163-6 .
- Маккей, Кеннет Малкольм; Маккей, Розмари Энн; Хендерсон, В. (2002). Введение в современную неорганическую химию (6-е изд.). ЦРК Пресс. ISBN 978-0-7487-6420-4 .
- Ульманн, Франц, изд. (2005). Энциклопедия промышленной химии . Вайли-ВЧ. ISBN 978-3-527-30673-2 .
- Эгеперс, Жан; Моллард, Поль; Девильерс, Дидье; Чемла, Мариус; Фарон, Роберт; Романо, Рене; Куэр, Жан Пьер (2000). «Соединения фтора неорганические». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007 . ISBN 978-3-527-30673-2 .
- Карлсон, Д. Питер; Шмигель, Уолтер (2000). «Фторполимеры органические». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a11_393 . ISBN 978-3527306732 .
- Жакко, Майкл; Фарон, Роберт; Девильерс, Дидье; Романо, Рене (2000). "Фтор". Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a11_293 . ISBN 978-3527306732 .
- Зигемунд, GN; Швертфегер, В.; Фейринг, А.; Смарт, Б.; Бер, Ф.; Фогель, Х.; МакКьюсик, Б. (2000). Соединения фтора органические . Том 15. doi : 10.1002/14356007.a11_349 . ISBN 3527306730 .
- Виберг, Эгон; Виберг, Нильс; Холлеман, Арнольд Фредерик (2001). Неорганическая химия . Академическая пресса. ISBN 978-0-12-352651-9 . Проверено 3 марта 2011 г.
- Йос, Карл Л.; Брейкер, Уильям (2001). "Фтор". Сборник данных по газам Мэтисона, книга 2001 г. МакГроу-Хилл Профессионал . ISBN 978-0-07-135854-5 .



