Соединения урана
Соединения урана — это соединения, образованные элементом ураном ( U). Хотя уран является радиоактивным актинидом , его соединения хорошо изучены из-за его длительного периода полураспада и применения. +4 и +6 Обычно он образуется в степенях окисления , хотя может образовываться и в других степенях окисления.
Степени окисления и оксиды
[ редактировать ]Оксиды
[ редактировать ]Прокаленный желтый кек урана , производимый на многих крупных заводах, содержит различные формы окисления урана в различных формах, от наиболее окисленных до наименее окисленных. Частицы с коротким временем пребывания в декарбонизаторе обычно менее окислены, чем частицы с длительным временем пребывания или частицы, извлеченные в скруббере. Содержание урана обычно обозначается как U.
33О
8 , который относится ко временам Манхэттенского проекта, когда У.
33О
8 использовался в качестве стандарта отчетности по аналитической химии. [1]
Фазовые взаимоотношения в системе уран-кислород сложны. Наиболее важными степенями окисления урана являются уран(IV) и уран(VI), а двумя соответствующими оксидами являются соответственно диоксид урана ( UO
2 ) и триоксид урана ( UO
3 ). [2] Другие оксиды урана, такие как монооксид урана (UO), пентаоксид диурана ( U
22О
5 ) и пероксид урана ( UO
4 · 2ч
2 O ) тоже существуют.
Наиболее распространенными формами оксида урана являются окись триурана ( U
33О
8 ) и УО
2 . [3] Обе формы оксида представляют собой твердые вещества, которые плохо растворяются в воде и относительно стабильны в широком диапазоне условий окружающей среды. Ококсид триурана (в зависимости от условий) является наиболее стабильным соединением урана и является формой, наиболее часто встречающейся в природе. Диоксид урана — это форма, в которой уран чаще всего используется в качестве топлива для ядерных реакторов. [3] При температуре окружающей среды UO
2 постепенно преобразуется в U
33О
8 . Из-за своей стабильности оксиды урана обычно считаются предпочтительной химической формой для хранения или утилизации. [3]
Водная химия
[ редактировать ]
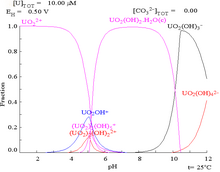
Соли многих степеней окисления урана растворимы в воде и могут быть изучены в водных растворах . Наиболее распространенными ионными формами являются U 3+
(коричнево-красный), У 4+
(зеленый), УО +
2 (нестабильный) и UO 2+
2 (желтый) для U(III), U(IV), U(V) и U(VI) соответственно. [4] Несколько твердых и полуметаллических соединений, таких как UO и US, существуют для формальной степени окисления урана (II), но не известно, что в растворе для этого состояния существуют простые ионы. Ионы U 3+
выделяют водород из воды и поэтому считаются очень нестабильными. УО 2+
Ион 2 представляет состояние урана (VI) и, как известно, образует такие соединения, как уранилкарбонат , уранилхлорид и уранилсульфат . УО 2+
2 также образует комплексы с различными органическими хелатирующими агентами, наиболее часто встречающимся из которых является уранилацетат . [4]
В отличие от ураниловых солей урана и катионных форм многоатомного иона оксида урана, уранаты , соли, содержащие многоатомный анион оксида урана, обычно не растворимы в воде.
Карбонаты
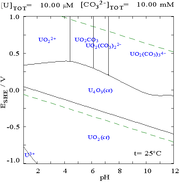
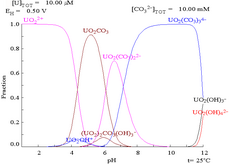
[ редактировать ]Взаимодействие карбонат-анионов с ураном(VI) приводит к сильному изменению диаграммы Пурбе при переходе от воды к раствору, содержащему карбонат. Хотя подавляющее большинство карбонатов нерастворимы в воде (студентов часто учат, что все карбонаты, кроме карбонатов щелочных металлов, нерастворимы в воде), карбонаты урана часто растворимы в воде. Это связано с тем, что катион U(VI) способен связывать два концевых оксида и три или более карбоната с образованием анионных комплексов.
 |  |
| Уран в некомплексующей водной среде (например, хлорная кислота /гидроксид натрия). [5] | Уран в карбонатном растворе |
 |  |
| Относительные концентрации различных химических форм урана в некомплексующей водной среде (например, хлорная кислота /гидроксид натрия). [5] | Относительные концентрации различных химических форм урана в водном растворе карбоната. [5] |
Влияние pH
[ редактировать ]Диаграммы фракций урана в присутствии карбоната иллюстрируют это еще раз: когда pH раствора урана (VI) увеличивается, уран превращается в гидратированный гидроксид оксида урана, а при высоких значениях pH он становится анионным гидроксидным комплексом.
При добавлении карбоната уран превращается в ряд карбонатных комплексов при повышении pH. Одним из последствий этих реакций является повышенная растворимость урана в диапазоне pH от 6 до 8, и этот факт имеет прямое отношение к долгосрочной стабильности отработанного ядерного топлива на основе диоксида урана.
Гидриды, карбиды и нитриды
[ редактировать ]Металлический уран, нагретый до 250–300 °C (от 482 до 572 °F), реагирует с водородом с образованием гидрида урана . Даже более высокие температуры будут обратимо удалять водород. Это свойство делает гидриды урана удобными исходными материалами для создания реактивного уранового порошка наряду с различными карбидами , нитридами и галогенидами урана . [6] Существуют две кристаллические модификации гидрида урана: α-форма, получаемая при низких температурах, и β-форма, возникающая при температуре образования выше 250 °C. [6]
Карбиды и нитриды урана представляют собой относительно инертные полуметаллические соединения, минимально растворимые в кислотах , реагирующие с водой и способные воспламеняться на воздухе с образованием U.
33О
8 . [6] Карбиды урана включают монокарбид урана (UC ) , дикарбид урана ( UC
2 ) и трикарбид диурана ( U
22С
3 ). И UC, и UC
2 образуются при добавлении углерода к расплавленному урану или при воздействии на металл окиси углерода при высоких температурах. Стабильно ниже 1800 °C, U
22С
3 получают путем нагревания смеси UC и UC
2 к механическому воздействию. [7] К нитридам урана, полученным прямым воздействием азота на металл, относятся мононитрид урана (UN), динитрид урана ( UN
2 ) и тринитрид диурана ( U
2 Н
3 ). [7]
Галогениды
[ редактировать ]
Все фториды урана создаются с использованием тетрафторида урана ( UF
4 ); УФ
Сам 4 получают гидрофторированием диоксида урана. [6] Снижение УФ
4 с водородом при 1000 ° C дает трифторид урана ( UF
3 ). При правильных условиях температуры и давления реакция твердого UF
4 с газообразным гексафторидом урана ( UF
6 ) могут образовывать промежуточные фториды U
22F
9 , У
4 Ф
17 и УФ
5 . [6]
При комнатной температуре УФ
6 имеет высокое давление паров , что делает его полезным в процессе газовой диффузии для отделения редкого урана-235 от обычного изотопа урана-238. Это соединение можно получить из диоксида урана и гидрида урана следующим способом: [6]
- ДРУЗЬЯ
2 + 4 ВЧ → УФ
4 + 2 часа
2 O (500 °C, эндотермический) - УФ
4 + Ф
2 → УФ
6 (350 °C, эндотермический)
Полученный УФ
6 , белое твердое вещество, обладает высокой реакционной способностью (за счет фторирования), легко сублимируется (выделяя пар, который ведет себя как почти идеальный газ ) и является наиболее летучим соединением урана, которое, как известно, существует. [6]
Один из способов получения тетрахлорида урана ( UCl
4 ) заключается в прямом соединении хлора с металлическим ураном или гидридом урана. Снижение UCl
4 водородом дает трихлорид урана ( UCl
3 ), тогда как высшие хлориды урана получают реакцией с дополнительным хлором. [6] Все хлориды урана реагируют с водой и воздухом.
Бромиды и йодиды урана образуются при прямой реакции соответственно брома и йода с ураном или при добавлении UH.
3 к кислотам этого элемента. [6] Известные примеры включают: UBr.
3 , УБр
4 , пользовательский интерфейс
3 и пользовательский интерфейс
4 . пользовательский интерфейс
5 никогда не готовился. Оксигалогениды урана водорастворимы и включают UO.
22F
2 , УОКл
2 , ДРУЗЬЯ
2 кл.
2 и УО
22 комн.
2 . Стабильность оксигалогенидов снижается по мере увеличения атомного веса галогенидного компонента. [6]
См. также
[ редактировать ]Цитаты
[ редактировать ]- ^ Клопрогге 2021 , стр. 861–862.
- ^ Сиборг 1968 , с. 779.
- ^ Jump up to: а б с Аргонн Нат. Лаборатория .
- ^ Jump up to: а б Сиборг 1968 , с. 778.
- ^ Jump up to: а б с д Пуигдоменек, Игнаси Гидра/Медуза База данных химического равновесия и программное обеспечение для построения графиков (2004) Королевский технологический институт KTH, программное обеспечение, которое можно бесплатно загрузить на ( факультет химии )
- ^ Jump up to: а б с д и ж г час я дж Сиборг 1968 , с. 782.
- ^ Jump up to: а б Сиборг 1968 , с. 780.
Источники
[ редактировать ]- «Программное обеспечение химического равновесия» . Химический факультет Королевского технологического института KTH . Архивировано из оригинала 29 сентября 2007 года . Проверено 29 сентября 2007 г.
- «Химические формы урана» . Аргоннская национальная лаборатория. Архивировано из оригинала 22 сентября 2006 года . Проверено 18 февраля 2007 г.
- Клопрогге, Дж. Тео (2021). Таблица Менделеева: строительные блоки природы: введение в встречающиеся в природе элементы, их происхождение и использование . Консепсьон П. Понсе, Том А. Лумис. Амстердам: Эльзевир. стр. 861–862. ISBN 978-0-12-821538-8 . OCLC 1223058470 .
- Сиборг, Гленн Т. (1968). "Уран". Энциклопедия химических элементов . Скоки, Иллинойс: Reinhold Book Corporation. стр. 773–786. LCCN 68029938 .

