Хлорид урана(III)
 | |
| Имена | |
|---|---|
| Название ИЮПАК Хлорид урана(III) | |
| Другие имена Хлорид урана Трихлорид урана Гипоранистый хлорид | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| UClUCl3 | |
| Появление | Зеленое кристаллическое твердое вещество |
| Плотность | 5.500 г/см 3 , жидкость |
| Температура плавления | 837 ° C (1539 ° F; 1110 К) |
| Точка кипения | 1657 ° C (3015 ° F; 1930 К) |
| Растворимый | |
| Структура | |
| Гибридизация | Трехглавая треугольная призматика |
| Опасности | |
| точка возгорания | Невоспламеняющийся |
| Невоспламеняющийся | |
| Родственные соединения | |
Родственные соединения | Хлорид урана(IV) , Хлорид урана(V) , Хлорид урана(VI) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Хлорид урана(III) , UCl 3 , представляет собой водорастворимую соль урана. UCl 3 используется в основном для переработки отработанного ядерного топлива. Хлорид урана(III) синтезируют различными способами из хлорида урана(IV) ; однако UCl 3 менее стабилен, чем UCl 4 .
Подготовка
[ редактировать ]Существует два способа синтеза хлорида урана (III). Следующие процессы описывают, как получить хлорид урана (III).
(1) В смесь NaCl-KCl при температуре 670–710 °С добавить тетрахлорид урана с металлическим ураном.
(2) Нагрейте хлорид урана(IV) в газообразном водороде.
Характеристики
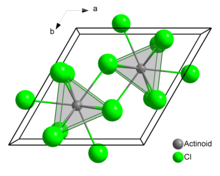
[ редактировать ]В твердом хлориде урана (III) каждый атом урана имеет девять атомов хлора в качестве ближайших соседей, примерно на одинаковом расстоянии, в тройной тригональной призматической конфигурации. [3]
Хлорид урана (III) представляет собой зеленое кристаллическое твердое вещество при комнатной температуре. UCl 3 плавится при 837°С и кипит при 1657°С. Хлорид урана(III) имеет плотность 5500 кг/м. 3 или 5.500 г/см 3 .
Его весовой состав:
- Хлор: 30,84%
- Уран: 69,16%
Его формальные окислительные состояния:
- Хлор: −1
- Уран: +3
Эта соль хорошо растворима в воде, а также очень гигроскопична . UCl 3 более устойчив в растворе соляной кислоты . [4]
Использование
[ редактировать ]Реагент
[ редактировать ]Хлорид урана(III) используется в реакциях с тетрагидрофураном (ТГФ) и метилциклопентадиеном натрия для получения различных металлоценовых комплексов урана. [5]
Катализатор
[ редактировать ]Хлорид урана(III) используется в качестве катализатора в реакциях между литийалюминийгидридом (LiAlH 4 ) и олефинами с получением алкилалюминатных соединений. [6]
Расплавленная форма
[ редактировать ]Расплавленная форма хлорида урана (III) является типичным соединением в пирохимических процессах, поскольку она важна при переработке отработавшего ядерного топлива . [7] UCl 3 обычно представляет собой форму, которую уран принимает в качестве отработанного топлива в процессах электрорафинирования. [7] [8]
Гидраты
[ редактировать ]Существует три гидрата хлорида урана (III):
- UClUCl3 . 2H22H2O . 2CH32CH3CN
- UClUCl3 . 6Н 2 О
- UClUCl3 . 7H27H2O
Каждый из них синтезируется путем восстановления хлорида урана (IV) в метилцианиде ( ацетонитриле ) с определенным количеством воды и пропионовой кислоты . [9]
Меры предосторожности
[ редактировать ]Хотя долгосрочных данных о токсических эффектах UCl 3 нет , важно по возможности свести к минимуму воздействие этого соединения.
Подобно другим соединениям урана, растворимым в воде, UCl 3 , вероятно, всасывается в кровь через альвеолярные карманы легких в течение нескольких дней после воздействия. Воздействие хлорида урана(III) приводит к токсичности почечной системы . [10]
Ссылки
[ редактировать ]- ^ Серрано, К.; Таксил, П.; Дань, О.; Буве, С.; Пуэх, EJ Nucl. Иметь значение. 2000, 282, 137–145.
- ^ Ремсен, Ира. Неорганическая химия. Нью-Йорк: Генри Холт и компания, 1890.
- ^ Уэллс А.Ф. (1984) Структурная неорганическая химия, 5-е издание Oxford Science Publications ISBN 0-19-855370-6
- ^ Коми, Артур М.; Хан, Дороти А. Словарь химической растворимости: неорганические вещества. Нью-Йорк: Компания MacMillan, 1921.
- ^ Бренна, JG; Андерсон, РА; Залкин, А. Неорг. хим. 1986, 25, 1756–1760.
- ^ Le Marechal, J.F.; Ephritikhine, M.; Folcher, G. J. Organomet. Chem. 1986, 309, C1–C3.
- ^ Jump up to: а б Окамото, Ю.; Мэдден, П.; Минато, К.Дж. Нукл. Матер. 2005, 344, 109–114.
- ^ Окамото, Ю.; Кобаяши, Ф.; Огава, TJ Alloys Compd. 1998, 271, 355–358.
- ^ Мех, А.; Карбовик, М.; Лис, Т. Многогранник. 2006, 25, 2083–2092.
- ^ Бертелл, Розали. «Ветераны войны в Персидском заливе и обедненный уран». Май 1999 г. Доступно: http://ccnr.org/du_hague.html .
Внешние ссылки
[ редактировать ]- Информация о хлориде урана (III) на Webelements
- Хлорид урана(III) International Bio-Analytical Industries, Inc.
- Обедненный уран: на все вопросы об обедненном уране и синдроме войны в Персидском заливе еще нет ответов