Хлорид иридия(III)
 α-IrCl 3 | |
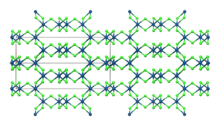 β-IrCl 3 | |
 Тригидрат хлорида иридия(III) | |
| Имена | |
|---|---|
| Другие имена трихлорид иридия | |
| Идентификаторы | |
| |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.030.028 |
| Номер ЕС |
|
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| IrCl 3 | |
| Молярная масса | 298,58 г/моль (безводный) 316,60 г/моль (гидрат) |
| Появление | коричневое твердое вещество (α-безводный) красное твердое вещество (β-безводный) темно-зеленое твердое вещество (тригидрат) |
| Плотность | 5,30 г/см 3 , твердый [1] |
| Температура плавления | 763 ° C (1405 ° F; 1036 К) [1] [2] (разлагается) |
| нерастворимый (безводный IrCl 3 ), растворимый (гидратированное производное) [1] | |
| Растворимость | Нерастворим в HCl и алканах. [1] |
| −14.4·10 −6 см 3 /моль | |
| Структура | |
| Моноклиника , мС16 | |
| С12/м1, №12 | |
| Термохимия | |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | -257 кДж/моль |
| Опасности | |
| СГС Маркировка : [3] | |
  | |
| Предупреждение | |
| Х302 , Х411 | |
| точка возгорания | негорючий |
| Родственные соединения | |
Другие катионы | Хлорид родия(III) |
Родственные соединения | Платина(II) хлорид |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
) – неорганическое соединение формулы Хлорид иридия( III IrCl 3 . соединение Безводное встречается относительно редко, но родственный ему гидрат гораздо чаще встречается . Безводная соль имеет две полиморфные модификации : α и β, коричневого и красного цвета соответственно. Чаще встречается гигроскопичный темно-зеленый тригидрат IrCl 3 (H 2 O) 3 , который является общей отправной точкой для химии иридия. [4]
Подготовка
[ редактировать ]Иридий отделяется от других металлов платиновой группы в виде кристаллического гексахлориридата аммония (NH 4 ) 2 [IrCl 6 ], который можно восстановить до металлического иридия в токе водорода . Полученный таким образом губчатый Ir реагирует с хлором при 650 ° C с образованием хлорида иридия (III). [5]
Гидратированный трихлорид иридия получают нагреванием гидратированного оксида иридия(III) с соляной кислотой . [6]
Структура
[ редактировать ]Как и родственное соединение родия, IrCl 3 принимает структуру хлорида алюминия . [6] Это моноклинная α- полиморфная модификация . [7] модификация . Также существует ромбоэдрическая β-полиморфная Обе полиморфные модификации имеют фактически одинаковую анионную решетку, но различаются октаэдрическими междоузлиями, которые занимают ионы иридия. [8] Полиморф α превращается в полиморф β при нагревании примерно до 650 °C. [4]
| Сложный | α-IrCl 3 [7] | β-IrCl 3 [8] |
|---|---|---|
| Кристаллическая структура | Моноклиника | орторомбический |
| Космическая группа | С2/м | Фдд |
| Постоянная решетки a (Å) | 5.99 | 6.95 |
| Постоянная решетки b (Å) | 10.37 | 9.81 |
| Постоянная решетки c (Å) | 5.99 | 20.82 |
| б | 109.4° | |
| Расчетная плотность (г/см 3 ) | 5.33 | 5.34 |
Структура тригидрата пока не выяснена.
Реакции и использование
[ редактировать ]В промышленности большинство комплексов иридия получают из гексахлориридата аммония или родственной хлориридовой кислоты (H 2 IrCl 6 ). Процесс Cativa , источник большей части мировой уксусной кислоты , основан на таких катализаторах.
Гидратированный хлорид иридия(III) используется для получения других комплексов иридия, таких как комплекс Васки , транс- [IrCl(CO)(PPh 3 ) 2 ]. [9] В присутствии хлорид-аниона он образует гексахлориридат(III) и образует гексахлориридат(IV) в царской водке . Тригидрат реагирует с аммиаком с образованием амминных комплексов , таких как хлорид пентаамминхлориридия(III), формула [IrCl(NH 3 ) 5 ]Cl 2 . Он также реагирует с концентрированным гидроксидом аммония при 150 °C с образованием полностью аммонизированного комплекса [Ir(NH 3 ) 6 ]Cl 3 . Гидрат может также образовывать комплексы при реакции с бипиридином , ацетонитрилом и пиридином . [4]
Алкеновые комплексы, такие как димер циклооктадиена иридия хлорида. [10] [11] и димер хлорбис(циклооктен)иридия [11] [10] также может быть получен путем нагревания гидрата с соответствующим алкеном в смесях воды и спирта.
Разложение
[ редактировать ]Тригидрат разлагается до безводной формы при 200 °C, которая затем окисляется на воздухе при 763 °C до оксида иридия (IV) , который затем разлагается до металлического иридия при 1070 °C. Однако под водородом он напрямую восстанавливается при 190 ° C до металлического иридия: [2] [12] [13]
- 2 IrCl 3 + 3 H 2 → 2 Ir + 6 HCl
Безопасность
[ редактировать ]Хлорид иридия(III) не включен в Приложение I Директивы 67/548/EEC , но внесен в перечень Закона о контроле над токсичными веществами (TSCA). Он также известен как мягкое средство, раздражающее кожу и глаза. [14]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д Хейнс, Уильям, изд. (2014). CRC Справочник по химии и физике . ЦРК Пресс. п. 4-68. ISBN 9781482208689 .
- ^ Jump up to: а б А.Э. Ньюкирк; Д. У. Макки (1968). «Термическое разложение хлоридов родия, иридия и рутения». Журнал катализа . 11 (4): 370–377. дои : 10.1016/0021-9517(68)90061-4 .
- ^ «Инвентаризация C&L» . echa.europa.eu . Проверено 23 декабря 2021 г.
- ^ Jump up to: а б с CE Housecroft и AG Sharpe Неорганическая химия , с. 849.
- ^ Герман Реннер (2018). «Металлы и соединения платиновой группы». Энциклопедия промышленной химии Ульмана : 1–73. дои : 10.1002/9783527306732.a21_075.pub2 . ISBN 9783527303854 . S2CID 94472506 .
- ^ Jump up to: а б Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Jump up to: а б Бродерсен, К.; Моерс, Ф.; Шнеринг, HG (1965). «О строении хлоридов иридия (III) и рутения (III)». естественные науки . 52 (9): 205–206. дои : 10.1007/BF00626459 . S2CID 43351743 .
- ^ Jump up to: а б Мейзель, А.; Леонхардт, Г. (1965). «Кристаллическая структура хлорида β-иридия (III)». З. неорг. общая хим. 339 (1–2): 57–66. дои : 10.1002/zaac.19653390109 .
- ^ Васька, Л.; И ДиЛуцио, JW (1961) J. Am. хим. Соц. 83:2784. Джиролами, Г.С.; Раухфус, ТБ; Анжеличи, Р.Дж. (1999). Синтез и техника в неорганической химии (3-е изд.) . Саусалито: Университетские научные книги.
- ^ Jump up to: а б Винкхаус, Г.; И Сингер, Х. (1966). Иридий(I)-олефинкомплекс. хим. Бер. 99:3610–18.
- ^ Jump up to: а б Херде, Дж.Л.; Ламберт, Дж. К.; И Сенофф, CV (1974). Циклооктеновые и 1,5-циклооктадиеновые комплексы иридия(I). Неорг. Синтез. 1974, том 15, страницы 18–20. два : 10.1002/9780470132463.ch5 .
- ^ У. Б. Роустон; Дж. М. Оттауэй (1979). «Определение благородных металлов методом атомно-абсорбционной спектрометрии в угольной печи. Часть 1. Процессы образования атомов». Аналитик . 104 (1240): 645–659. Бибкод : 1979Ана...104..645Р . дои : 10.1039/AN9790400645 .
- ^ Р.К. Кавар; PS Чигаре; П.С. Патил (2003). «Структурные, оптические и электрические свойства подложки, зависящие от температуры тонких пленок оксида иридия, осажденных распылением». Прикладная наука о поверхности . 206 (1–4): 90–101. Бибкод : 2003АпсС..206...90К . дои : 10.1016/S0169-4332(02)01191-1 .
- ^ Магер Стеллман, Дж. (1998). «Иридиум» . Энциклопедия охраны труда и техники безопасности . Международная организация труда. стр. 63.19 . ISBN 978-92-2-109816-4 . OCLC 35279504 .