Катализатор Крэбтри

| |

| |
| Имена | |
|---|---|
| Название ИЮПАК
( СП -4)-(η 2 ,или 2 -Циклоокта-1,5-диен)(пиридин)(трициклогексилфосфан)иридий(1+) гексафторофосфат(1-)
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.164.161 |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 31 H 50 F 6 ИрНП 2 | |
| Молярная масса | 804.9026 g/mol |
| Появление | Желтые микрокристаллы |
| Температура плавления | 150 ° C (302 ° F, 423 К) (разлагается) [ 1 ] |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Катализатор Крэбтри представляет собой иридиеворганическое соединение формулы [ C 8 H 12 Ir P(C 6 H 11 ) 3 C 5 H 5 N ]PF 6 . Это гомогенный катализатор реакций гидрирования и переноса водорода, разработанный Робертом Х. Крэбтри . Это стабильное на воздухе твердое вещество оранжевого цвета коммерчески доступно и известно своим направленным гидрированием, обеспечивающим транс-стереоселективность в отношении соответствующей направляющей группы. [ 2 ] [ 3 ]
Структура и синтез
[ редактировать ]Комплекс имеет квадратно-плоскую молекулярную геометрию , как и ожидалось для рекламы. 8 сложный. Его получают из димера хлорида циклооктадиена иридия . [ 4 ]
Реактивность
[ редактировать ]Катализатор Крэбтри эффективен для гидрирования моно-, ди-, три- и тетразамещенных субстратов. В то время как катализатор Уилкинсона и катализатор Шрока-Осборна не катализируют гидрирование тетразамещенного олефина, катализатор Крэбтри делает это при высоких частотах оборота (таблица). [ 2 ] [ 5 ]
Частота оборота Субстрат Катализатор Уилкинсона Катализатор Шрока – Осборна Катализатор Крэбтри Hex-1-ен 650 4000 6400 Циклогексен 700 10 4500 1-Метилциклогексен 13 — 3800 2,3-Диметил-бут-2-ен — — 4000
Катализатор реакционноспособен при комнатной температуре. [ 1 ] Реакция протекает устойчиво без высушивающих растворителей или тщательного деоксигенирования водорода. Катализатор толерантен к слабоосновным функциональным группам, таким как сложноэфирные, но не к спиртам (см. ниже) или аминам. [ 2 ] Катализатор чувствителен к протонсодержащим примесям. [ 6 ]
Катализатор необратимо дезактивируется примерно через десять минут при комнатной температуре, о чем свидетельствует появление желтого цвета. Один из процессов дезактивации включает образование димеров с гидридными мостиками. [ 7 ] Как следствие, катализатор Crabtree's Catalyst обычно используется с очень низкой загрузкой катализатора.

Другие каталитические функции: изотопный обмен и изомеризация.
[ редактировать ]Помимо гидрирования катализатор катализирует изомеризацию и гидроборирование алкенов. [ 1 ]

Катализатор Крэбтри используется в реакциях изотопного обмена. Точнее, он катализирует прямой обмен атома водорода с его изотопами дейтерием и тритием без использования промежуточного соединения. [ 8 ] Было показано, что изотопный обмен с катализатором Крэбтри обладает высокой региоселективностью. [ 9 ] [ 10 ]
Влияние направляющих функциональных групп
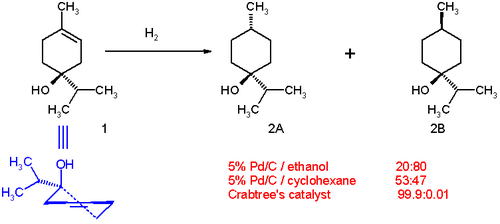
[ редактировать ]Гидрирование . терпен-4-ола демонстрирует способность соединений с направляющими группами (группа –ОН) подвергаться диастереоселективному гидрированию При использовании палладия на угле в этаноле распределение продуктов составляет 20:80 в пользу цис- изомера ( 2B на схеме 1). Полярная сторона (с гидроксильной группой) взаимодействует с растворителем. Это связано с небольшой гаптофильностью — эффектом, при котором функциональная группа связывается с поверхностью гетерогенного катализатора и направляет реакцию. [ 11 ] [ 12 ] В циклогексане в качестве растворителя распределение меняется на 53:47, поскольку гаптофильность больше не присутствует (у циклогексана нет направляющей группы). Распределение полностью меняется в пользу транс- изомера 2А при использовании катализатора Крэбтри в дихлорметане . Такая избирательность одновременно предсказуема и практически полезна. [ 13 ] Известно также, что карбонильные группы обеспечивают высокую региоселективность гидрирования на катализаторе Крэбтри. [ 14 ] [ 15 ] [ 16 ]
Направляющий эффект, обусловливающий стереоселективность гидрирования терпен-4-ола на катализаторе Крэбтри, показан ниже.

История
[ редактировать ]Крэбтри и аспирант Джордж Моррис открыли этот катализатор в 1970-х годах, работая над иридиевыми аналогами катализатора Уилкинсона родиевого в Институте химии природных веществ в Гиф-сюр-Иветт , недалеко от Парижа.
Предыдущие катализаторы гидрирования включали катализатор Уилкинсона и катионный комплекс родия (I) с двумя фосфиновыми группами, разработанный Осборном и Шроком. [ 17 ] Эти катализаторы осуществляли гидрирование путем замещения; после присоединения водорода к металлу растворитель или фосфиновая группа диссоциируют от металлического родия, так что гидрируемый олефин может получить доступ к активному центру. [ 2 ] Это смещение происходит быстро для комплексов родия и практически не происходит для комплексов иридия. [ 18 ] По этой причине исследования в то время были сосредоточены на соединениях родия, а не на соединениях, включающих переходные металлы третьего ряда, такие как иридий. Уилкинсон, Осборн и Шрок также использовали только координирующие растворители. [ 19 ]
Крэбтри отметил, что стадия диссоциации лиганда не происходит в гетерогенном катализе , и поэтому предположил, что эта стадия является ограничивающей в гомогенных системах. [ 2 ] Они искали катализаторы с «необратимо создаваемыми активными центрами в некоординирующем растворителе». Это привело к разработке катализатора Крэбтри и использованию растворителя CH 2 Cl 2 .
Ссылки
[ редактировать ]- ^ Jump up to: а б с Крэбтри, Р.Х. (2001). «(1,5-Циклооктадиен)(трициклогексилфосфин)(пиридин)иридий(I)Гексафторфосфат». Электронная энциклопедия реагентов для органического синтеза EROS . doi : 10.1002/047084289X.rc290m.pub4 (неактивен 31 января 2024 г.).
{{cite encyclopedia}}: CS1 maint: DOI неактивен по состоянию на январь 2024 г. ( ссылка ) - ^ Jump up to: а б с д и Роберт Х. Крэбтри (1979). «Соединения иридия в катализе». Акк. хим. Рез . 12 (9): 331–337. дои : 10.1021/ar50141a005 .
- ^ Браун, Дж. М. (1987). «Направленное гомогенное гидрирование». Энджью. хим. Межд. Эд. 26 (3): 190–203. дои : 10.1002/anie.198701901 .
- ^ Крэбтри, Р. Х.; Моррис, GE (1977). «Некоторые диолефиновые комплексы иридия (I) и серия транс -влияния для комплексов [IrCl (cod) L]». Дж. Органомет. Хим . 135 (3): 395–403. дои : 10.1016/S0022-328X(00)88091-2 .
- ^ Уайт, М. (15 октября 2002 г.). «Гидрирование» (PDF) . Проверено 1 декабря 2014 г.
- ^ Сюй, Инцзянь; Мингос, Д. Майкл П .; Браун, Джон М. (2008). «Возврат к катализатору Крэбтри; влияние лиганда на стабильность и долговечность». хим. Комм. 2008 (2): 199–201. дои : 10.1039/b711979h . ПМИД 18092086 .
- ^ Крэбтри, Р.; Фелкин, Х.; Моррис, Г. (1977). «Катионные комплексы диолефина иридия как катализаторы гидрирования алкенов и выделение некоторых родственных гидридокомплексов». Журнал металлоорганической химии . 141 (2): 205–215. дои : 10.1016/S0022-328X(00)92273-3 .
- ^ Шу, С. (2009). «Эффект добавления катализатора Крэбтри к родиевой черни в реакциях прямого изотопного обмена водорода». Журнал меченых соединений и радиофармпрепаратов . 52 (9): 376–381. дои : 10.1002/jlcr.1612 .
- ^ Вальсборг, Дж.; Соренсен, Л.; Фогед, К. (2001). «Иридийорганический катализируемый изотопно-водородный обмен производных бензамида». Журнал меченых соединений и радиофармпрепаратов . 44 (3): 209–214. дои : 10.1002/jlcr.446 .
- ^ Хеск, Д.; Дас, П.; Эванс, Б. (1995). «Дейтерирование ацетанилидов и других замещенных ароматических соединений с использованием [Ir(COD)(Cy 3 P)(Py)]PF 6 в качестве катализатора». Журнал меченых соединений и радиофармпрепаратов . 36 (5): 497–502. дои : 10.1002/jlcr.2580360514 .
- ^ Томпсон, Х.; Найпауэр, Р. (1973). «Стереохимический контроль редукций. III. Подход к групповым гаптофильностям». Журнал Американского химического общества . 95 (19): 6379–6386. дои : 10.1021/ja00800a036 .
- ^ Роулендс, Г. (1 января 2002 г.). «Гидрирование» (PDF) . Архивировано из оригинала (PDF) 2 января 2015 г. Проверено 1 декабря 2014 г.
- ^ Браун, Дж. (1987). «Направленное гомогенное гидрирование [Новые синтетические методы (65)]». Энджью. хим. Межд. Эд. англ. 26 (3): 190–203. дои : 10.1002/anie.198701901 .
- ^ Шульц, А.; Макклоски, П. (1985). «Карбоксамид и карбалкоксигруппа направляют стереоселективное катализируемое иридием гомогенное гидрирование олефинов». Журнал органической химии . 50 (26): 5905–5907. дои : 10.1021/jo00350a105 .
- ^ Крэбтри, Р. Х.; Дэвис, М.В. (1986). «Направление эффектов при гомогенном гидрировании с помощью [Ir (cod) (PCy3) (py)] PF6». Дж. Орг. Хим . 51 (14): 2655–2661. дои : 10.1021/jo00364a007 .
- ^ Крэбтри, Р.; Дэвис, М. (1983). «Возникновение и возникновение выраженного направляющего действия гидроксильной группы при гидрировании с [Ir(cod)P(C 6 H 11 ) 3 (py)]PF 6 ». Металлоорганические соединения . 2 (5): 681–682. дои : 10.1021/om00077a019 .
- ^ Шрок, Р.; Осборн, Дж. А. (1976). «Каталитическое гидрирование с использованием катионных комплексов родия. I. Эволюция каталитической системы и гидрирование олефинов». Журнал Американского химического общества . 98 (8): 2134–2143. дои : 10.1021/ja00424a020 .
- ^ Осборн, Дж.; Шепли, Дж. (1970). «Быстрые внутримолекулярные перегруппировки в пятикоординационных соединениях переходных металлов. Механизм перегруппировки некоторых флюсионных комплексов иридия (I)». Журнал Американского химического общества . 92 (23): 6976–6978. дои : 10.1021/ja00726a047 .
- ^ Янг, Дж.; Уилкинсон, Г. (1966). «Получение и свойства трис (трифенилфосфин) галогенродия (I) и некоторые его реакции, включая каталитическое гомогенное гидрирование олефинов и ацетиленов и их производных». Дж. Хим. Соц. А. 1966 : 1711. doi : 10.1039/J19660001711 .