1,5-Циклооктадиен

| |
| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
Циклоокта-1,5-диен [1] | |
| Идентификаторы | |
| |
3D model ( JSmol )
|
|
| Сокращения | 1,5-ХПК |
| 2036542 1209288 ( З , З ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.003.552 |
| Номер ЕС |
|
| МеШ | 1,5-циклооктадиен |
ПабХим CID
|
|
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 2520 |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 8 Ч 12 | |
| Молярная масса | 108.184 g·mol −1 |
| Появление | Бесцветная жидкость |
| Плотность | 0,882 г/мл |
| Температура плавления | −69 °С; −92 ° F; 204 К |
| Точка кипения | 150 °С; 302 °Ф; 423 К |
| Давление пара | 910 Ну |
Показатель преломления ( n D )
|
1.493 |
| Термохимия | |
Теплоемкость ( С )
|
198,9 Дж К −1 моль −1 |
Стандартный моляр
энтропия ( S ⦵ 298 ) |
250,0 Дж К −1 моль −1 |
Стандартная энтальпия
образование (Δ f H ⦵ 298 ) |
21–27 кДж раз −1 |
Стандартная энтальпия
горение (Δ c H ⦵ 298 ) |
−4,890 – −4,884 МДж моль −1 |
| Опасности | |
| СГС Маркировка : | |
 
| |
| Опасность | |
| Х226 , Х304 , Х315 , Х317 , Х319 , Х334 | |
| П261 , П280 , П301+П310 , П305+П351+П338 , П331 , П342+П311 | |
| точка возгорания | От 32 до 38 ° C (от 90 до 100 ° F; от 305 до 311 К) |
| 222 ° С (432 ° F; 495 К) | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Циклоокта-1,5-диен представляет собой циклический углеводород с химической формулой C 8 H 12 , в частности [-(СН 2 ) 2 -СН=СН-] 2 .
Существует три конфигурационных изомера с таким строением, которые отличаются расположением четырех одинарных связей C–C, прилегающих к двойным связям. Каждая пара одинарных связей может находиться на одной стороне ( цис , Z ) или на противоположных сторонах ( транс , E ) плоскости двойной связи; три возможности обозначены цис,цис , транс,транс и цис,транс ; или ( Z,Z ), ( E,E ) и ( Z,E ). (Из-за общей симметрии транс,цис имеет ту же конфигурацию, что и цис,транс .)
, обычно сокращенно ХПК, Цис,цис- изомер этого диена является полезным предшественником других органических соединений и служит лигандом в металлоорганической химии . Это бесцветная жидкость с резким запахом. [2] [3] 1,5-Циклооктадиен можно получить димеризацией бутадиена в присутствии никелевого катализатора, побочным продуктом которого является винилциклогексен . В 2005 году было произведено около 10 000 тонн. [4] [5]
Органические реакции
[ редактировать ]ХПК реагирует с бораном с образованием 9-борабицикло[3.3.1]нонана , [6] широко известный как 9-BBN, реагент в органической химии, используемый при гидроборировании :
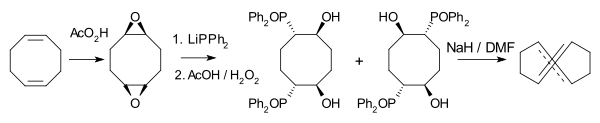
ХПК добавляет SCl 2 (или подобные реагенты) с получением 2,6-дихлор-9-тиабицикло[3.3.1]нонана: [7] [8]
Полученный дихлорид может быть дополнительно модифицирован как диазидное или дицианопроизводное путем нуклеофильного замещения с помощью анхимерного содействия .
ХПК используется в качестве промежуточного продукта в одном из синтезов диспарлюра , непарного шелкопряда феромона . [9]
Металлические комплексы
[ редактировать ]- Комплексы избранных металлов с 1,5-ХПК.
-
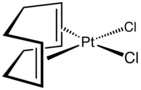
Комплекс Rh 2 (ХПК) 2 Cl 2 .
-
Со(1,5-циклооктадиен)(циклооктенил).
1,5-ХОД связывается с низковалентными металлами через обе алкеновые группы. Комплексы металл-ХПК привлекательны, поскольку они достаточно стабильны, чтобы их можно было изолировать, и часто более прочны, чем родственные комплексы этилена. Стабильность комплексов ХПК обусловлена хелатным эффектом . Лиганды ХПК легко замещаются другими лигандами, например фосфинами.
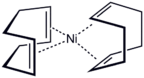
Ni(COD) 2 получают восстановлением безводного никеля ацетилацетоната в присутствии лиганда с использованием триэтилалюминия . [10]
- 1 ⁄ 3 [Ni(C 5 H 7 O 2 ) 2 ] 3 + 2COD + 2Al(C 2 H 5 ) 3 → Ni(COD) 2 + 2Al(C 2 H 5 ) 2 (C 5 H 7 O 2 ) + C 2 H4 + 2HC2H6
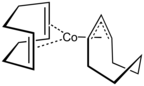
Соответствующие Pt(COD) 2 получают более обходным путем с использованием дилитийциклооктатетраена : [11]
- Li 2 C 8 H 8 + PtCl 2 (COD) + 3C 7 H 10 → [Pt(C 7 H 10 ) 3 ] + 2LiCl + C 8 H 8 + C 8 H 12
- Pt(C 7 H 10 ) 3 + 2COD → Pt(COD) 2 + 3C 7 H 10
Сообщалось об обширных работах по комплексам ХПК, большая часть которых описана в томах 25, 26 и 28 книги « Неорганические синтезы» . Платиновый комплекс является предшественником 16-электронного комплекса этилена:
- Pt(COD) 2 + 3C 2 H 4 → Pt(C 2 H 4 ) 3 + 2COD
Комплексы ХПК полезны в качестве исходных материалов; Одним из примечательных примеров является реакция:
- Ni(COD) 2 + 4CO → Ni(CO) 4 + 2COD
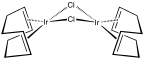
Продукт Ni(CO) 4 очень токсичен, поэтому выгодно генерировать его в реакционном сосуде по мере необходимости. Другие комплексы ХПК низковалентных металлов включают димер хлорида циклооктадиенродия , димер хлорида циклооктадиена иридия и Fe(COD)(CO) 3 и катализатор Крэбтри .
The Комплексы M(COD) 2 с никелем, палладием и платиной имеют тетраэдрическую геометрию , тогда как [М(ХПК) 2 ] + Комплексы родия и иридия имеют плоско-квадратную форму .
( E , E )-COD
[ редактировать ]Высоконапряженный транс , транс -изомер 1,5-циклооктадиена является известным соединением. ( E , E )-COD был впервые синтезирован Джорджем М. Уайтсайдсом и Артуром К. Коупом в 1969 году путем фотоизомеризации цис - , цис соединения. [12] О другом синтезе (реакция двойного элиминирования циклооктанового кольца) сообщил Рольф Хейсген в 1987 году. [13] Молекулярная конформация ( E , E )-COD скорее скрученная, чем стулообразная. Соединение было исследовано как медиатор клик-химии . [14]
Ссылки
[ редактировать ]- ^ «AC1L1QCE — Сводная информация о соединениях» . Пабхим соединение . США: Национальный центр биотехнологической информации. 26 марта 2005 г. Идентификация и соответствующие записи . Проверено 14 октября 2011 г.
- ^ Бюлер, К.; Пирсон, Д. (1970). Обзор органических синтезов . Нью-Йорк: Wiley-Interscience.
- ^ Шрайвер, Д.; Аткинс, П. (1999). Неорганическая химия . WH Freeman and Co. Нью-Йорк: ISBN 978-0-716-72873-3 .
- ^ Шиффер, Томас; Энбринк, Георг. «Циклододекатриен, циклооктадиен и 4-винилциклогексен». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a08_205.pub2 . ISBN 978-3527306732 .
- ^ Ли, Х; Кэмпбелл, Миннесота; Санчес, Р.Х.; Бёргель, Дж.; Рейно, Дж; Паркер, ЮВ; Риттер, Т. (2016). «Механистический взгляд на димеризацию бутадиена, катализируемую высокоспиновым железом (I)». Металлоорганические соединения . 35 (17): 2923–2929. doi : 10.1021/acs.organomet.6b00474 .
- ^ Содерквист, Джон А.; Негрон, Элвин (1998). «Димер 9-борабицикло[3.3.1]нонан» . Органические синтезы ; Сборник томов , т. 9, с. 95 .
- ^ Бишоп, Роджер. «9-Тиабицикло[3.3.1]нонан-2,6-дион» . Органические синтезы ; Сборник томов , т. 9, с. 692 .
- ^ Диас, Дэвид; Конверсо, Антонелла; Шарплесс, К. Барри; Финн, МГ (2006). «2,6-Дихлор-9-тиабицикло[3.3.1]нонан: мультиграммное отображение азидных и цианидных компонентов на универсальном каркасе» (PDF) . Молекулы . 11 (4): 212–218. дои : 10.3390/11040212 . ПМК 6148556 . ПМИД 17962753 .

- ^ Клюненберг, Гельмут; Шефер, Ханс Дж. (1978). «Синтез диспарлюра электролизом Кольбе». Международное издание «Прикладная химия» на английском языке . 17 :47–48. дои : 10.1002/anie.197800471 .
- ^ Шунн, Р.; Иттель, С. (2007). «Бис(1,5-Циклооктадиен)Никель(0)». Неорганические синтезы . Полный. 28. стр. 94–98. дои : 10.1002/9780470132593.ch25 . ISBN 978-0-470-13259-3 .
- ^ Красколл, Л; Спенсер, Дж. (2007). «Олефиновые комплексы платины». Неорганические синтезы . Том. 28. С. 126–132. дои : 10.1002/9780470132593.ch34 . ISBN 978-0-470-13259-3 .
- ^ Уайтсайдс, Джордж М .; Гоу, Джеральд Л.; Коуп, Артур К. (1969). «Облучение цис , цис -1,5-циклооктадиена в присутствии хлорида меди (I)». Дж. Ам. хим. Соц . 91 (10): 2608–2616. дои : 10.1021/ja01038a036 .
- ^ Бек, Дитер; Хейсген, Рольф ; Ноэт, Генрих (1987). «Получение и конформация ( E , E )-1,5-циклооктадиена». Дж. Ам. хим. Соц . 109 (4): 1248–1249. дои : 10.1021/ja00238a046 .
- ^ Штёкманн, Хеннинг; Невес, Андре А.; Дэй, Генри А.; Лестница, Шон; Бриндл, Кевин М.; Липер, Финиан Дж. (2011). «( E , E )-1,5-Циклооктадиен: маленький и быстрый мультиталант в области химии». хим. Коммун . 47 (25): 7203–5. дои : 10.1039/C1CC12161H . ПМИД 21611648 .

![2,6-Дихлор-9-тиабицикло[3.3.1]нонан, синтез и реакции](http://upload.wikimedia.org/wikipedia/commons/thumb/a/ab/CODSCl2.png/450px-CODSCl2.png)