Циклооктатетраен
| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Циклоокта-1,3,5,7-тетраен [1] | |||
| Другие имена [8] Кольцевое пространство (1 Z ,3 Z ,5 Z ,7 Z )-Циклоокта-1,3,5,7-тетраен 1,3,5,7-Циклооктатетраен СОТ | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ЧЭБИ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.010.074 | ||
| Номер ЕС |
| ||
ПабХим CID | |||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| С 8 Ч 8 | |||
| Молярная масса | 104.15 g/mol | ||
| Появление | Прозрачный желтый | ||
| Плотность | 0,9250 г/см 3 , жидкость | ||
| Температура плавления | от -5 до -3 ° C (от 23 до 27 ° F; от 268 до 270 К) | ||
| Точка кипения | От 142 до 143 ° C (от 288 до 289 ° F; от 415 до 416 К) | ||
| несмешиваемый | |||
| -53.9·10 −6 см 3 /моль | |||
| Опасности | |||
| СГС Маркировка : | |||
   | |||
| Опасность | |||
| Х225 , Х304 , Х315 , Х319 , Х335 | |||
| P210 , P233 , P240 , P241 , P242 , P243 , P261 , P264 , P271 , P280 , P301+P310 , P302+P352 , P303+P361+P353 , P304+P340 , P305+P351+P338 , П312 , П321 , П331 , P332+P313 , P337+P313 , P362 , P370+P378 , P403+P233 , P403+P235 , P405 , P501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | −11 ° C (12 ° F; 262 К) | ||
| 561 ° C (1042 ° F; 834 К) | |||
| Родственные соединения | |||
Родственные углеводороды | Циклооктан Тетрафенилен | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
1,3,5,7-Циклооктатетраен ( ЦОТ ) представляет собой ненасыщенное производное циклооктана 8 формулой C с H 8 . Он также известен как [8] аннулен . Этот полиненасыщенный углеводород представляет собой легковоспламеняющуюся жидкость от бесцветного до светло-желтого цвета при комнатной температуре. Из-за своей стехиометрической связи с бензолом COT стал предметом множества исследований и некоторых споров.
В отличие от бензола C 6 H 6 , циклооктатетраен C H 8 не является ароматическим , хотя его дианион C 8
88Ч 2−
8 ( циклооктатетраенид ), о. Его реакционная способность характерна для обычного полиена , т. е. он подвергается реакциям присоединения . Бензол, напротив, обычно подвергается реакциям замещения , а не присоединения.
История [ править ]
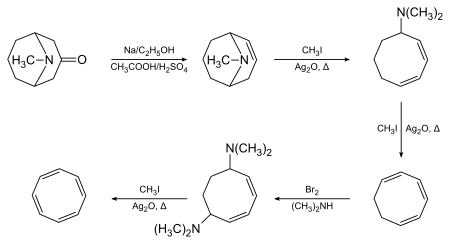
1,3,5,7-Циклооктатетраен был первоначально синтезирован Рихардом Вильштеттером в Мюнхене в 1905 году с использованием псевдопеллетиерина в качестве исходного материала и элиминирования Хофмана в качестве ключевого преобразования: [2] [3]
Вильштеттер отметил, что соединение не проявляло ожидаемой ароматичности. Между 1939 и 1943 годами химики США безуспешно пытались синтезировать COT. Они объяснили свою неудачу тем, что Вильштеттер на самом деле синтезировал не это соединение, а его изомер, стирол . Вильштеттер ответил на эти отзывы в своей автобиографии, где отметил, что американских химиков «не беспокоило» восстановление его циклооктатетраена до циклооктана (реакция, невозможная для стирола). Во время мировой войны Второй Вальтер Реппе из BASF Ludwigshafen разработал простой одностадийный синтез циклооктатетраена из ацетилена, получив материал, идентичный тому, который приготовил Вильштеттер. [4] Все оставшиеся сомнения в точности первоначального синтеза Вильштеттера были разрешены, когда Артур К. Коуп и его коллеги из Массачусетского технологического института сообщили в 1947 году о полном повторении синтеза Вильштеттера, шаг за шагом, с использованием первоначально описанных методов. Они получили тот же циклооктатетраен, [5] и впоследствии они сообщили о современных спектральных характеристиках многих промежуточных продуктов, что еще раз подтвердило точность оригинальной работы Вильштеттера. [6] Однако температура замерзания продукта отличалась от температуры чистого COT, и авторы интерпретировали ее как загрязнение примерно 30% стирола.
Структура и связь [ править ]

Ранние исследования показали, что COT не отображает химический состав ароматического соединения. [7] Затем ранние эксперименты по дифракции электронов пришли к выводу, что расстояния связей CC идентичны. [8] Однако данные рентгеновской дифракции Х.С. Кауфмана продемонстрировали, что циклооктатетраен принимает несколько конформаций и содержит два различных расстояния связи C–C. [9] Этот результат показал, что COT представляет собой аннулен с фиксированными чередующимися одинарными и двойными связями CC.
В нормальном состоянии циклооктатетраен неплоский и принимает форму ванны с углами C=C-C = 126,1° и C=C-H = 117,6°. [10] Точечная группа циклооктатетраена – D 2d . [11]
В плоском переходном состоянии переходное состояние D 4h более стабильно, чем переходное состояние D 8h, из-за эффекта Яна-Теллера . [12]
Синтез [ править ]
Оригинальный синтез Рихарда Вильштеттера (4 последовательные реакции элиминирования на циклооктановом каркасе) дает относительно низкие выходы. Синтез циклооктатетраена Реппе, который включает обработку ацетилена под высоким давлением теплой смесью цианида никеля и карбида кальция , оказался намного лучше, с химическим выходом около 90%: [4]
COT также можно получить фотолизом баррелена , причем , одного из его структурных изомеров реакция протекает через другой изолируемый изомер, семибуллвален . [13] Производные COT также могут быть синтезированы с использованием полубуллваленовых промежуточных продуктов. В последовательности, показанной ниже, октаэтилциклооктатетраен (C 8 Et 8 ) образуется путем термической изомеризации октаэтилсемибуллвалена, который сам образуется в результате бромидом меди (I) опосредованной циклодимеризации 1,2,3,4-тетраэтил-1,4-дилитио-1, 3-бутадиен. [14]
Поскольку COT нестабилен и легко образует взрывоопасные органические пероксиды небольшое количество гидрохинона , к коммерчески доступному материалу обычно добавляют . Тестирование на пероксиды рекомендуется проводить при использовании ранее открытой бутылки; белые кристаллы на горлышке бутылки могут состоять из перекиси, которая может взорваться при механическом повреждении.
Естественное явление [ править ]
Циклооктатетраен был выделен из некоторых грибов. [15]
Реакция [ править ]
π-связи в COT реагируют как обычно для олефинов, а не как ароматические кольцевые системы. Моно- и полиэпоксиды могут быть получены реакцией COT с пероксикислотами или диметилдиоксираном . Известны также различные другие реакции присоединения. Кроме того, полиацетилен можно синтезировать путем с раскрытием цикла . полимеризации циклооктатетраена [16] Сам COT, а также его аналоги с боковыми цепями использовались в качестве металлических лигандов и в сэндвич-соединениях .
Циклооктатетраен также подвергается реакциям перегруппировки с образованием ароматических кольцевых систем. Например, при окислении раствором водным сульфата ртути(II) образуется фенилацетальдегид. [4] [17] и фотохимическая перегруппировка его моноэпоксида образует бензофуран . [18]
как лиганд и лиганда предшественник Циклооктатетраенид

COT легко реагирует с металлическим калием с образованием соли K 2 COT, которая содержит дианион C.
88Ч 2−
8 . [19] Дианион плоский, восьмиугольный и ароматический , с числом электронов Хюккеля 10.
Циклооктатетраен образует металлоорганические комплексы с некоторыми металлами, включая иттрий , лантаноиды и актиниды. [20] Сэндвич -соединение ураноцена (U(COT) 2 ) имеет два η 8 -COT-лиганды. В бис(циклооктатетраен)железе (Fe(COT) 2 ) один COT равен η 6 а другой - η 4 . (Циклооктатетраен)трикарбонильные свойства железа η 4 -КОТ. Комнатная температура 1 Спектры ЯМР 1Н этих комплексов железа являются синглетными, что указывает на текучесть . [21]

Циклооктатетраен хлорируется с образованием [4.2.0] -бициклического соединения, которое далее реагирует с диметилацетилендикарбоксилатом по реакции Дильса-Альдера (ДА). Ретро-DA при 200 ° C выделяет цис-дихлорциклобутен. Это соединение реагирует с дижелезо-нонакарбонилом с образованием циклобутадиен-трикарбонила железа . [22] [23]
См. также [ править ]
- Баррелен , структурный изомер циклооктатетраена.
- Бензол
- Циклобутадиен
- Гептафульвен , структурный изомер циклооктатетраена.
- Пентален
- Семибуллвален
Ссылки [ править ]
- ^ «Фронт материи». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. стр. P001–P004. doi : 10.1039/9781849733069-FP001 (неактивен 5 июня 2024 г.). ISBN 978-0-85404-182-4 .
{{cite book}}: CS1 maint: DOI неактивен по состоянию на июнь 2024 г. ( ссылка ) - ^ Мейсон, С. (февраль 1997 г.). «Наука и гуманизм Лайнуса Полинга (1901–1994)». хим. Соц. Откр. 26 : 29–39. дои : 10.1039/CS9972600029 .
- ^ Рихард Вильштеттер ; Эрнст Васер (1911). «О циклооктатетраене» [О циклооктатетраене]. Отчеты Немецкого химического общества . 44 (3): 3423–3445. дои : 10.1002/cber.191104403216 .
- ^ Jump up to: Перейти обратно: а б с Реппе, Уолтер ; Шлихтин, Отто; Клагер, Карл; Топель, Тим (1948). «Циклизационная полимеризация ацетилена. I. О циклооктатетраене» [Кольцеобразующая полимеризация ацетилена. I. Циклооктатетраены]. «Анналы химии» Юстуса Либиха . 560 (1): 1–92. дои : 10.1002/jlac.19485600102 .
- ^ Коуп, Артур К.; Овербергер, CG (1947). «Синтез циклооктатетраена из псевдопеллетиерина». Журнал Американского химического общества . 69 (4): 976. дои : 10.1021/ja01196a513 . ПМИД 20292490 .
- ^ Коуп, Артур К.; Овербергер, CG (1947). «Циклические полиолефины. I. Синтез циклооктатетраена из псевдопеллетиерина». Журнал Американского химического общества . 70 (4): 1433–1437. дои : 10.1021/ja01184a041 . ПМИД 18915758 .
- ^ Джонсон, AW (1947). «Органическая химия». наук. Прогр . 35 (139): 506–515. JSTOR 43413011 .
- ^ Бастиенсен, О.; Хассель, О.; Лангсет, А. (1947). «Октабензол, Циклооктатетраен (C 8 H 8 )» . Природа . 160 (4056): 128. Бибкод : 1947Natur.160..128B . дои : 10.1038/160128a0 .
- ^ Кауфман, Х.С.; Фанкючен, И.; Х., Марк (1948). «Строение циклооктатетраена» . Природа . 161 (4083): 165. Бибкод : 1948Natur.161..165K . дои : 10.1038/161165a0 .
- ^ Томас, премьер-министр; Вебер, А. (1978). «Комбинационная спектроскопия газов высокого разрешения с лазерными источниками. XIII – чистые вращательные спектры 1,3,5,7-циклооктатетраена и 1,5-циклооктадиена». Дж. Рамановский спектр . 7 (6): 353–357. Бибкод : 1978JRSp....7..353T . дои : 10.1002/jrs.1250070614 .
- ^ Клаус, К.Х.; Крюгер, К. (15 сентября 1988 г.). «Структура циклооктатетраена при 129 К». Акта Кристаллогр. С. 44 (9): 1632–1634. Бибкод : 1988AcCrC..44.1632C . дои : 10.1107/S0108270188005840 .
- ^ Нисинага, Тору; Омаэ, Такеши; Иёда, Масахико (5 февраля 2010 г.). «Недавние исследования ароматичности и антиароматичности плоского циклооктатетраена» . Симметрия . 2 (1): 76–97. Бибкод : 2010Symm....2...76N . дои : 10.3390/sym2010076 .
- ^ Циммерман, HE; Грюневальд, Г.Л. (1966). «Химия баррелена. III. Уникальная фотоизомеризация в семибуллвален» (PDF) . Дж. Ам. хим. Соц. 88 (1): 183–184. дои : 10.1021/ja00953a045 .
- ^ Ван, К.; Юань, Дж.; Ли, Г.; Ван, З.; Чжан, С.; Си, З. (2006). «Эффективный синтез, опосредованный металлами, структурная характеристика и скелетная перестройка октазамещенных семибуллваленов». Дж. Ам. хим. Соц. 128 (14): 4564–4565. дои : 10.1021/ja0579208 . ПМИД 16594680 .
- ^ Стинсон, М.; Эзра, Д.; Гесс, В.М.; Сирс, Дж.; Стробель, Г. (2003). «Эндофитный Gliocladium sp. Eucryphia cordifolia , продуцирующий селективные летучие противомикробные соединения». Наука о растениях . 165 (4): 913–922. Бибкод : 2003PlnSc.165..913S . дои : 10.1016/S0168-9452(03)00299-1 .
- ^ Мурхед, Эрик Дж.; Венцель, Анна Г. (август 2009 г.). «Два студенческих эксперимента с органическими полимерами: получение полиацетилена и телехелатного полиацетилена посредством метатезисной полимеризации с раскрытием кольца». Журнал химического образования . 86 (8): 973. Бибкод : 2009ЖЧЭд..86..973М . дои : 10.1021/ed086p973 .
- ^ Куничика, Санго (1953). «Циклополиолефины, полученные из ацетилена». Бюллетень Института химических исследований Киотского университета . 31 (5): 323–335. hdl : 2433/75368 .
- ^ Головка, Ю.М.; Гарднер, доктор медицинских наук; Строу, CB; Хилл, МЛ; Ван Аукен, ТВ (1968). «Фотолиз и фотоизомеризация оксида циклооктатетраена». Журнал Американского химического общества . 90 (18): 5041–5043. дои : 10.1021/ja01020a058 .
- ^ Кац, Томас Дж. (1960). «Циклооктатетраенил дианион». Дж. Ам. хим. Соц. 82 (14): 3784–3785. дои : 10.1021/ja01499a077 .
- ^ «Основные моменты проекта JST по наноструктурным материалам - презентация профессора Накадзимы» . Архивировано из оригинала 19 февраля 2008 г. Проверено 24 ноября 2005 г.
- ^ Коттон, Ф. Альберт; Хантер, Дуглас Л. (1976). «Исследование магнитного резонанса углерода-13 флюксиального поведения циклооктатетрикарбонилирона и -рутения». Журнал Американского химического общества . 98 (6): 1413–1417. дои : 10.1021/ja00422a022 .
- ^ Р. Петтит и Дж. Хенери (1970). « цис -дихлорциклобутен». Органические синтезы . 50:36 . дои : 10.15227/orgsyn.050.0036 .
- ^ «ЦИКЛОБУТАДИЕН В СИНТЕЗЕ: Эндо-ТРИКЛО[4.4.0.02,5]ДЕКА-3,8-ДИЕН-7,10-ДИОН». Органические синтезы . 55 : 43. 1976. doi : 10.15227/orgsyn.055.0043 .