Структурный изомер
Эта статья читается как учебник . ( август 2020 г. ) |
В химии — структурный изомер (или конституционный изомер в ИЮПАК) . номенклатуре [1] ) соединения — это другое соединение, молекула которого имеет одинаковое количество атомов каждого элемента, но с логически различными связями между ними. [2] [3] Термин метамер раньше использовался для того же понятия. [4]
Например, бутанол H 3 C-(CH 2 ) 3 -OH , метилпропиловый эфир H 3 C-(CH 2 ) 2 -O-CH 3 и диэтиловый эфир (H 3 CCH 2 -) 2 O имеют одинаковую молекулярную формулу C 4 H 10 O, но представляют собой три различных структурных изомера.
Эта концепция применима также к многоатомным ионам с тем же полным зарядом. Классическим примером является цианат- ион. О=С=Н − и гремучий ион С − ≡N + −О − . Это также распространяется на ионные соединения, так что (например) цианат аммония [НХ 4 ] + [О=С=Н] − и мочевина (H 2 N−) 2 C=O считаются структурными изомерами, [4] и формиат метиламмония [H 3 C-NH 3 ] + [HCO 2 ] − и ацетат аммония [НХ 4 ] + [Н 3 С-СО 2 ] − .
Структурная изомерия — наиболее радикальный тип изомерии . Она противоположна стереоизомерии , при которой атомы и схема связи одинаковы, но отличается только относительное пространственное расположение атомов. [5] [6] Примерами последних являются энантиомеры , молекулы которых являются зеркальным отражением друг друга, а также цис- и транс- версии 2-бутена .
Среди структурных изомеров можно выделить несколько классов, включая скелетные изомеры , позиционные изомеры (или региоизомеры ), функциональные изомеры , таутомеры и структурные топоизомеры . [7]
Скелетная изомерия
[ редактировать ]Скелетный изомер соединения — это структурный изомер, отличающийся от него атомами и связями, которые считаются составляющими «скелет» молекулы. Для органических соединений , таких как алканы , это обычно означает атомы углерода и связи между ними.
Например, существует три скелетных изомера пентана : н -пентан (часто называемый просто «пентан»), изопентан (2-метилбутан) и неопентан (диметилпропан). [8]
 |  | |
| н - Пентан | изопентан | Неопентан |
Если скелет ациклический , как в приведенном выше примере, можно использовать термин цепная изомерия .
Позиционная изомерия (региоизомерия)
[ редактировать ]Позиционные изомеры (также позиционные изомеры или региоизомеры ) представляют собой структурные изомеры, которые можно рассматривать как различающиеся только положением функциональной группы , заместителя или какого-либо другого признака в одной и той же «родительской» структуре. [9]
Например, замена одного из 12 атомов водорода –H на гидроксильную группу –OH в исходной молекуле н -пентана может дать любой из трех различных изомеров положения:
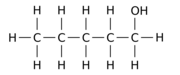 | 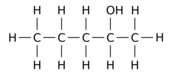 | 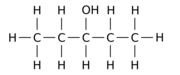 |
| Пентан-1-ол | Пентан-2-ол | Пентан-3-ол |
Другим примером региоизомеров являются α-линоленовая и γ-линоленовая кислоты , обе октадекатриеновые кислоты , каждая из которых имеет три двойные связи, но в разных положениях цепи.
Функциональная изомерия
[ редактировать ]Функциональные изомеры — это структурные изомеры, которые имеют разные функциональные группы , что приводит к существенно различным химическим и физическим свойствам. [10]
Примером может служить пара пропаналь H 3 C–CH 2 –C(=O)-H и ацетон H 3 C–C(=O)–CH 3 : первый имеет функциональную группу –C(=O)H, которая делает его альдегидом , тогда как второй имеет группу C–C(=O)–C, что делает его кетоном .
Другой пример – пара этанол H 3 C–CH 2 –OH ( спирт ) и диметиловый эфир H 3 C–O–CH 2 H ( эфир ). Напротив, 1-пропанол и 2-пропанол являются структурными, но не функциональными изомерами, поскольку они имеют одну и ту же значительную функциональную группу ( гидроксил –ОН) и оба являются спиртами.
Помимо разного химического состава, функциональные изомеры обычно имеют очень разные инфракрасные спектры . Инфракрасный спектр во многом определяется режимами колебаний молекулы, а функциональные группы, такие как гидроксилы и сложные эфиры, имеют совершенно разные режимы колебаний. Таким образом, 1-пропанол и 2-пропанол имеют относительно схожие инфракрасные спектры из-за гидроксильной группы, которая сильно отличается от спектра метилэтилового эфира. [ нужна ссылка ]
Структурные изотопомеры
[ редактировать ]В химии обычно игнорируют различия между изотопами одного и того же элемента. Однако в некоторых ситуациях (например, в рамановской , ЯМР или микроволновой спектроскопии ) можно рассматривать разные изотопы одного и того же элемента как разные элементы. Во втором случае две молекулы с одинаковым числом атомов каждого изотопа, но разными схемами связи называются структурными изотопомерами .
Так, например, у этилена в первой интерпретации не было бы структурных изомеров; но заменив два атома водорода ( 1 H) атомами дейтерия ( 2 H) может давать любой из двух структурных изотопомеров (1,1-дидейтероэтен и 1,2-дидейтероэтен), если оба атома углерода являются одним и тем же изотопом. Если, кроме того, два углерода представляют собой разные изотопы (скажем, 12 С и 13 C), будет три различных структурных изотопомера, поскольку 1- 13 C-1,1-дидейтероэтен будет отличаться от 1- 13 C-2,2-дидейтероэтен.) И в обоих случаях 1,2-дидейтероструктурный изотопомер будет существовать в виде двух стереоизотопомеров, цис и транс .
Структурная эквивалентность и симметрия
[ редактировать ]Структурная эквивалентность
[ редактировать ]Две молекулы (включая многоатомные ионы) A и B имеют одинаковую структуру , если каждый атом A может быть соединен в пару с атомом B того же элемента взаимно однозначным образом, так что для каждой связи в A существует связь в B того же типа между соответствующими атомами; и наоборот. [3] Это требование распространяется и на сложные связи, включающие три и более атомов, например делокализованную связь в молекуле бензола и других ароматических соединений.
В зависимости от контекста может потребоваться, чтобы каждый атом был соединен с атомом того же изотопа, а не только одного и того же элемента.
Тогда можно сказать, что две молекулы являются структурными изомерами (или, если изотопы имеют значение, структурными изотопомерами), если они имеют одинаковую молекулярную формулу, но не имеют одинаковую структуру.
Структурная симметрия и эквивалентные атомы
[ редактировать ]Структурную симметрию молекулы можно определить математически как перестановку атомов, которая заменяет по крайней мере два атома, но не меняет структуру молекулы. Тогда можно сказать, что два атома структурно эквивалентны , если существует структурная симметрия, которая приводит один к другому. [11]
Так, например, все четыре атома водорода метана структурно эквивалентны, поскольку любая их перестановка сохранит все связи молекулы.
Аналогично, все шесть атомов водорода этана ( C
22Ч
6 ) структурно эквивалентны друг другу, как и два атома углерода; потому что любой водород можно заменить на любой другой, либо с помощью перестановки, которая заменяет только эти два атома, либо с помощью перестановки, которая заменяет два атома углерода и каждый водород в одной метильной группе на другой водород в другой метильной группе. Любая операция сохраняет структуру молекулы. То же самое относится и к атомам водорода: циклопентана , аллена , 2-бутина , гексаметилентетрамина , призмана , кубана , додекаэдрана и т. д.
атомы водорода пропана С другой стороны, не все структурно эквивалентны. Шесть атомов водорода, присоединенных к первому и третьему атомам углерода, эквивалентны, как в этане, а два атома водорода, присоединенные к среднему атому углерода, эквивалентны друг другу; нет эквивалентности но между этими двумя классами эквивалентности .
Симметрия и позиционная изомерия
[ редактировать ]Структурная эквивалентность атомов родительской молекулы уменьшает количество позиционных изомеров, которые можно получить, заменяя эти атомы другим элементом или группой. Так, например, структурная эквивалентность шести атомов водорода этана C
22Ч
6 означает, что существует только один структурный изомер этанола C.
22Ч
5 OH , а не 6. Восемь атомов водорода пропана C
3 H
8 разделены на два класса структурной эквивалентности (шесть по метильным группам и два по центральному углероду); поэтому существует только два позиционных изомера пропанола ( 1-пропанол и 2-пропанол ). Точно так же существует только два позиционных изомера бутанола и три пентанола или гексанола .
Нарушение симметрии заменами
[ редактировать ]После замены в родительской молекуле ее структурная симметрия обычно снижается, а это означает, что атомы, которые раньше были эквивалентными, могут перестать быть таковыми. Таким образом, замена двух или более эквивалентных атомов одним и тем же элементом может привести к образованию более одного позиционного изомера.
Классический пример — производные бензола . Его шесть атомов водорода структурно эквивалентны, как и шесть атомов углерода; потому что структура не меняется, если атомы переставляются таким образом, что это соответствует перевороту молекулы или ее повороту на угол, кратный 60 градусам. Следовательно, замена любого водорода хлором дает только один хлорбензол . Однако после этой замены перестановки атомов, которые переместили этот водород, больше не действительны. Остается только одна перестановка, которая соответствует перевороту молекулы при сохранении хлора фиксированным. Пять оставшихся атомов водорода тогда попадают в три разных класса эквивалентности: тот, который противоположен хлору, представляет собой отдельный класс (называемый пара -положением), два самых близких к хлору образуют другой класс ( орто ), а оставшиеся два являются третьим. класс ( мета ). второе замещение водорода хлором может дать три позиционных изомера: 1,2- или орто- . , 1,3- или мета- Таким образом , и 1,4- или пара -дихлорбензол .
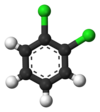 |  | 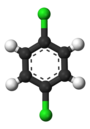 |
| орто -дихлорбензол | мета -дихлорбензол | пара -Дихлорбензол |
| 1,2-Дихлорбензол | 1,3-Дихлорбензол | 1,4-дихлорбензол |
По этой же причине существует только один фенол (гидроксибензол), но три бензолдиола ; и один толуол (метилбензол), но три толуола и три ксилола .
С другой стороны, вторая замена (тем же заместителем) может сохранить или даже повысить симметрию молекулы и, таким образом, может сохранить или уменьшить число классов эквивалентности для следующей замены. Таким образом, четыре оставшихся водорода в мета -дихлорбензоле по-прежнему относятся к трем классам, орто- – к двум, а атомы пара- снова эквивалентны. Тем не менее, некоторые из этих замен 3 + 2 + 1 = 6 в конечном итоге дают одну и ту же структуру, поэтому существует только три структурно различных трихлорбензола : 1,2,3- , 1,2,4- и 1,3,5-. .
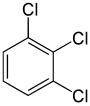 |  | 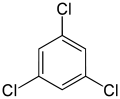 |
| 1,2,3-Трихлорбензол | 1,2,4-Трихлорбензол | 1,3,5-Трихлорбензол |
Если заместители на каждой стадии разные, структурных изомеров обычно будет больше. Ксиленол , который представляет собой бензол с одним гидроксильным заместителем и двумя метильными заместителями, имеет в общей сложности 6 изомеров:
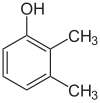 | 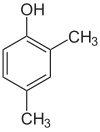 | 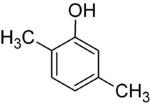 |
| 2,3-ксиленол | 2,4-ксиленол | 2,5-ксиленол |
 |  | 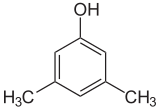 |
| 2,6-ксиленол | 3,4-ксиленол | 3,5-ксиленол |
Перечисление и подсчет изомеров
[ редактировать ]Перечисление или подсчет структурных изомеров в целом представляет собой сложную задачу, поскольку необходимо учитывать несколько типов связей (в том числе делокализованные), циклические структуры и структуры, которые невозможно реализовать из-за валентных или геометрических ограничений, а также неразделяемые таутомеры.
Например, существует девять структурных изомеров с молекулярной формулой C 3 H 6 O, имеющих различную связность связей. Семь из них устойчивы на воздухе при комнатной температуре, они приведены в таблице ниже.
| Химическое соединение | Молекулярная структура | плавление точка (°С) | Кипение точка (°С) | Комментарий |
|---|---|---|---|---|
| Аллиловый спирт | –129 | 97 | ||
| Циклопопропанол | 101–102 | |||
| Пропиональдегид | –81 | 48 | Таутомерный с проп-1-ен-1-олом, который имеет как цис-, так и транс- стереоизомерные формы. | |
| Ацетон | 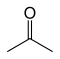 | –94.9 | 56.53 | Таутомерный с пропен-2-олом |
| оксетан | –97 | 48 | ||
| оксид пропилена | –112 | 34 | Имеет две энантиомерные формы | |
| Метилвиниловый эфир | –122 | 6 |
Два структурных изомера представляют собой енольные таутомеры карбонильных изомеров (пропиональдегида и ацетона), но они нестабильны. [12]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «Конституционная изомерия» . Золотая книга ИЮПАК . ИЮПАК. 2014. doi : 10.1351/goldbook.C01285 . Проверено 19 июля 2018 г.
- ^ Фредерик А. Беттельхейм, Уильям Х. Браун, Мэри К. Кэмпбелл, Шон О. Фаррелл (2009): Введение в органику и биохимию . 752 страницы. ISBN 9780495391166
- ^ Jump up to: а б Питер П. Мумба (2018): Полезные принципы химии для студентов, изучающих сельское хозяйство и медсестер , 2-е издание. 281 страница. ISBN 9781618965288
- ^ Jump up to: а б Уильям Ф. Байнум, Э. Джанет Браун, Рой Портер (2014): Словарь истории науки . 530 страниц. ISBN 9781400853410
- ^ Джим Кларк (2000). «Структурная изомерия» в Chemguide , Нидерланды.
- ^ Поппе, Ласло; Надь, Йожеф; Хорнянски, Габор; Борос, Золтан; Михай, Ногради (2016). Стереохимия и стереоселективный синтез: Введение . Вайнхайм, Германия: Wiley-VCH. стр. 26–27. ISBN 978-3-527-33901-3 .
- ^ Д. Бринн Хибберт, А. М. Джеймс (1987): Химический словарь Macmillan . 532 страницы. ISBN 9781349188178
- ^ Зденек Сланина (1986): Современная теория химической изомерии . 254 страницы. ISBN 9789027717078
- ^ Х. Стивен Стокер (2015): Общая, органическая и биологическая химия , 7-е издание. 1232 страницы. ISBN 9781305686182
- ^ Барри Г. Хинвуд (1997): Учебник науки для работников здравоохранения . 489 страниц. ISBN 9780748733774
- ^ Жан-Лу Фаулон, Андреас Бендер (2010): Справочник по алгоритмам хемоинформатики . 454 страницы. ISBN 9781420082999
- ^ Справочник CRC по химии и физике, 65-е изд.