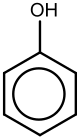
Фенол
| |||
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Фенол [1] | |||
| Систематическое название ИЮПАК Бензенол | |||
Другие имена
| |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ЧЭБИ | |||
| ЧЕМБЛ | |||
| ХимическийПаук | |||
| Лекарственный Банк | |||
| Информационная карта ECHA | 100.003.303 | ||
| КЕГГ | |||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
| Число | 2821 (решение) 2312 (расплавленный) 1671 (сплошной) | ||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| С 6 Н 6 О | |||
| Молярная масса | 94.113 g/mol | ||
| Появление | Прозрачное кристаллическое твердое вещество | ||
| Запах | Сладкий и терпкий | ||
| Плотность | 1,07 г/см 3 | ||
| Температура плавления | 40,5 ° C (104,9 ° F; 313,6 К) | ||
| Точка кипения | 181,7 ° С (359,1 ° F; 454,8 К) | ||
| 8,3 г/100 мл (20 °С) | |||
| войти P | 1.48 [2] | ||
| Давление пара | 0,4 мм рт.ст. (20 °С) [3] | ||
| Кислотность ( pKa ) |
| ||
| Сопряженная база | Феноксид | ||
| УФ-видимое излучение (λ макс .) | 270,75 нм [5] | ||
| 1,224 Д | |||
| Фармакология | |||
| C05BB05 ( ВОЗ ) D08AE03 ( ВОЗ ), N01BX03 ( ВОЗ ), R02AA19 ( ВОЗ ) | |||
| Опасности | |||
| СГС Маркировка : | |||
   [6] [6] | |||
| Опасность | |||
| Х301 , Х311 , Х314 , Х331 , Х341 , Х373 [6] | |||
| П261 , П280 , П301+П310 , П305+П351+П338 , П310 [6] | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 79 ° С (174 ° F; 352 К) | ||
| Взрывоопасные пределы | 1.8–8.6% [3] | ||
| Летальная доза или концентрация (LD, LC): | |||
ЛД 50 ( средняя доза ) |
| ||
LD Lo ( самый низкий опубликованный ) |
| ||
ЛК 50 ( средняя концентрация ) |
| ||
| NIOSH (пределы воздействия на здоровье в США): | |||
МЕХ (Допускается) | СВВ 5 частей на миллион (19 мг/м 3 ) [кожа] [3] | ||
РЕЛ (рекомендуется) |
| ||
IDLH (Непосредственная опасность) | 250 частей на миллион [3] | ||
| Паспорт безопасности (SDS) | [1] | ||
| Родственные соединения | |||
Родственные соединения | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Фенол (также известный как карболовая кислота , фенольная кислота или бензол ) представляет собой ароматическое органическое соединение с молекулярной формулой С 6 Н 5 ОН . [5] Это белое кристаллическое вещество , летучее . Молекула состоит из фенильной группы ( −C 6 H 5 ), связанный с гидроксильной группой ( -ОХ ). Умеренно кислый , он требует осторожного обращения, поскольку может вызвать химические ожоги . [5]
Фенол сначала был извлечен из каменноугольной смолы , но сегодня производится в больших масштабах (около 7 миллионов тонн в год) из нефтяного сырья. Это важный промышленный товар как предшественник многих материалов и полезных соединений. [8] В основном его используют для синтеза пластмасс и родственных материалов. Фенол и его химические производные необходимы для производства поликарбонатов , эпоксидных смол , взрывчатых веществ , бакелита , нейлона , моющих средств , гербицидов , таких как феноксигербициды , и многочисленных фармацевтических препаратов . [9]
Характеристики
[ редактировать ]Фенол представляет собой органическое соединение, хорошо растворимое в воде, около 84,2 г которого растворяется в 1000 мл (0,895 М ). Возможны гомогенные смеси фенола и воды при массовом соотношении фенола и воды ~2,6 и выше. Натриевая соль фенола, феноксид натрия , гораздо лучше растворима в воде. Это горючее твердое вещество (рейтинг NFPA = 2). При нагревании фенол выделяет легковоспламеняющиеся пары, взрывоопасные при концентрации в воздухе от 3 до 10%. Для тушения фенольных пожаров следует использовать углекислотные или сухие химические огнетушители. [5]
Кислотность
[ редактировать ]Фенол – слабая кислота (рН 6,6). В водном растворе в диапазоне pH ок. 8 - 12 находится в равновесии с фенолят- анионом. С 6 Н 5 О − (также называемый феноксидом или карболатом ): [10]

Фенол более кислый, чем алифатические спирты. Его повышенная кислотность объясняется резонансной стабилизацией фенолят - аниона. Таким образом, отрицательный заряд кислорода делокализуется на орто- и параатомах углерода через пи-систему. [11] Альтернативное объяснение включает в себя сигма-структуру, постулирующую, что доминирующим эффектом является индукция со стороны более электроотрицательного sp. 2 гибридизованные углероды ; сравнительно более мощный индуктивный отвод электронной плотности, обеспечиваемый sp 2 система по сравнению с sp 3 Система позволяет добиться значительной стабилизации оксианиона. В подтверждение второго объяснения p K a енола K ацетона a в воде составляет 10,9, что делает его лишь немного менее кислым, чем фенол (p 10,0 ) . [5] Таким образом, большее количество резонансных структур, доступных феноксиду по сравнению с енолятом ацетона, по-видимому, мало способствует его стабилизации. Однако ситуация меняется при исключении эффектов сольватации.
Водородная связь
[ редактировать ]В четыреххлористом углероде и в алкановых растворителях фенол образует водородные связи с широким спектром оснований Льюиса, таких как пиридин , диэтиловый эфир и диэтилсульфид . Энтальпии образования аддукта и −OH , сопровождающие образование аддукта. Сопоставлены ИК-частотные сдвиги [12] Фенол классифицируется как жесткая кислота . [13] [14]
Таутомерия
[ редактировать ]
Фенол демонстрирует кето-еноловую таутомерию с его нестабильным кето-таутомером циклогексадиеноном, но эффект практически незначителен. Константа равновесия енолизации составляет примерно 10 −13 Это означает, что только одна из каждых десяти триллионов молекул в любой момент находится в кето-форме. [15] Небольшая степень стабилизации, полученная при замене связи C=C на связь C=O, более чем компенсируется значительной дестабилизацией, возникающей в результате потери ароматичности. Таким образом, фенол существует по существу исключительно в енольной форме. [16] 4,4'-Замещенный циклогексадиенон может подвергаться диенон-фенольной перегруппировке в кислых условиях с образованием стабильного 3,4-дизамещенного фенола. [17]
Для замещенных фенолов несколько факторов могут способствовать образованию кетотаутомера: (а) дополнительные гидроксильные группы (см. резорцин ) (б) аннелирование, как при образовании нафтолов , и (в) депротонирование с образованием фенолята. [18]
Феноксиды представляют собой еноляты, стабилизированные по ароматичности . В нормальных условиях феноксид более реакционноспособен в положении кислорода, но положение кислорода является «жестким» нуклеофилом, тогда как положения альфа-углерода имеют тенденцию быть «мягкими». [19]
Реакции
[ редактировать ]

Фенол очень активен в отношении электрофильного ароматического замещения . Повышенная нуклеофильность объясняется передачей pi-электронной плотности из O в кольцо. Многие группы могут быть присоединены к кольцу посредством галогенирования , ацилирования , сульфирования и родственных процессов.
Фенол настолько сильно активируется, что бромирование и хлорирование легко приводят к полизамещению. [20] В результате реакции образуются 2- и 4-замещенные производные. Региохимия галогенирования меняется в сильнокислых растворах, где PhOH 2 ] + преобладает. Фенол реагирует с разбавленной азотной кислотой при комнатной температуре с образованием смеси 2-нитрофенола и 4-нитрофенола, тогда как с концентрированной азотной кислотой вводятся дополнительные нитрогруппы, например, с образованием 2,4,6-тринитрофенола . Алкилирование фенола и его производных по Фриделю Крафту часто протекает без катализаторов. Алкилирующие агенты включают алкилгалогениды, алкены и кетоны. Так, адамантил-1-бромид , дициклопентадиен ) и циклогексаноны дают соответственно 4-адамантилфенол, бис(2-гидроксифенил)производное и 4-циклогексилфенолы. Спирты и гидропероксиды алкилируют фенолы в присутствии твердых кислотных катализаторов (например, некоторых цеолитов ). Таким способом можно получать крезолы и кумилфенолы. [21]
Водные растворы фенола слабокислые и слегка окрашивают лакмус из синего в красный. Фенол нейтрализуется гидроксидом натрия с образованием фената или фенолята натрия, но, будучи более слабым, чем угольная кислота , он не может быть нейтрализован бикарбонатом натрия или карбонатом натрия с выделением углекислого газа .
- C 6 H 5 OH + NaOH → C 6 H 5 ONa + H 2 O
смеси фенола и бензоилхлорида При встряхивании гидроксида натрия в присутствии разбавленного раствора фенилбензоат образуется . Это пример реакции Шоттена-Баумана :
- C 6 H 5 COCl + HOC 6 H 5 → C 6 H 5 CO 2 C 6 H 5 + HCl
Фенол восстанавливается до бензола при перегонке его с цинковой пылью или при пропускании его паров над гранулами цинка при температуре 400°С: [22]
- C 6 H 5 OH + Zn → C 6 H 6 + ZnO
При обработке фенола диазометаном в присутствии трифторида бора ( BF 3 ) анизол получают в качестве основного продукта и газообразный азот в качестве побочного продукта.
- C 6 H 5 OH + CH 2 N 2 → C 6 H 5 OCH 3 + N 2
Фенол и его производные реагируют с хлоридом железа(III) с образованием интенсивно окрашенных растворов, содержащих феноксидные комплексы.
Производство
[ редактировать ]Из-за коммерческой важности фенола было разработано множество методов его производства, но доминирующей технологией является кумоловый процесс.
Общий процесс
[ редактировать ]
На долю 95% производства (2003 г.) приходится кумоловый процесс , также называемый процессом Хока . Он включает частичное окисление кумола ( изопропилбензола ) посредством перегруппировки Хока : [8] По сравнению с большинством других процессов, при производстве кумола используются мягкие условия и недорогое сырье. Чтобы процесс был экономичным, как фенол, так и побочный продукт ацетон должны быть востребованы. [23] [24] В 2010 году мировой спрос на ацетон составил около 6,7 миллиона тонн, 83 процента из которых было удовлетворено ацетоном, полученным кумоловым процессом.
Путь, аналогичный кумоловому процессу, начинается с циклогексилбензола . Он окисляется до гидропероксида , аналогично производству гидропероксида кумола . В результате перегруппировки Хока гидропероксид циклогексилбензола расщепляется с образованием фенола и циклогексанона . Циклогексанон является важным предшественником некоторых нейлонов . [25]
Окисление бензола, толуола, циклогексилбензола
[ редактировать ]Прямое окисление бензола ( C 6 H 6 ) в фенол теоретически возможен и представляет большой интерес, но не получил коммерческого применения:
- С 6 Н 6 + О → С 6 Н 5 ОН
Закись азота является потенциально «зеленым» окислителем, который является более сильным окислителем, чем O 2 . Однако маршруты производства закиси азота остаются неконкурентоспособными. [26] [23] [25]
Электросинтез дает с использованием переменного тока фенол из бензола. [27]
Окисление толуола , разработанное Dow Chemical , включает катализируемую медью реакцию расплавленного бензоата натрия с воздухом:
- C 6 H 5 CH 3 + 2 O 2 → C 6 H 5 OH + CO 2 + H 2 O
Предполагается, что реакция протекает через образование бензиоилсалицилата. [8]
Автоокисление циклогексилбензола дает гидропероксид . Разложение этого гидропероксида дает циклогексанон и фенол. [8]
Старые методы
[ редактировать ]Ранние методы основывались на экстракции фенола из производных угля или гидролизе производных бензола.
Гидролиз бензолсульфоновой кислоты
[ редактировать ]Оригинальный коммерческий маршрут был разработан компаниями Bayer и Monsanto в начале 1900-х годов на основе открытий Вюрца и Кекуле. Метод включает реакцию сильного основания с бензолсульфоновой кислотой , протекающую по реакции гидроксида с бензолсульфонатом натрия с образованием феноксида натрия. Подкисление последнего дает фенол. Чистая конверсия равна: [28]
- C 6 H 5 SO 3 H + 2 NaOH → C 6 H 5 OH + Na 2 SO 3 + H 2 O
Гидролиз хлорбензола
[ редактировать ]Хлорбензол можно гидролизовать до фенола с использованием основания ( процесс Доу ) или пара ( процесс Рашига-Хукера ): [24] [25] [29]
- C 6 H 5 Cl + NaOH → C 6 H 5 OH + NaCl
- C 6 H 5 Cl + H 2 O → C 6 H 5 OH + HCl
Недостатком этих методов является стоимость хлорбензола и необходимость утилизации побочного хлорида.
Пиролиз угля
[ редактировать ]Фенол также является извлекаемым побочным продуктом пиролиза угля . [29] В процессе Ламмуса окисление толуола до бензойной кислоты проводится отдельно.
Разные методы
[ редактировать ]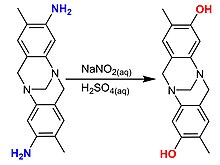
Соли фенилдиазония гидролизуются до фенола. Коммерческого интереса метод не представляет, поскольку прекурсор дорог. [30]
Салициловая кислота декарбоксилируется до фенола. [31]
Использование
[ редактировать ]Основное применение фенола, на которое приходится две трети его производства, связано с его переработкой в прекурсоры для производства пластмасс. Конденсация с ацетоном дает бисфенол-А , ключевой предшественник поликарбонатов и эпоксидных смол. Конденсация фенола, алкилфенолов [ нужна ссылка ] , или дифенолы [ нужна ссылка ] с формальдегидом дает фенольные смолы , известным примером которых является бакелит . Частичное гидрирование фенола дает циклогексанон , [32] предшественник нейлона . Неионогенные моющие средства производятся путем алкилирования фенола с образованием алкилфенолов , например нонилфенола , которые затем подвергаются этоксилированию . [8]
Фенол также является универсальным предшественником большого количества лекарств, в первую очередь аспирина , а также многих гербицидов и фармацевтических препаратов . Фенол является компонентом метода жидкостно-жидкостной фенол-хлороформной экстракции, используемого в молекулярной биологии для получения нуклеиновых кислот из тканей или образцов клеточных культур. В зависимости от pH раствора ДНК или РНК можно экстрагировать .
Фенол настолько недорог, что его также привлекают многие мелкие применения. Входит в состав промышленных средств для снятия краски, используемых в авиационной промышленности для удаления эпоксидных, полиуретановых и других химически стойких покрытий. [33] Из соображений безопасности фенол запрещен к использованию в косметической продукции в Европейском Союзе. [34] [35] и Канада . [36] [37]
Медицинский
[ редактировать ]Фенол широко применялся как антисептик , его применяют при производстве карболового мыла . Концентрированные фенольные жидкости используются для постоянного лечения вросших ногтей на ногах и руках — процедура, известная как химическая матриксэктомия . Процедура была впервые описана Отто Боллом в 1945 году. С тех пор фенол стал предпочтительным химикатом для химической матрэктомии, выполняемой ортопедами.
Концентрированный жидкий фенол можно использовать местно в качестве местного анестетика при отологических процедурах, таких как миринготомия и установка тимпанотомической трубки, в качестве альтернативы общей анестезии или другим местным анестетикам. Он также обладает кровоостанавливающими и антисептическими свойствами, что делает его идеальным для такого применения. Феноловый спрей, обычно содержащий 1,4% фенола в качестве активного ингредиента, используется в медицине для лечения боли в горле. [38] Это активный ингредиент некоторых пероральных анальгетиков, таких как хлорасептический спрей, TCP и Carmex . [39]
История
[ редактировать ]
Фенол был открыт в 1834 году Фридлибом Фердинандом Рунге , который извлек его (в нечистом виде) из каменноугольной смолы . [41] Рунге назвал фенол «Karbolsäure» (угольно-масляная кислота, карболовая кислота). Каменноугольная смола оставалась основным источником до развития нефтехимической промышленности . Французский химик Огюст Лоран выделил фенол в чистом виде как производное бензола в 1841 году. [42] В 1836 году Огюст Лоран придумал название бензола «фен»; [43] это корень слов «фенол» и « фенил ». В 1843 году французский химик Шарль Герхардт придумал название «фенол». [44]
Антисептические в его свойства фенола были использованы сэром Джозефом Листером новаторской технике антисептической хирургии. Листер решил, что раны необходимо тщательно промыть. Затем он закрыл раны куском тряпки или ворса. [45] покрыты фенолом. Раздражение кожи, вызванное постоянным воздействием фенола, в конечном итоге привело к внедрению асептических (безмикробных) методов в хирургии. Работа Листера была вдохновлена работами и экспериментами его современника Луи Пастера по стерилизации различных биологических сред. Он предположил, что если микробы можно будет убить или предотвратить, заражения не произойдет. Листер предположил, что химическое вещество можно использовать для уничтожения микроорганизмов, вызывающих инфекцию. [46]
Тем временем в Карлайле , Англия, чиновники экспериментировали с очисткой сточных вод с использованием карболовой кислоты, чтобы уменьшить запах канализационных выгребных ям . Услышав об этих разработках и ранее без особого успеха экспериментируя с другими химическими веществами в антисептических целях, Листер решил попробовать карболовую кислоту в качестве антисептика для ран. Первый шанс у него появился 12 августа 1865 года, когда он принял пациента: одиннадцатилетнего мальчика с переломом большеберцовой кости, пронзившим кожу голени. Обычно ампутация была бы единственным решением. Однако Листер решил попробовать карболовую кислоту. Вправив кость и подкрепив ногу шинами, он пропитал чистые хлопчатобумажные полотенца неразбавленной карболовой кислотой и приложил их к ране, накрыв слоем оловянной фольги, оставив на четыре дня. Осмотрев рану, Листер был приятно удивлен, не обнаружив никаких признаков инфекции, только покраснение по краям раны от легкого жжения карболовой кислотой. Повторно наложив свежие повязки с разбавленной карболовой кислотой, мальчик смог вернуться домой примерно через шесть недель лечения. [47]
К 16 марта 1867 года, когда первые результаты работы Листера были опубликованы в журнале «Ланцет», он вылечил в общей сложности одиннадцать пациентов, используя свой новый антисептический метод. Из них только один умер, и то из-за осложнения, не связанного с техникой перевязки ран Листера. Теперь впервые пациенты со сложными переломами могли покинуть больницу с целыми конечностями.
- - Ричард Холлингем, Кровь и кишки: история хирургии , с. 62 [47]
До того, как в больнице начали проводить антисептические операции, в тридцати пяти хирургических случаях было зарегистрировано шестнадцать смертей. Почти каждый второй пациент умер. После того, как летом 1865 года была введена антисептическая хирургия, в сорока случаях было всего шесть смертей. Уровень смертности снизился с почти 50 процентов до примерно 15 процентов. Это было выдающееся достижение
- - Ричард Холлингем, Кровь и кишки: история хирургии , с. 63 [48]
Фенол был основным ингредиентом «карболового дымового шара», неэффективного устройства, продававшегося в Лондоне в 19 веке для защиты от гриппа и других заболеваний, а также предметом знаменитого судебного дела « Карлилл против компании Carbolic Smoke Ball» .
Вторая мировая война
[ редактировать ]Токсическое действие фенола на центральную нервную систему вызывает внезапный коллапс и потерю сознания как у людей, так и у животных; Этим симптомам предшествует состояние судорог из-за двигательной активности, контролируемой центральной нервной системой. [49] Инъекции фенола использовались в качестве средства индивидуальной казни в нацистской Германии во время Второй мировой войны . [50] Первоначально он использовался нацистами в 1939 году в рамках массового убийства инвалидов в рамках Акции Т4 . [51] Немцы узнали, что уничтожение небольших групп более экономично, если вводить фенол каждой жертве. Инъекции фенола были сделаны тысячам людей. Максимилиан Кольбе также был убит инъекцией фенола после того, как он пережил две недели обезвоживания и голодания в Освенциме , когда он вызвался умереть вместо незнакомца . Примерно одного грамма достаточно, чтобы вызвать смерть. [52]
События
[ редактировать ]Фенол является нормальным продуктом обмена веществ, выводится в количестве до 40 мг/л с мочой человека. [49] Секреция височных желез самцов слонов- показала присутствие фенола и 4-метилфенола во время сусла . [53] [54] Это также одно из химических соединений, содержащихся в кастореуме . Это соединение попадает в организм из растений, которые едят бобр. [55]
Фенол является измеримым компонентом аромата и вкуса характерного шотландского виски с острова Айлей . [56] обычно ~30 ppm , оно может превышать 160 ppm , но в солодовом ячмене, используемом для производства виски . [57] Это количество отличается от количества в дистилляте и предположительно превышает его. [56]
Биодеградация
[ редактировать ]Cryptanaerobacterphenolicus — это вид бактерий, который производит бензоат из фенола через 4-гидроксибензоат . [58] Rhodococcusphenolicus — это вид бактерий, способный разлагать фенол как единственный источник углерода. [59]
Токсичность
[ редактировать ]Фенол и его пары разъедают глаза, кожу и дыхательные пути. [60] Его разъедающее действие на кожу и слизистые оболочки обусловлено белково-дегенеративным действием. [49] Повторный или длительный контакт кожи с фенолом может вызвать дерматит или даже ожоги второй и третьей степени. [61] Вдыхание паров фенола может вызвать отек легких . [60] Вещество может оказывать вредное воздействие на центральную нервную систему и сердце, приводя к аритмии , судорогам и коме . [62] Почки . также могут быть поражены Длительное или многократное воздействие вещества может оказать вредное воздействие на печень и почки . [63] Нет никаких доказательств того, что фенол вызывает рак у людей. [64] Помимо гидрофобных эффектов, другим механизмом токсичности фенола может быть образование феноксильных радикалов . [65]
Поскольку фенол относительно быстро всасывается через кожу, помимо местных едких ожогов может возникнуть системное отравление. [49] Резорбтивное отравление большим количеством фенола может возникнуть даже на небольшом участке кожи, быстро приводя к параличу центральной нервной системы и резкому падению температуры тела. ЛД ; 50 при пероральной токсичности составляет менее 500 мг/кг для собак, кроликов или мышей минимальная смертельная доза для человека составляла 140 мг/кг. [49] Агентство по регистрации токсичных веществ и заболеваний (ATSDR) Министерства здравоохранения и социальных служб США утверждает, что смертельная доза при приеме внутрь фенола составляет от 1 до 32 г. [66]
Химические ожоги можно кожи обеззаразить промыванием полиэтиленгликолем . [67] изопропиловый спирт , [68] или, возможно, даже обильное количество воды. [69] Требуется снять загрязненную одежду, а также немедленно обратиться в больницу в случае больших брызг. Это особенно важно, если фенол смешан с хлороформом (обычно используемая смесь в молекулярной биологии для очистки ДНК и РНК ). [ нужна ссылка ] Фенол также является репродуктивным токсином, вызывающим повышенный риск выкидыша и низкого веса при рождении, что указывает на задержку внутриутробного развития. [5]
Фенолы
[ редактировать ]Слово фенол также используется для обозначения любого соединения, которое содержит шестичленное ароматическое кольцо, непосредственно связанное с гидроксильной группой (-ОН). Таким образом, фенолы представляют собой класс органических соединений , простейшим представителем которого является фенол, обсуждаемый в этой статье.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «Фронт материи». Номенклатура органической химии: рекомендации ИЮПАК и предпочтительные названия 2013 г. (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 690. doi : 10.1039/9781849733069-FP001 (неактивен 14 апреля 2024 г.). ISBN 978-0-85404-182-4 .
сохранено только одно название, фенол, как в качестве предпочтительного названия, так и для общей номенклатуры. Для C 6 H 5 -OH
{{cite book}}: CS1 maint: DOI неактивен по состоянию на апрель 2024 г. ( ссылка ) - ^ «Фенол_мсдс» .
- ^ Перейти обратно: а б с д и Карманный справочник NIOSH по химическим опасностям. «#0493» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Кютт, Агнес; Мовчун, Валерия; Родима, Тоомас; и др. (2008). «Пентакис (трифторметил) фенил, стерически переполненная и электроноакцепторная группа: синтез и кислотность пентакис (трифторметил) бензола, -толуола, -фенола и -анилина». Журнал органической химии . 73 (7): 2607–20. дои : 10.1021/jo702513w . ПМИД 18324831 .
- ^ Перейти обратно: а б с д и ж «Фенол» . PubChem, Национальная медицинская библиотека США. 10 июня 2023 г. Проверено 12 июня 2023 г.
- ^ Перейти обратно: а б с Сигма-Олдрич Ко. , Фенол . Проверено 15 февраля 2022 г.
- ^ Перейти обратно: а б с «Фенол» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Перейти обратно: а б с д и Вебер, Манфред; Вебер, Маркус; Кляйне-Бойманн, Майкл (2004). "Фенол". Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a19_299.pub3 . ISBN 978-3527306732 .
- ^ Цви Раппопорт, изд. (2003). Химия фенолов . Химия функциональных групп ПАТАИ. Джон Уайли и сыновья. дои : 10.1002/0470857277 . ISBN 9780470857274 .
- ^ Смит, Майкл Б.; Марч, Джерри (2007), Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Органическая химия 2-е изд. Джон Макмерри ISBN 0-534-07968-7
- ^ Драго, Р. С. Физические методы для химиков (Saunders College Publishing, 1992), ISBN 0-03-075176-4
- ^ Лоуренс, К. и Гал, Дж.Ф. Шкалы основности и сродства Льюиса, данные и измерения, (Wiley 2010), стр. 50–51, ISBN 978-0-470-74957-9
- ^ Крамер, Р.Э.; Бопп, Т.Т. (1977). «Графическое отображение энтальпий образования аддуктов кислот и оснований Льюиса». Журнал химического образования . 54 : 612–613. дои : 10.1021/ed054p612 . На графиках, показанных в этой статье, использовались более старые параметры. Улучшенные параметры E&C перечислены в модели ECW .
- ^ Каппони, Марко; Гут, Иво Г.; Хеллрунг, Бруно; Перси, Габи; Вирц, Якоб (1999). «Равновесия кетонизации фенола в водном растворе». Может. Дж. Хим. 77 (5–6): 605–613. дои : 10.1139/cjc-77-5-6-605 .
- ^ Клейден, Джонатан ; Гривз, Ник; Уоррен, Стюарт ; Уотерс, Питер (2001). Органическая химия (1-е изд.). Издательство Оксфордского университета. п. 531. ИСБН 978-0-19-850346-0 .
- ^ Арнольд, Ричард Т.; Бакли, Джей С. (1 мая 1949 г.). «Диенонофенольная перегруппировка. II. Перегруппировка 1-кето-4-метил-4-фенил-1,4-дигидронафталина». Дж. Ам. хим. Соц . 71 (5): 1781. doi : 10.1021/ja01173a071 .
- ^ Сергей Лукьянов, Алла Коблик (2003). «Таутомерные равновесия и перегруппировки с участием фенолов». В Цви Раппопорте (ред.). Химия фенолов . Химия функциональных групп ПАТАИ. Джон Уайли и сыновья. стр. 713–838. дои : 10.1002/0470857277.ch11 . ISBN 0471497371 .
- ^ Дэвид Ю. Кертин и Аллан Р. Стейн (1966). «2,6,6-Триметил-2,4-Циклогексадион» . Органические синтезы . 46 : 115. дои : 10.15227/orgsyn.046.0115 . Архивировано из оригинала 5 июня 2011 г. Проверено 31 марта 2010 г.
- ^ Мюллер Ф., Кайлард Л. (2011). «Хлорфенолы». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a07_001.pub2 . ISBN 978-3527306732 .
- ^ В. Пракаш Редди. ГК Сурья Пракаш (2003). «Электрофильные реакции фенолов». В Цви Раппопорте (ред.). Химия фенолов . Химия функциональных групп ПАТАИ. Джон Уайли и сыновья. стр. 605–660. дои : 10.1002/0470857277.ch9 . ISBN 0471497371 .
- ^ Роско, Генри (1891). Трактат по химии, Том 3, Часть 3 . Лондон: Macmillan & Co. 23.
- ^ Перейти обратно: а б «Фенол — важная химическая промышленность в Интернете» . 11 января 2017 г. Проверено 02 января 2018 г.
- ^ Перейти обратно: а б «Прямой путь к фенолу» . Архивировано из оригинала 9 апреля 2007 г. Проверено 9 апреля 2007 г.
- ^ Перейти обратно: а б с Плоткин, Джеффри С. (21 марта 2016 г.). «Что нового в производстве фенола?» . Американское химическое общество. Архивировано из оригинала 27 октября 2019 г. Проверено 02 января 2018 г.
- ^ Пармон, В.Н.; Панов Г.И.; Уриарте, А.; Носков А.С. (2005). «Закись азота в области химии окисления и применения и производства катализа». Катализ сегодня . 100 (2005): 115–131. дои : 10.1016/j.cattod.2004.12.012 .
- ^ Ли, Бёнгик; Наито, Хирото; Нагао, Масахиро; Хибино, Такаши (9 июля 2012 г.). «Электролиз переменного тока для получения фенола из бензола». Angewandte Chemie, международное издание . 51 (28): 6961–6965. дои : 10.1002/anie.201202159 . ПМИД 22684819 .
- ^ Виткофф, Х.А., Рубен, Б.Г. Промышленные органические химикаты в перспективе. Часть первая: Сырье и производство. Уайли-Интерсайенс, Нью-Йорк. 1980.
- ^ Перейти обратно: а б Франк Х.-Г., Стадельхофер Дж. В. Промышленная ароматическая химия. Издательство Springer, Нью-Йорк. 1988. стр. 148–155.
- ^ Перейти обратно: а б Казем-Ростами, Масуд (2017). «Превращение амина в фенол». Синлетт . 28 (13): 1641–1645. дои : 10.1055/s-0036-1588180 . S2CID 99294625 .
- ^ Каединг, Уоррен В. (1 сентября 1964 г.). «Окисление ароматических кислот. IV. Декарбоксилирование салициловых кислот». Журнал органической химии . 29 (9): 2556–2559. дои : 10.1021/jo01032a016 .
- ^ Массер, Майкл Т. «Циклогексанол и циклогексанон». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a08_217.pub2 . ISBN 978-3527306732 .
- ^ «CH207 Средство для снятия краски для самолетов, фенольная кислота» (PDF) . Каллингтон. 14 октября 2009 г. Архивировано из оригинала (PDF) 23 сентября 2015 г. . Проверено 25 августа 2015 г.
- ^ «Запрещенные вещества в косметической продукции (Приложение II, № 1175, Фенол) – Европейская Комиссия» . ec.europa.eu . Проверено 6 июля 2018 г.
- ^ «CosIng – Косметика – РОСТ – Европейская Комиссия» . ec.europa.eu . Проверено 6 июля 2018 г.
- ^ Канада, Здоровье (18 июня 2004 г.). «Горячий список косметических ингредиентов — Canada.ca» . www.canada.ca . Проверено 6 июля 2018 г.
- ^ Канада, Здоровье (18 июня 2004 г.). «Горячий список косметических ингредиентов: запрещенные и ограниченные ингредиенты — Canada.ca» . www.canada.ca . Проверено 6 июля 2018 г.
- ^ «Феноловый спрей» . наркотики.com .
- ^ «Как действует наш бальзам для губ» . Кармекс . Архивировано из оригинала 18 февраля 2015 года . Проверено 18 февраля 2015 г.
- ^ «182.095 | Коллекции онлайн» . Collections.thackraymuseum.co.uk . Проверено 30 мая 2024 г.
- ^ Ф. Ф. Рунге (1834) «О некоторых продуктах перегонки угля» , Анналы физики и химии , 31 : 65-78. На странице 69 тома 31 Рунге называет фенол «карболовой кислотой» (угольно-масляная кислота, карболовая кислота). Рунге характеризует фенол в: Рунге Ф. Ф. (1834) «О некоторых продуктах перегонки каменного угля», Анналы физики и химии , 31 : 308-328.
- ^ Огюст Лоран (1841) «Мемуары о бензоле и его производных» , Annales de Chimie et de Physique , серии 3, 3 : 195-228. На странице 198 Лоран называет фенол «фенилгидратом» и «карболовой кислотой».
- ^ Огюст Лоран (1836) «О хлорфенизе, а также хлорфениновых и хлорфенезовых кислотах», Annales de Chemie et de Physique , vol. 63, с. 27–45, см . с. 44 : Я даю название фена основному радикалу предшествующих кислот (φαινω, я освещаю), так как бензин находится в газе освещения. (Я даю название «фен» (φαινω, я освещаю) основному радикалу предыдущей кислоты, потому что бензол содержится в освещающем газе.)
- ^ Герхардт, Чарльз (1843) «Исследование салицина», Annales de Chimie et de Physique , серии 3, 7 : 215-229. Герхардт придумал название «фенол» на странице 221.
- ^ Листер, Джозеф (1867). «Антисептический принцип хирургической практики» .
- ^ Холлингем, Ричард (2008). Кровь и кишки: история хирургии . Книги BBC - Random House. п. 61. ИСБН 9781407024530 .
- ^ Перейти обратно: а б Холлингем, Ричард (2008). Кровь и кишки: история хирургии . Книги BBC - Random House. п. 62. ИСБН 9781407024530 .
- ^ Холлингем, Ричард (2008). Кровь и кишки: история хирургии . Книги BBC - Randomhouse. п. 63. ИСБН 9781407024530 .
- ^ Перейти обратно: а б с д и "Фенол". Энциклопедия промышленной химии Ульмана . Том. 25. Вайли-ВЧ. 2003. стр. 589–604.
- ^ Эксперименты Питера Тайсона. НОВАЯ ЗВЕЗДА
- ^ Нацистские врачи. Архивировано 22 октября 2017 г. в Wayback Machine , Глава 14, Убийство шприцами: инъекции фенола. Доктор Роберт Джей Лифтон
- ^ «Убийство посредством инъекции фенола» . Освенцим: окончательная станция уничтожения . Линц, Австрия: Университет Иоганна Кеплера. Архивировано из оригинала 12 ноября 2006 г.
- ^ Расмуссен, ЛЕЛ; Перрин, Томас Э (1999). «Физиологические корреляты сусла». Физиология и поведение . 67 (4): 539–49. дои : 10.1016/S0031-9384(99)00114-6 . ПМИД 10549891 . S2CID 21368454 .
- ^ Муст у слонов. Дипа Анант, Печатный журнал зоопарка, 15 (5), страницы 259–262 ( статья )
- ^ Бобер: его жизнь и влияние. Дитланд Мюллер-Шварце, 2003, стр. 43 ( книга в Google Books )
- ^ Перейти обратно: а б «Торф, фенол и PPM, доктор П. Броссар» (PDF) . Проверено 27 мая 2008 г.
- ^ «Брюкладдих» . Брюхладдих . БДКЛ. Архивировано из оригинала 21 апреля 2016 года . Проверено 8 августа 2015 г.
- ^ Жуто, П.; Коте, В; Дакетт, МФ; Боде, Р; Лепин, Ф; Виллемур, Р; Бисайон, JG (2005). « Cryptanaerobacterphenolicus gen. nov., sp. nov., анаэроб, который превращает фенол в бензоат через 4-гидроксибензоат» . Международный журнал систематической и эволюционной микробиологии . 55 (Часть 1): 245–50. дои : 10.1099/ijs.0.02914-0 . ПМИД 15653882 .
- ^ Рефусс, Марк; Урбан, Джеймс (2005). « Rhodococcusphenolicus sp. nov., новый биопроцессор, выделил актиномицеты, способные разлагать хлорбензол, дихлорбензол и фенол как единственные источники углерода». Систематическая и прикладная микробиология . 28 (8): 695–701. дои : 10.1016/j.syapm.2005.05.011 . ПМИД 16261859 .
- ^ Перейти обратно: а б Будавари, С, изд. (1996). Индекс Merck: энциклопедия химикатов, лекарств и биологических препаратов . Станция Уайтхаус, Нью-Джерси: Merck .
- ^ Лин ТМ, Ли С.С., Лай К.С., Лин С.Д. (июнь 2006 г.). «Феноловый ожог». Ожоги: Журнал Международного общества ожоговых травм . 32 (4): 517–21. дои : 10.1016/j.burns.2005.12.016 . ПМИД 16621299 .
- ^ Уорнер, Массачусетс; Харпер, СП (1985). «Нарушения ритма сердца, связанные с химическим пилингом фенолом» . Анестезиология . 62 (3): 366–7. дои : 10.1097/00000542-198503000-00030 . ПМИД 2579602 .
- ^ Всемирная организация здравоохранения/Международная организация труда: Международные карты химической безопасности, http://www.inchem.org/documents/icsc/icsc/eics0070.htm
- ^ Министерство здравоохранения и социальных служб США. «Как фенол может повлиять на мое здоровье?» (PDF) . Токсикологический профиль фенола : 24.
- ^ Ханша, Корвин; Маккарнс, Сьюзен С; Смит, Карр Дж; Дулитл, Дэвид Дж. (15 июня 2000 г.). «Сравнительные доказательства QSAR свободнорадикального механизма токсичности, вызванной фенолом». Химико-биологические взаимодействия . 127 (1): 61–72. дои : 10.1016/S0009-2797(00)00171-X . ПМИД 10903419 .
- ^ «Руководство по медицинскому обращению с фенолом (C6H6O)» . Агентство по регистрации токсичных веществ и заболеваний . Министерство здравоохранения и социальных служб США. 21 октября 2014 года . Проверено 8 августа 2015 г.
- ^ Браун, ВКХ; Коробка, ВЛ; Симпсон, Би Джей (1975). «Процедуры обеззараживания кожи, подвергшейся воздействию фенольных веществ». Архивы гигиены окружающей среды . 30 (1): 1–6. дои : 10.1080/00039896.1975.10666623 . ПМИД 1109265 .
- ^ Хантер, DM; Таймеринг, БЛ; Леонард, РБ; МакКалмонт, TH; Шварц, Э. (1992). «Влияние изопропилового спирта, этанола и полиэтиленгликоля/промышленного метилового спирта при лечении острых фенольных ожогов». Анналы неотложной медицины . 21 (11): 1303–7. дои : 10.1016/S0196-0644(05)81891-8 . ПМИД 1416322 .
- ^ Пуллин, Т.Г.; Пинкертон, Миннесота; Джонстон, Р.В.; Килиан, диджей (1978). «Обеззараживание кожи свиней после воздействия фенола: сравнение относительной эффективности воды и полиэтиленгликоля/промышленного денатурата». Токсикол Appl Pharmacol . 43 (1): 199–206. дои : 10.1016/S0041-008X(78)80044-1 . ПМИД 625760 .
Внешние ссылки
[ редактировать ]- Международная карта химической безопасности 0070
- Паспорт безопасности фенола
- Национальный реестр загрязнителей: информационный бюллетень по фенолу
- Карманный справочник NIOSH по химическим опасностям
- CDC – Фенол – Тема NIOSH по безопасности и гигиене труда на рабочем месте
- Монография МАИР: «Фенол».
- Arcane Radio Trivia описывает конкурирующие способы применения фенола примерно в 1915 году.