гидрирование
| гидрирование | |
|---|---|
| Условия | |
| Катализатор | Is, Pd, Pt |
| Тип процесса | Химическая |
|---|---|
| Промышленный сектор(ы) | Пищевая промышленность, нефтехимическая промышленность , фармацевтическая промышленность, сельское хозяйство. |
| Основные технологии или подпроцессы | Различные катализаторы на основе переходных металлов, технология высокого давления. |
| Сырье | Ненасыщенные субстраты и водород или доноры водорода |
| Продукт(ы) | Насыщенные углеводороды и их производные |
| изобретатель | Поль Сабатье |
| Год изобретения | 1897 |

(1) Реагенты адсорбируются на поверхности катализатора, а H 2 диссоциирует.
(2) Атом H связан с одним атомом C. Другой атом С все еще прикреплен к поверхности.
(3) Второй атом C связан с атомом H. Молекула покидает поверхность.
Гидрирование — это химическая реакция между молекулярным водородом (H 2 ) и другим соединением или элементом, обычно в присутствии катализатора , такого как никель , палладий или платина . Этот процесс обычно используется для восстановления или насыщения органических соединений . Гидрирование обычно представляет собой присоединение пар водорода атомов к молекуле, часто алкену . Для того чтобы реакцию можно было использовать, необходимы катализаторы; некаталитическое гидрирование происходит только при очень высоких температурах. Гидрирование восстанавливает двойные и тройные связи в углеводородах . [1]
Процесс [ править ]
Гидрирование состоит из трех компонентов: ненасыщенного субстрата, водорода (или источника водорода) и, неизменно, катализатора . Реакцию восстановления проводят при различных температурах и давлениях в зависимости от субстрата и активности катализатора.
Родственные конкурирующие реакции или
Те же катализаторы и условия, которые используются для реакций гидрирования, также могут привести к из цис изомеризации алкенов в транс . Этот процесс представляет большой интерес, поскольку технология гидрогенизации генерирует большую часть трансжиров в пищевых продуктах. Реакция, при которой связи разрываются при добавлении водорода, называется гидрогенолизом . Это реакция, которая может происходить со связями углерод-углерод и углерод-гетероатом ( кислород , азот или галоген ). Некоторые гидрирования полярных связей сопровождаются гидрогенолизом.
Источники водорода [ править ]
Для гидрирования очевидным источником водорода является Сам газ H 2 , который обычно имеется в продаже в качестве носителя в баллоне под давлением. В процессе гидрирования часто используется давление более 1 атмосферы. H 2 , обычно подаваемый из баллонов и иногда дополняемый «подкачивающими насосами». Газообразный водород производится в промышленности из углеводородов с помощью процесса, известного как паровой риформинг . [2] Во многих приложениях водород переносится от молекул-доноров, таких как муравьиная кислота , изопропанол и дигидроантрацен . [3] Эти доноры водорода подвергаются дегидрированию соответственно до диоксида углерода , ацетона и антрацена . Эти процессы называются трансферным гидрированием .
Субстраты [ править ]
Важной характеристикой гидрирования алкенов и алкинов , как гомогенно, так и гетерогенно катализируемых версий, является то, что присоединение водорода происходит с помощью « син-присоединения », при этом водород поступает с наименее затрудненной стороны. [4] Эту реакцию можно проводить с множеством различных функциональных групп .
| Субстрат | Продукт | Комментарии | Теплота гидрирования (кДж/моль) [5] |
|---|---|---|---|
| Р 2 С=CR' 2 ( алкен ) | Р 2 ЧЧР' 2 (алкан) | большое применение – производство маргарина | от −90 до −130 |
| RC≡CR' ( алкин ) | РСН 2 СН 2 Р' (алкан) | полугидрирование дает цис -RHC=CHR' | −300 (для полного гидрирования) |
| РЧ=О ( альдегид ) | РЧ 2 ОН (первичный спирт) | часто использует трансферное гидрирование | от −60 до −65 |
| Р 2СО ( кетон ) | Р 2 СНОН (вторичный спирт) | часто использует трансферное гидрирование | от −60 до −65 |
| РКО 2 Р' ( эфир ) | RCH 2 OH + R'OH (два спирта) | часто применяется при производстве жирных спиртов | от −25 до −105 |
| РКО 2 Н ( карбоновая кислота ) | РЧ 2 ОН (первичный спирт) | применимо к жирным спиртам | от −25 до −75 |
| РНО 2 ( нитро ) | РНХ 2 (амин) | Основное применение - анилин [6] [7] | −550 |
Катализаторы [ править ]
За редким исключением, H 2 не реагирует с органическими соединениями в отсутствие металлических катализаторов. Ненасыщенный субстрат хемосорбируется на катализаторе, причем большинство участков покрыто субстратом. В гетерогенных катализаторах водород образует поверхностные гидриды (МГ), из которых водород может переноситься на хемосорбированную подложку. Платина , палладий , родий и рутений образуют высокоактивные катализаторы, которые работают при более низких температурах и более низких давлениях. Н 2 . Катализаторы из недрагоценных металлов, особенно на основе никеля (такие как никель Ренея и никель Урусибара ), также были разработаны в качестве экономичных альтернатив, но они часто работают медленнее или требуют более высоких температур. Компромиссом является активность (скорость реакции) по сравнению со стоимостью катализатора и стоимостью аппарата, необходимого для использования высокого давления. Обратите внимание, что гидрирование, катализируемое никелем Ренея, требует высокого давления: [8] [9]
Катализаторы обычно делят на два широких класса: гомогенные и гетерогенные . Гомогенные катализаторы растворяются в растворителе, содержащем ненасыщенный субстрат. Гетерогенные катализаторы представляют собой твердые вещества, которые суспендированы в том же растворителе, что и субстрат, или обработаны газообразным субстратом.
Гомогенные катализаторы [ править ]
Некоторые хорошо известные гомогенные катализаторы указаны ниже. Это координационные комплексы , которые активируют как ненасыщенный субстрат, так и Н 2 . Чаще всего эти комплексы содержат металлы платиновой группы, особенно Rh и Ir.
- Гомогенные катализаторы гидрирования и их предшественники
- Дихлортрис(трифенилфосфин)рутений(II) – предкатализатор на основе рутения.
- Катализатор Крэбтри представляет собой высокоактивный катализатор на основе иридия.
- димер циклооктадиенхлорида родия , Rh 2 Cl 2 (треска) 2 является предшественником многих гомогенных катализаторов.
- (S)-iPr-PHOX представляет собой типичный хелатирующий фосфиновый лиганд, используемый при асимметричном гидрировании.

Гомогенные катализаторы также используются в асимметричном синтезе путем гидрирования прохиральных субстратов. Ранней демонстрацией этого подхода стало резус-катализируемое гидрирование енамидов в качестве предшественников препарата L-ДОФА . [10] Для достижения асимметричного восстановления эти катализаторы делают хиральными с использованием хиральных дифосфиновых лигандов. [11] Гидрирование, катализируемое родием, также использовалось при производстве гербицидов S-метолахлора, в котором используется лиганд типа Йозифоса (называемый Ксилифос). [12] В принципе асимметричное гидрирование может катализироваться хиральными гетерогенными катализаторами. [13] но этот подход остается скорее диковинкой, чем полезной технологией.
Гетерогенные катализаторы [ править ]
Гетерогенные катализаторы гидрирования более распространены в промышленности. В промышленности катализаторы гидрирования драгоценных металлов наносят из раствора в виде мелкодисперсного порошка на носитель, представляющий собой дешевый, громоздкий, пористый, обычно гранулированный материал, такой как активированный уголь , оксид алюминия , карбонат кальция или сульфат бария . [14] Например, платину на угле получают восстановлением платинохлористоводородной кислоты in situ углеродом. Примерами таких катализаторов являются 5% рутения на активированном угле или 1% платины на оксиде алюминия. Катализаторы из недрагоценных металлов, такие как никель Ренея , обычно намного дешевле и не требуют поддержки. Кроме того, в лаборатории безнесущие (массивные) катализаторы из драгоценных металлов, такие как платиновая чернь до сих пор используются , несмотря на их стоимость.
Как и в гомогенных катализаторах, активность регулируется изменением среды вокруг металла, т. е. координационной сферы . Например, разные грани кристаллического гетерогенного катализатора проявляют различную активность. Это можно изменить, смешивая металлы или используя различные методы подготовки. Аналогичным образом на гетерогенные катализаторы влияют их носители.
Во многих случаях высокоэмпирические модификации включают избирательные «яды». Таким образом, тщательно выбранный катализатор можно использовать для гидрирования некоторых функциональных групп, не затрагивая другие, например, гидрирование алкенов без затрагивания ароматических колец или селективное гидрирование алкинов в алкены с использованием катализатора Линдлара . Например, когда катализатор палладий помещают на сульфат бария , а затем обрабатывают хинолином , полученный катализатор восстанавливает алкины только в той степени, в которой это касается алкенов. Катализатор Линдлара был применен для превращения фенилацетилена в стирол . [15]
- Иллюстративные гидрирования
- Селективное гидрирование менее затрудненной алкеновой группы карвона с использованием гомогенного катализатора ( катализатор Уилкинсона ). [16]
- Частичное гидрирование фенилацетилена с использованием катализатора Линдлара .
- Гидрирование имина с использованием никелевого катализатора Ренея , популярного гетерогенного катализатора.
- Частичное гидрирование производного резорцина с использованием катализатора Ренея-никеля.
Трансферное гидрирование [ править ]

В трансферном гидрировании используются молекулы-доноры водорода, отличные от молекулярных. Н 2 . К таким «жертвенным» донорам водорода, которые также могут служить растворителями реакции, относятся гидразин , муравьиная кислота и спирты, такие как изопропанол. [18]
В органическом синтезе трансферное гидрирование полезно для асимметричного гидрирования полярных ненасыщенных субстратов, таких как кетоны , альдегиды и имины , с использованием хиральных катализаторов .
Электролитическое гидрирование [ править ]
Полярные субстраты, такие как нитрилы, можно гидрировать электрохимически , используя протонные растворители и восстанавливающие эквиваленты в качестве источника водорода. [19]
Термодинамика и механизм [ править ]
Присоединение водорода к двойным или тройным связям в углеводородах представляет собой тип окислительно-восстановительной реакции, которая может быть термодинамически выгодной. Например, присоединение водорода к этилену имеет изменение свободной энергии Гиббса -101 кДж·моль. −1 , что является сильно экзотермическим . [11] Например, при гидрировании растительных масел и жирных кислот выделяемого тепла около 25 ккал на моль (105 кДж/моль) достаточно для повышения температуры масла на 1,6–1,7 °С на одно падение йодного числа .
Однако скорость реакции большинства реакций гидрирования незначительна в отсутствие катализаторов. Механизм катализируемого металлами гидрирования алкенов и алкинов хорошо изучен. [20] Прежде всего, мечение изотопов с использованием дейтерия подтверждает региохимию присоединения:
Гетерогенный катализ [ править ]
В твердых телах общепринятым механизмом является механизм Хориути- Полани : [21] [22]
- Связывание ненасыщенной связи
- Диссоциация H 2 на катализаторе
- Добавление одного атома водорода; этот шаг обратим
- Добавление второго атома; фактически необратимы.
На третьем этапе алкильная группа может превратиться в алкен, который может оторваться от катализатора. Следовательно, контакт с катализатором гидрирования обеспечивает цис-транс -изомеризацию. Транс . -алкен может повторно ассоциироваться с поверхностью и подвергаться гидрированию Эти детали частично раскрываются с помощью D 2 (дейтерий), поскольку восстановленные алкены часто содержат дейтерий.
Для ароматических субстратов первое гидрирование протекает наиболее медленно. Продуктом этого этапа является циклогексадиен, который быстро гидрируется и редко обнаруживается. Аналогичным образом циклогексен обычно восстанавливают до циклогексана.
Гомогенный катализ [ править ]
Во многих процессах гомогенного гидрирования [23] металл связывается с обоими компонентами, образуя промежуточный комплекс алкен-металл(H) 2 . Предполагается, что общая последовательность реакций следующая или связанная с ней последовательность стадий:
- связывание водорода с образованием дигидридного комплекса посредством окислительного присоединения (предшествующего окислительному присоединению H 2 – образование диводородного комплекса ):
- Л н М + Н 2 → LnMH 2
- связывание алкена:
- L n MH 2 + CH 2 =CHR → L n MH 2 (CH 2 =CHR)
- перенос одного атома водорода от металла к углероду (миграционная внедрение):
- L n MH 2 (CH 2 =CHR) → L n M(H)(CH 2 −CH 2 R)
- перенос второго атома водорода от металла к алкильной группе с одновременной диссоциацией алкана («восстановительное элиминирование»)
- L n M(H)(CH 2 −CH 2 R) → L n M + CH 3 −CH 2 R
Изомеризация алкенов часто сопровождает гидрирование. Эта важная побочная реакция протекает путем отщепления бета-гидридом промежуточного алкилгидридного соединения: [24]
- L n M(H)(CH 2 −CH 2 R) → L n MH 2 (CH 2 =CHR)
- L n MH 2 (CH 2 =CHR) → L n MH 2 + CH 2 =CHR
Часто высвобождаемый олефин является транс.
Неорганические субстраты [ править ]
Гидрирование азота с получением аммиака проводится в огромных масштабах с помощью процесса Габера-Боша . [25] потребляя примерно 1% мирового энергоснабжения .
Кислород можно частично гидрировать с образованием перекиси водорода , хотя этот процесс не получил коммерческого применения. Одна из трудностей заключается в том, чтобы не допустить, чтобы катализаторы инициировали разложение перекиси водорода с образованием воды. [26] [27]
применение Промышленное
Каталитическое гидрирование имеет разнообразное промышленное применение. Чаще всего в промышленном гидрировании используются гетерогенные катализаторы. [2]
Пищевая промышленность [ править ]
Пищевая промышленность гидрогенизирует растительные масла, чтобы превратить их в твердые или полутвердые жиры, которые можно использовать в спредах, конфетах, выпечке и других продуктах, таких как маргарин . Растительные масла производятся из полиненасыщенных жирных кислот (имеющих более одной двойной углерод-углеродной связи). Гидрирование устраняет некоторые из этих двойных связей. [28]

Частичная гидрогенизация типичного растительного масла до типичного компонента маргарина. В этом процессе удаляется большая часть двойных связей C=C, что повышает температуру плавления продукта.
Нефтехимическая промышленность [ править ]
В нефтехимических процессах гидрирование используется для преобразования алкенов и ароматических соединений в насыщенные алканы (парафины) и циклоалканы (нафтены), которые менее токсичны и менее реакционноспособны. Что касается жидкого топлива, которое иногда в течение длительного времени хранится на воздухе, насыщенные углеводороды обладают превосходными свойствами хранения. С другой стороны, алкены имеют тенденцию образовывать гидропероксиды , которые могут образовывать смолы, мешающие работе оборудования для работы с топливом. Например, минеральный скипидар обычно гидрогенизируют. Еще одним применением является гидрокрекинг тяжелых остатков в дизельное топливо. В процессах изомеризации и каталитического риформинга некоторое давление водорода поддерживается для гидрогенолиза кокса, образующегося на катализаторе, и предотвращения его накопления.
Органическая химия [ править ]
Гидрирование — полезный способ превращения ненасыщенных соединений в насыщенные производные. Субстраты включают не только алкены и алкины, но также альдегиды, имины и нитрилы. [29] которые превращаются в соответствующие насыщенные соединения, т.е. спирты и амины. Так, алкилальдегиды, которые можно синтезировать оксо-процессом из монооксида углерода и алкена, можно превратить в спирты. Например, 1-пропанол получают из пропиональдегида, полученного из этилена и окиси углерода. Ксилит , полиол , получают гидрированием сахарной ксилозы , альдегида. Первичные амины можно синтезировать путем гидрирования нитрилов , тогда как нитрилы легко синтезируются из цианида и подходящего электрофила. Например, изофорондиамин, предшественник полиуретанового мономера изофорондиизоцианата , получают из изофороннитрила путем тандемного гидрирования нитрила/восстановительного аминирования аммиаком, при этом гидрирование превращает как нитрил в амин, так и имин, образующийся из альдегида и аммиака, в еще один амин.
Гидрирование угля [ править ]
История [ править ]
Гетерогенное каталитическое гидрирование [ править ]
Самым ранним гидрированием было катализируемое платиной присоединение водорода к кислороду в лампе Дёберейнера , устройстве, которое поступило в продажу еще в 1823 году. Французский химик Поль Сабатье считается отцом процесса гидрирования. В 1897 году, опираясь на более раннюю работу Джеймса Бойса , американского химика, работавшего в производстве мыльной продукции, он обнаружил, что следы никеля катализируют присоединение водорода к молекулам газообразных углеводородов в так называемом процессе Сабатье . За эту работу Сабатье получил Нобелевскую премию по химии 1912 года . Вильгельм Норманн получил патент в Германии в 1902 году и в Великобритании в 1903 году на гидрогенизацию жидких масел, что положило начало тому, что сейчас является мировой отраслью. Коммерчески важный процесс Габера-Боша , впервые описанный в 1905 году, включает гидрирование азота. В процессе Фишера-Тропша , о котором сообщалось в 1922 году, окись углерода, которую легко получить из угля, гидрируется до жидкого топлива.
В 1922 году Вурхис и Адамс описали аппарат для проведения гидрирования при давлении выше одной атмосферы. [30] Шейкер Парра, первый продукт, позволяющий осуществлять гидрирование при повышенном давлении и температуре, был коммерциализирован в 1926 году на основе исследований Вурхиса и Адамса и до сих пор широко используется. В 1924 году Мюррей Рэйни разработал тонкоизмельченную форму никеля, которая широко используется для катализа реакций гидрирования, таких как превращение нитрилов в амины или производство маргарина.
Гомогенное каталитическое гидрирование [ править ]
В 1930-х годах Кальвин обнаружил, что комплексы меди(II) окисляют H 2 . 1960-е годы стали свидетелями разработки четко определенных гомогенных катализаторов с использованием комплексов переходных металлов, например, катализатора Уилкинсона (RhCl(PPh 3 ) 3 ). Вскоре после этого было обнаружено, что катионные Rh и Ir катализируют гидрирование алкенов и карбонилов. [31] В 1970-х годах асимметричное гидрирование было продемонстрировано при синтезе L-ДОФА , а в 1990-х годах Нойори изобрел асимметричное гидрирование . [32] На развитие гомогенного гидрирования повлияли начатые в 1930-х и 1940-х годах работы по оксо-процессу и полимеризации Циглера-Натта .
Безметалловое гидрирование [ править ]
Для большинства практических целей гидрирование требует металлического катализатора. Однако гидрирование может происходить от некоторых доноров водорода без катализаторов, примерными донорами водорода являются диимид и изопропоксид алюминия , последний иллюстрируется восстановлением Меервейна-Понндорфа-Верли . Некоторые безметалловые каталитические системы были исследованы в академических исследованиях. Одна из таких систем восстановления кетонов состоит из трет -бутанола и трет-бутоксида калия и очень высоких температур. [33] Реакция, изображенная ниже, описывает гидрирование бензофенона :
химической кинетики Исследование [34] обнаружил, что эта реакция имеет первый порядок для всех трех реагентов, что указывает на циклическое 6-членное переходное состояние .
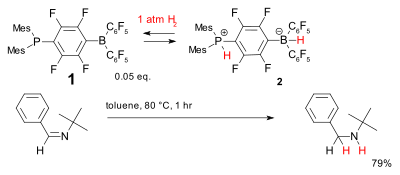
Другая система безметаллового гидрирования основана на фосфин - борана соединении 1 , которое было названо фрустрированной парой Льюиса . Он обратимо присоединяет диводород при относительно низких температурах с образованием фосфония бората 2 , который может восстанавливать простые затрудненные имины . [35]
Сообщалось, что восстановление нитробензола до анилина катализируется фуллереном , его моноанионом, атмосферным водородом и УФ-светом. [36]
Оборудование, используемое для гидрирования [ править ]
Сегодняшний химик имеет три основных варианта оборудования для гидрирования:
- Периодическое гидрирование в атмосферных условиях
- Периодическое гидрирование при повышенной температуре и/или давлении [37]
- Проточное гидрирование
Периодическое гидрирование в атмосферных условиях [ править ]
Оригинальная и до сих пор широко практикуемая форма гидрирования в учебных лабораториях. Этот процесс обычно осуществляется путем добавления твердого катализатора в круглодонную колбу с растворенным реагентом, из которой был откачан азот или аргон , и герметизации смеси проницаемым резиновым уплотнением. Затем газообразный водород подается из H 2 наполненного баллона, . Полученную трехфазную смесь перемешивают для ускорения перемешивания. Поглощение водорода можно контролировать, что может быть полезно для мониторинга хода гидрирования. Это достигается либо использованием градуированной трубки, содержащей цветную жидкость, обычно водный сульфат меди , либо с помощью манометров для каждого реакционного сосуда.
Периодическое гидрирование при повышенной температуре и давлении или /
Поскольку многие реакции гидрирования, такие как гидрогенолиз защитных групп и восстановление ароматических систем, протекают крайне медленно при атмосферной температуре и давлении, популярны системы под давлением. В этих случаях катализатор добавляют к раствору реагента в инертной атмосфере в сосуде под давлением . Водород добавляется непосредственно из баллона или встроенного лабораторного источника водорода, а суспензия под давлением механически встряхивается для обеспечения перемешивания или используется вращающаяся корзина. [37] Последние достижения в технологии электролиза привели к разработке генераторов водорода высокого давления , которые производят водород из воды под давлением до 1400 фунтов на квадратный дюйм (100 бар). Также можно использовать тепло, поскольку давление компенсирует связанное с этим снижение растворимости газа.
гидрирование Поточное
Проточное гидрирование стало популярным методом в лабораторных условиях и во все более широком масштабе процесса. Этот метод включает непрерывное пропускание разбавленного потока растворенного реагента через катализатор с неподвижным слоем в присутствии водорода. Используя признанную технологию высокоэффективной жидкостной хроматографии , этот метод позволяет применять давление от атмосферного до 1450 фунтов на квадратный дюйм (100 бар). Также могут использоваться повышенные температуры. В стендовых системах используется ряд предварительно упакованных катализаторов, что устраняет необходимость взвешивания и фильтрации пирофорных катализаторов.
Промышленные реакторы [ править ]
Каталитическое гидрирование проводится в трубчатом реакторе поршневого типа, заполненном нанесенным катализатором. Давление и температура обычно высокие, хотя это зависит от катализатора. Загрузка катализатора обычно намного ниже, чем при периодическом гидрировании в лабораторных условиях, и к металлу добавляются различные промоторы или используются смеси металлов для улучшения активности, селективности и стабильности катализатора. Использование никеля широко распространено, несмотря на его низкую активность из-за его низкой стоимости по сравнению с драгоценными металлами.
Газожидкостные индукционные реакторы (гидрогенаторы) также используются для проведения каталитического гидрирования. [38]
См. также [ править ]
Ссылки [ править ]
- ^ Гудлицкий, Милош (1996). Редукции в органической химии . Вашингтон, округ Колумбия: Американское химическое общество . п. 429. ИСБН 978-0-8412-3344-7 .
- ↑ Перейти обратно: Перейти обратно: а б Пол Н. Райландер, «Гидрирование и дегидрирование» в Энциклопедии промышленной химии Ульмана , Wiley-VCH, Вайнхайм, 2005. два : 10.1002/14356007.a13_487
- ^ Бек, Шей. Металлоорганическая химия. Великобритания, EDTECH, 2019.
- ^ Продвинутая органическая химия Джерри, 2 марта, издание [ нужна полная цитата ]
- ^ Скотт Д. Барницки «Синтетические органические химикаты» в Справочнике по промышленной химии и биотехнологии под редакцией Джеймса А. Кента, Нью-Йорк: Springer, 2012. 12-е изд. ISBN 978-1-4614-4259-2 .
- ^ «Гидрирование нитробензола с использованием связанных с полимером комплексов Ru (III) в качестве катализатора». Индийский младший из Chem. Тех . 7 : 280. 2000.
- ^ Патель, Д.Р. (1998). «Гидрирование нитробензола с использованием полимерных комплексов Pd (II) в качестве катализатора». Журнал молекулярного катализа . 130 (1–2): 57. дои : 10.1016/s1381-1169(97)00197-0 .
- ^ CFH Аллен и Джеймс ВанАллан (1955). «м-Тойлибензиламин» . Органические синтезы ; Сборник томов , т. 3, с. 827 .
- ^ А. Б. Меклер, С. Рамачандран, С. Сваминатан и Мелвин С. Ньюман (1973). «2-Метил-1,3-Циклогександион» . Органические синтезы
{{cite journal}}: CS1 maint: multiple names: authors list (link); Сборник томов , т. 5, с. 743 . - ^ Ноулз, WS (март 1986 г.). «Применение металлоорганического катализа для промышленного производства L-ДОФА». Журнал химического образования . 63 (3): 222. Бибкод : 1986ЖЧЭд..63..222К . дои : 10.1021/ed063p222 .
- ↑ Перейти обратно: Перейти обратно: а б Аткинс, Питер В. (2010). Неорганическая химия Шрайвера и Аткинса (5-е изд.). Нью-Йорк: WH Freeman and Co., с. 696. ИСБН 978-1-4292-1820-7 .
- ^ Блазер, Ганс-Ульрих; Пугин, Бенуа; Шпиндлер, Феликс; Томмен, Марк (декабрь 2007 г.). «От хирального переключателя к портфелю лигандов для асимметричного катализа». Отчеты о химических исследованиях . 40 (12): 1240–1250. дои : 10.1021/ar7001057 . ПМИД 17715990 .
- ^ Маллат, Т.; Оргльмейстер, Э.; Байкер, А. (2007). «Асимметричный катализ на хиральных металлических поверхностях». Химические обзоры . 107 (11): 4863–90. дои : 10.1021/cr0683663 . ПМИД 17927256 .
- ^ «Платиновые гетерогенные катализаторы – Alfa Aesar» . www.alfa.com . Архивировано из оригинала 18 января 2018 года . Проверено 28 апреля 2018 г.
- ^ Х. Линдлар и Р. Дюбюи (1973). «Палладиевый катализатор частичного восстановления ацетиленов» . Органические синтезы ; Сборник томов , т. 5, с. 880 .
- ^ С. Роберт Э. Ирландия и П. Бей (1988). «Гомогенное каталитическое гидрирование: дигидрокарвон» . Органические синтезы ; Сборник томов , т. 6, с. 459 .
- ^ Амоа, Квеси (2007). «Каталитическое гидрирование малеиновой кислоты при умеренном давлении. Лабораторная демонстрация». Журнал химического образования . 84 (12): 1948. Бибкод : 2007JChEd..84.1948A . дои : 10.1021/ed084p1948 .
- ^ Ван, Донг; Астрюк, Дидье (2015). «Золотой век трансферного гидрирования». хим. Преподобный . 115 (13): 6621–6686. doi : 10.1021/acs.chemrev.5b00203 . ISSN 0009-2665 . ПМИД 26061159 .
- ^ Наварро, Даниэла Мария ду Амарал Феррас; Наварро, Марсело (2004). «Каталитическое гидрирование органических соединений без подачи H2: электрохимическая система». Журнал химического образования . 81 (9): 1350. Бибкод : 2004JChEd..81.1350N . дои : 10.1021/ed081p1350 . S2CID 93416392 .
- ^ Кубас, Г.Дж., «Дигидроген металла и комплексы σ-связей», Kluwer Academic/Plenum Publishers: Нью-Йорк, 2001 г.
- ^ Галлезо, Пьер. «Гидрирование - гетерогенное» в Энциклопедии катализа, том 4, изд. Хорват, IT, John Wiley & Sons, 2003.
- ^ Хориути, Юро; Поланьи, М. (1934). «Реакции обмена водорода на металлических катализаторах». Труды Фарадеевского общества . 30 : 1164. дои : 10.1039/TF9343001164 .
- ^ Йоханнес Г. де Врис, Корнелис Дж. Эльзевир, ред. Справочник по гомогенному гидрированию Wiley-VCH, Вайнхайм, 2007. ISBN 978-3-527-31161-3
- ^ Хартвиг, Джон (2010). Химия органопереходных металлов: от связывания к катализу . Нью-Йорк: Университетские научные книги. п. 1160. ИСБН 978-1-938787-15-7 .
- ^ Аппл, Макс (2006). «Аммиак». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a02_143.pub2 . ISBN 978-3527306732 .
- ^ Норитака Мизуно Габриэле Ченти, Сиглинда Ператонер, Сальваторе Абате «Прямой синтез перекиси водорода: последние достижения» в современном катализе гетерогенного окисления: дизайн, реакции и характеристики 2009, Wiley-VCH. два : 10.1002/9783527627547.ch8
- ^ Эдвардс, Дженнифер К.; Сольсона, Бенджамин; Н, Эдвин Нтайнджуа; Карли, Альберт Ф.; Герцинг, Эндрю А.; Кили, Кристофер Дж.; Хатчингс, Грэм Дж. (20 февраля 2009 г.). «Отключение гидрирования пероксида водорода в процессе прямого синтеза». Наука . 323 (5917): 1037–1041. Бибкод : 2009Sci...323.1037E . дои : 10.1126/science.1168980 . ПМИД 19229032 . S2CID 1828874 .
- ^ Ян П. Фриман «Маргарины и шортенинги» в Энциклопедии промышленной химии Ульмана , 2005, Wiley-VCH, Вайнхайм. два : 10.1002/14356007.a16_145
- ^ Веркмайстер, Свенья; Юнге, Катрин; Беллер, Матиас (2 февраля 2014 г.). «Каталитическое гидрирование эфиров, амидов и нитрилов карбоновых кислот с помощью гомогенных катализаторов» . Исследования и разработки органических процессов . 18 (2): 289–302. дои : 10.1021/op4003278 . S2CID 102012512 .

- ^ «Архивная копия» (PDF) . Архивировано (PDF) из оригинала 10 сентября 2008 г. Проверено 5 августа 2008 г.
{{cite web}}: CS1 maint: архивная копия в заголовке ( ссылка ) - ^ Шрок, Ричард Р.; Осборн, Джон А. (апрель 1976 г.). «Каталитическое гидрирование с использованием катионных комплексов родия. I. Эволюция каталитической системы и гидрирование олефинов». Журнал Американского химического общества . 98 (8): 2134–2143. дои : 10.1021/ja00424a020 .
- ^ К. Петтинари, Ф. Маркетти, Д. Мартини «Металлические комплексы как катализаторы гидрирования» Комплексная координационная химия II, 2004, том 9. стр. 75–139. два : 10.1016/B0-08-043748-6/09125-8
- ^ Уоллинг, Чевес; Боллыки, Ласло. (1964). «Гомогенное гидрирование в отсутствие катализаторов переходных металлов». Журнал Американского химического общества . 86 (18): 3750. doi : 10.1021/ja01072a028 .
- ^ Беркессель, Альбрехт; Шуберт, Томас Дж.С.; Мюллер, Томас Н. (2002). «Гидрирование без катализатора из переходных металлов: о механизме катализируемого основаниями гидрирования кетонов». Журнал Американского химического общества . 124 (29): 8693–8. дои : 10.1021/ja016152r . ПМИД 12121113 .
- ^ Чейз, Престон А.; Уэлч, Грегори К.; Юрка, Титель; Стефан, Дуглас В. (2007). «Безметалловое каталитическое гидрирование». Angewandte Chemie, международное издание . 46 (42): 8050–3. дои : 10.1002/anie.200702908 . ПМИД 17696181 .
- ^ Ли, Баоцзюнь; Сюй, Чжэн (2009). «Неметаллический катализатор для молекулярной активации водорода, обладающий способностью к каталитическому гидрированию, сравнимой с катализатором на благородных металлах» . Журнал Американского химического общества . 131 (45): 16380–2. дои : 10.1021/ja9061097 . ПМИД 19845383 .
- ↑ Перейти обратно: Перейти обратно: а б Адамс, Роджер; Вурхис, В. (1928). «Аппарат для каталитического восстановления». Органические синтезы . 8 : 10. дои : 10.15227/orgsyn.008.0010 .
- ^ Джоши, Дж. Б.; Пандит, АБ; Шарма, ММ (1982). «Газожидкостные реакторы с механическим перемешиванием». Химико-техническая наука . 37 (6): 813. Бибкод : 1982ЧЭнС..37..813Ж . дои : 10.1016/0009-2509(82)80171-1 .
Дальнейшее чтение [ править ]
- Чан Э.С., Юнг М.И., Мин Д.Б. (2005). «Гидрирование жирных кислот с низким содержанием транс и высоким содержанием конъюгированных жирных кислот» (PDF) . Комплексные обзоры в области пищевой науки и безопасности пищевых продуктов . 1 . Архивировано из оригинала (PDF) 17 декабря 2008 г.
- примеры гидрирования от органических синтезов:
- ранние работы по трансферному гидрированию:
- Дэвис, РР; Ходжсон, Х.Х. (1943). «76. Каталитическое восстановление муравьиной кислотой под давлением. Часть II. Сравнение меди и никеля как катализаторов». Дж. Хим. Соц. : 281. дои : 10.1039/jr9430000281 .
- Леггетер, Бельгия; Браун, РК (1960). «Восстановление моногалогенированных нитробензолов гидразином и никелем Ренея. Удобное получение галогенированных анилинов». Может. Дж. Чем . 38 (12): 2363. дои : 10.1139/v60-320 .
- Кун, LP (1951). «Каталитическое восстановление гидразином». Дж. Ам. хим. Соц. 73 (4): 1510. doi : 10.1021/ja01148a029 .
Внешние ссылки [ править ]
- «Магия гидро» , Popular Mechanics , июнь 1931, стр. 107–109 - ранняя статья для широкой публики о гидрировании нефти, произведенной в 1930-х годах.




![Селективное гидрирование менее затрудненной алкеновой группы в карвоне с использованием гомогенного катализатора (катализатор Уилкинсона).[16]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d3/CarvoneH2.png/162px-CarvoneH2.png)

![Гидрирование азота {\displaystyle {\ce {{\underset {азот}{N{\equiv }N}}+{\underset {водород \наверху (200 атм)}{3H2}}->[{\ce {Fe\ катализатор}} ][350-550^{\circ }{\ce {C}}]{\underset {аммиак}{2NH3}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2dd5645111a3ad991987a7b9e10599029c287e98)