калия Трет -бутоксид
| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК
калия Трет -бутоксид | |||
| Другие имена
KOt-Bu, т- бутоксид калия.
| |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.011.583 | ||
ПабХим CID
|
|||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| С 4 Ч 9 КО | |||
| Молярная масса | 112.21 g mol −1 | ||
| Появление | твердый | ||
| Температура плавления | 256 ° С (493 ° F; 529 К) | ||
| Точка кипения | сублимируется при 220 °C (1 мм рт.ст.) или при 140 °C (0,01 гПа) | ||
| Реагирует с водой | |||
| Растворимость в диэтиловом эфире | 4,34 г/100 г (25–26 °С) [ 1 ] | ||
| Растворимость в гексане | 0,27 г/100 г (25–26 °С) [ 1 ] | ||
| Растворимость в толуоле | 2,27 г/100 г (25–26 °С) [ 1 ] | ||
| Растворимость в ТГФ | 25,00 г/100 г (25–26 °С) [ 1 ] | ||
| Опасности | |||
| СГС Маркировка : [ 2 ] | |||
 
| |||
| Опасность | |||
| Х228 , Х252 , Х314 | |||
| P405 | |||
| Паспорт безопасности (SDS) | Оксфордский паспорт безопасности материалов | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
калия Трет -бутоксид (или калия трет- бутоксид ) представляет собой химическое соединение с формулой [(CH 3 ) 3 COK] n (сокр. KOtBu). Это бесцветное твердое вещество является сильным основанием (pKa сопряженной кислоты около 17), которое полезно в органическом синтезе . Соединение часто изображают в виде соли, и оно часто ведет себя так, но его ионизация зависит от растворителя. [ 1 ]
Подготовка
[ редактировать ]бутоксид калия Трет- коммерчески доступен в виде раствора и твердого вещества, но его часто получают на месте для лабораторного использования, поскольку образцы очень чувствительны к влаге , а старые образцы часто имеют низкую чистоту. Его получают реакцией сухого трет -бутилового спирта с металлическим калием . [ 3 ] Твердое вещество получают выпариванием этих растворов с последующим нагреванием твердого вещества. Твердое вещество можно очистить сублимацией.
Структура
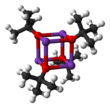
[ редактировать ]Он кристаллизуется в виде тетрамерного кластера кубанового типа . Он кристаллизуется из тетрагидрофурана / пентана при -20°C в виде [tBuOK·tBuOH] ∞ , который состоит из прямых цепей, связанных водородными связями . Сублимация [tBuOK·tBuOH] ∞ дает тетрамер [tBuOK] 4 , который принимает кубаноподобную структуру. Мягкие основные растворители Льюиса, такие как ТГФ и диэтиловый эфир, не разрушают тетрамерную структуру, которая сохраняется в твердом состоянии, в растворе и даже в газовой фазе. [ 4 ]
Реакции
[ редактировать ]В качестве основы
[ редактировать ]Сообщалось о многих модификациях, влияющих на реакционную способность этого реагента. Соединение имеет сложную кластерную структуру (на соседнем рисунке изображен упрощенный рисунок), а добавки, модифицирующие кластер, влияют на реакционную способность реагента. Например, ДМФ , ДМСО , гексаметилфосфорамид (ГМФА) и 18-краун-6 взаимодействуют с калиевым центром, образуя разделенные растворителем ионные пары, такие как K(ДМСО) x + и трет -BuO − . В то время как в бензоле, с другой стороны, соединение остается в виде кластерной структуры, которая является менее основной. [ 1 ] Даже в полярных растворителях он не так силен, как амидные основания, например диизопропиламид лития , но сильнее, чем гидроксид калия. препятствует участию группы в нуклеофильном присоединении, например, в синтезе эфира Вильямсона или в родственных SN Его стерическая масса 2 . реакциях [ нужна ссылка ]
Субстраты, депротонированные трет- бутоксидом калия, включают концевые ацетилены и активные метиленовые соединения . Он полезен в реакциях дегидрогалогенирования . Иллюстрируя последнее поведение, трет -бутоксид калия реагирует с хлороформом с образованием дихлоркарбена , который полезен для дихлорциклопропанирования . [ 5 ] [ 6 ] -бутоксид калия Трет может отрывать бета-протон от катионов алкиламмония, что приводит к образованию продукта Хофмана посредством реакции элиминирования .
Другие реакции
[ редактировать ]-бутоксид калия Трет катализирует реакцию гидросиланов и гетероциклических соединений с образованием силильных производных с выделением H 2 . [ 7 ]
Безопасность
[ редактировать ]-бутоксид калия Трет — очень сильное основание, которое быстро атакует живые ткани.
-бутоксид калия Трет при взаимодействии с дихлорметаном образует взрывоопасные смеси. [ 8 ] [ 9 ]
Родственные соединения
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж Кейн Д. (2006). «Калий трет-бутоксид». Трет-бутоксид калия . Электронная энциклопедия реагентов для органического синтеза EROS . дои : 10.1002/047084289X.rp198.pub2 . ISBN 0471936235 .
- ^ Запись о трет-бутоксиде калия в базе данных веществ GESTIS Института безопасности и гигиены труда , доступ 22 декабря 2021 г.
- ^ Уильям С. Джонсон и Уильям П. Шнайдер (1963). «β-Карбэтокси-γ,γ-дифенилвинилуксусная кислота» . Органические синтезы ; Сборник томов , т. 4, с. 132 .
- ^ Чисхолм, Малкольм Х.; Дрейк, Саймон Р.; Наини, Ахмад А.; Стрейб, Уильям Э. (1991). «Синтез и рентгенокристаллические структуры одномерных ленточных цепочек [MOBu т · Этот т OH] ∞ и кубановые виды [MOBu т ] 4 (M = K и Rb)». Многогранник . 10 (3): 337–345. doi : 10.1016/S0277-5387(00)80154-0 .
- ^ Браун, Уильям; Фут, Кристофер; Айверсон, Брент; Анслин, Эрик (10 января 2008 г.). Органическая химия . Cengage Обучение. ISBN 978-0495388579 .
- ^ Маргарет-Энн Армор (19 апреля 2016 г.). Руководство по утилизации опасных лабораторных химикатов, третье издание . ЦРК Пресс. ISBN 9781420032383 .
- ^ Антон А. Тутов, Вэнь-Бо Лю, Керри Н. Бетц, Алексей Федоров, Брайан Столц , Роберт Х. Граббс (2015). «Силилирование связей C–H в ароматических гетероциклах с помощью металлического катализатора, содержащего большое количество земли» (PDF) . Природа . 518 (7537): 80–84. Бибкод : 2015Natur.518...80T . дои : 10.1038/nature14126 . ПМИД 25652999 . S2CID 3117834 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Фоден, Чарльз Р.; Уэдделл, Джек Л. (29 декабря 1991 г.). Опасные материалы: данные о действиях в чрезвычайных ситуациях . ЦРК Пресс. ISBN 9780873715980 .
- ^ Бретерик, Л. (1990). Справочник по химическим опасностям, 4-е изд . Дихлорметан – Реактивность/Несовместимость в Национальной медицинской библиотеке НИЗ. п. 475. ИСБН 9781483284668 .