Асимметричное гидрирование
Асимметричное гидрирование — это химическая реакция, которая добавляет два атома водорода к молекуле мишени (субстрата) с трехмерной пространственной селективностью . Важно отметить, что эта селективность исходит не от самой целевой молекулы, а от других реагентов или катализаторов, присутствующих в реакции. Это позволяет пространственной информации (то, что химики называют хиральностью ) передаваться от одной молекулы к мишени, образуя продукт в виде одного энантиомера . Хиральная информация чаще всего содержится в катализаторе, и в этом случае информация в одной молекуле катализатора может передаваться многим молекулам субстрата, увеличивая количество присутствующей хиральной информации. Подобные процессы происходят в природе, где хиральная молекула, такая как фермент, может катализировать введение хирального центра с образованием продукта в виде одного энантиомера, такого как аминокислоты , который необходим клетке для функционирования. Имитируя этот процесс, химики могут создавать множество новых синтетических молекул, которые особым образом взаимодействуют с биологическими системами, что приводит к созданию новых фармацевтические средства и агрохимикаты . Важность асимметричного гидрирования как в научных кругах, так и в промышленности способствовала тому, что двое его пионеров — Уильям Стэндиш Ноулз и Рёдзи Ноёри — были коллективно удостоены половины Нобелевской премии по химии 2001 года . [1]
История
[ редактировать ]В 1956 году было показано, что гетерогенный катализатор из палладия , нанесенный на шелк, осуществляет асимметричное гидрирование. [2] Позже, в 1968 году, группы Уильяма Ноулза и Леопольда Хорнера независимо друг от друга опубликовали примеры асимметричного гидрирования с использованием гомогенных катализаторов . продемонстрировали лишь умеренный избыток энантиомеров Хотя эти ранние реакции , они продемонстрировали осуществимость. К 1972 году был достигнут энантиомерный избыток 90%, и с использованием этой технологии начался первый промышленный синтез лекарства Паркинсона от болезни L-ДОФА . [3] [4]

В области асимметричного гидрирования продолжался ряд заметных достижений. Анри Каган разработал DIOP , легко получаемый C 2 -симметричный дифосфин, который давал высокие значения EE в определенных реакциях. Рёдзи Ноёри представил катализаторы на основе рутения для асимметричных гидрированных полярных субстратов, таких как кетоны и альдегиды. Роберт Х. Крэбтри продемонстрировал способность соединений иридия катализировать реакции асимметричного гидрирования в 1979 году, изобретя катализатор Крэбтри . [5] В начале 1990-х годов введение лигандов P,N несколькими группами независимо затем еще больше расширило сферу применения C 2 -симметричных лигандов, хотя они принципиально не превосходят хиральные лиганды, лишенные вращательной симметрии . [6]
Сегодня асимметричное гидрирование является рутинной методикой в органической химии лабораторных и промышленных масштабов. Важность асимметричного гидрирования была признана Нобелевской премией по химии 2001 года, присужденной Уильяму Стэндишу Ноулзу и Рёдзи Ноёри .
Механизм
[ редактировать ]Асимметричное гидрирование осуществляется по обычным механизмам, используемым для других гидрирований. Сюда входят механизмы внутренней сферы, механизмы внешней сферы и механизмы метатезиса σ-связи. [7] Тип механизма, используемого катализатором, во многом зависит от лигандов, используемых в системе, что, в свою очередь, приводит к определенному сродству катализатора к субстрату.
Механизмы внутренней сферы
[ редактировать ]Так называемый внутрисферный механизм предполагает координацию алкена с металлическим центром. [8] Другие характеристики этого механизма включают тенденцию к гомолитическому расщеплению диводорода при наличии более богатых электронами низковалентных металлов, в то время как бедные электронами металлы с высокой валентностью обычно демонстрируют гетеролитическое расщепление диводорода с помощью основания. [9]
На диаграмме ниже показаны целевые механизмы каталитического гидрирования с комплексами родия , которые представляют собой внутрисферные механизмы. При ненасыщенном механизме образующийся хиральный продукт будет иметь противоположный режим по сравнению с используемым катализатором. В то время как термодинамически выгодный комплекс между катализатором и субстратом не может подвергаться гидрированию, нестабильный, неблагоприятный комплекс подвергается гидрированию быстро. [10] С другой стороны, дигидридный механизм предполагает, что комплекс первоначально гидрируется до дигидридной формы. Это впоследствии позволяет координировать двойную связь на свободной стороне. Благодаря вставке и восстановительному удалению хиральность продукта соответствует хиральности лиганда. [11]
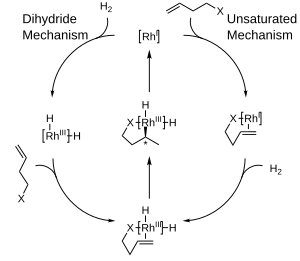
Предпочтение образования одного энантиомера вместо другого в этих реакциях часто объясняют стерическими взаимодействиями между лигандом и прохиральным субстратом. Учет этих взаимодействий привел к разработке квадрантных диаграмм, где «заблокированные» области обозначены заштрихованным прямоугольником, а «открытые» области оставлены незаполненными. В смоделированной реакции большие группы на поступающем олефине будут стремиться заполнить открытые области диаграммы, в то время как более мелкие группы будут направлены к заблокированным областям, и тогда доставка водорода будет происходить к задней поверхности олефина, фиксируя стереохимия . Обратите внимание, что для ясности показана только часть хирального фосфинового лиганда.

Механизмы внешней сферы
[ редактировать ]Некоторые катализаторы действуют по «механизму внешней сферы», так что субстрат никогда не связывается напрямую с металлом, а скорее взаимодействует с его лигандами, которые часто представляют собой гидрид металла и протонный водород на лиганде. Таким образом, в большинстве случаев диводород расщепляется гетеролитически, при этом металл действует как кислота Льюиса, а внешнее или внутреннее основание «депротонирует» гидрид. [7]

В качестве примера этого механизма можно рассмотреть систему БИНАП-Ru-диамин. Дигалогенидную форму катализатора превращают в катализаторы реакцией H 2 в присутствии основания: [12]
- RuCl 2 (BINAP)(диамин) + 2 KOBu-t + 2 H 2 → RuH 2 (BINAP)(диамин) + 2 KCl + 2 HOBu-t
Полученные катализаторы имеют три вида лигандов:
- гидриды, которые переходят на ненасыщенный субстрат
- диамины, которые взаимодействуют с субстратом и с основанием-активатором посредством второй координационной сферы
- дифосфин, который придает асимметрию.
Катализаторы «класса Нойори» часто называют бифункциональными катализаторами, чтобы подчеркнуть тот факт, что как металл, так и (аминный) лиганд являются функциональными. [13]
что при гидрировании субстратов, содержащих C=O, механизм действует посредством шестичленного перициклического переходного состояния /промежуточного соединения, при котором гидридный центр гидрида рутения ( H Ru-N H ) взаимодействует с карбонильным субстратом R 2 C = O. Долгое время предполагалось , [14] Более поздние DFT и экспериментальные исследования показали, что эта модель во многом неверна. Вместо этого аминная основная цепь сильно взаимодействует с основным активатором, который часто используется в большом избытке. [12] Однако в обоих случаях подложка не связана напрямую с металлическим центром, что делает ее отличным примером механизма внешней сферы.
Металлы
[ редактировать ]В практике АГ используются катализаторы на основе платиновых металлов. [15] [16] [17]
Недрагоценные металлы
[ редактировать ]Железо является популярным объектом исследований для многих каталитических процессов, во многом благодаря его низкой стоимости и низкой токсичности по сравнению с другими переходными металлами. [18] Реализованы методы асимметричного гидрирования с использованием железа, хотя по скорости и селективности они уступают катализаторам на основе драгоценных металлов. [19] В некоторых случаях структурно плохо определенные наночастицы оказались активными частицами in situ , и наблюдаемая умеренная селективность может быть результатом их неконтролируемой геометрии. [20]
Классы лигандов
[ редактировать ]Фосфиновые лиганды
[ редактировать ]Хиральные фосфиновые лиганды, особенно C 2 -симметричные лиганды , являются источником хиральности в большинстве асимметричных катализаторов гидрирования. Из них лиганд BINAP хорошо известен благодаря его использованию в асимметричном гидрировании Нойори, получившему Нобелевскую премию . [3]
Хиральные фосфиновые лиганды обычно можно классифицировать как моно- или бидентатные . Их можно дополнительно классифицировать по расположению стереогенного центра – фосфор и органические заместители. Лиганды с элементом симметрии C 2 были особенно популярны, отчасти потому, что присутствие такого элемента резко снижает возможные конформации связывания субстрата с комплексом металл-лиганд (часто приводя к исключительной энантиоселективности). [21]
Монодентатные фосфины
[ редактировать ]Одними из первых в асимметричном гидрировании появились лиганды монофосфинового типа, например лиганд CAMP. [22] Продолжающиеся исследования этих типов лигандов позволили изучить как с P -алкилом, так и с P лиганды, связанные -гетероатомом, при этом лиганды с P -гетероатомом, такие как фосфиты и фосфорамидиты, обычно достигают более впечатляющих результатов. [23] Структурные классы лигандов, добившиеся успеха, включают те, которые основаны на бинафтильной структуре MonoPHOS. [24] или спирокольцевая система SiPHOS. [25] Примечательно, что эти монодентатные лиганды можно использовать в сочетании друг с другом для достижения синергического улучшения энантиоселективности; [26] то, что невозможно с дифосфиновыми лигандами . [23]
Хиральные дифосфиновые лиганды
[ редактировать ]Дифосфиновым лигандам уделяется значительно больше внимания, чем монофосфинам, и, возможно, как следствие, они имеют гораздо более длинный список достижений. К этому классу относятся первый лиганд, добившийся высокой селективности ( ДИОП ), первый лиганд, который будет использоваться в промышленном асимметричном синтезе ( ДИПАМП). [27] [28] [4] ) и, вероятно, самый известный хиральный лиганд (BINAP). [3] Хиральные дифосфиновые лиганды в настоящее время повсеместно используются при асимметричном гидрировании.

Лиганды P,N и P,O
[ редактировать ]Использование лигандов P,N в асимметричном гидрировании можно отнести к C 2 симметричному бисоксазолиновому лиганду . [29] Однако вскоре эти симметричные лиганды были вытеснены монооксазолиновыми лигандами , отсутствие симметрии C 2 которых никоим образом не ограничивает их эффективность в асимметричном катализе. [30] Такие лиганды обычно состоят из ахирального азотсодержащего гетероцикла, который функционализирован боковым фосфорсодержащим плечом, хотя как точная природа гетероцикла, так и фосфорный центр химического окружения широко варьируются. Ни одна структура не оказалась последовательно эффективной с широким спектром субстратов, хотя некоторые привилегированные структуры (например, фосфин-оксазолиновая или PHOX- архитектура). были установлены [31] [30] [32] Более того, в пределах узко определенного класса субстратов характеристики металлических комплексов с хиральными лигандами P,N могут приближаться к идеальной конверсии и селективности в системах, которые в противном случае было бы очень трудно обнаружить. [33] Некоторые комплексы, полученные из хелатирующих лигандов PO, показали многообещающие результаты в гидрировании α,β-ненасыщенных кетонов и сложных эфиров. [34]
NHC-лиганды
[ редактировать ]
Простые лиганды на основе N -гетероциклического карбена (NHC) оказались непрактичными для асимметричного гидрирования.
Некоторые лиганды C,N объединяют NHC с хиральным оксазолином, образуя хелатирующий лиганд. [35] [36] Лиганды первого типа на основе NHC были созданы в виде крупных библиотек в результате реакции более мелких библиотек отдельных NHC и оксазолинов. [35] [36] Катализаторы на основе NHC с объемным семичленным металлоциклом на иридии применены для каталитического гидрирования нефункционализированных олефинов. [35] и винилэфирные спирты с конверсиями и ee в начале 80-х или 90-х годов. [37] Та же система была применена для синтеза ряда альдолов, [38] вицинальный диметил [39] и дезоксиполикетид [40] мотивы, так и сами дезоксиполикетиды. [41]
C 2 -симметричные NHC оказались весьма полезными лигандами для асимметричного гидрирования. [42]
Ациклические субстраты
[ редактировать ]Субстраты можно классифицировать по их полярности. В неполярных субстратах преобладают алкены . К полярным субстратам относятся кетоны , енамины, кетимины .
Неполярные подложки
[ редактировать ]Алкены, которые особенно поддаются асимметричному гидрированию, часто имеют полярную функциональную группу, примыкающую к сайту, подлежащему гидрированию. В отсутствие этой функциональной группы катализ часто приводит к низким значениям ee. Однако для некоторых нефункционализированных олефинов P , N. оказался эффективным иридий с лигандами на основе Алкеновые субстраты часто классифицируют по их заместителям, например, 1,1-дизамещенные, 1,2-диарилтризамещенные, 1,1,2-триалкильные и тетразамещенные олефины. [44] [45] и даже внутри этих классов могут существовать вариации, которые делают разные решения оптимальными. [46]


В отличие от олефинов, асимметричное гидрирование енаминов отдает предпочтение лигандам дифосфинового типа; Отличные результаты были достигнуты как с системами на основе иридия, так и с родием. Однако даже самые лучшие системы часто страдают от низкого ee и недостатка общности. Некоторые пирролидиновые производные енаминов ароматических кетонов поддаются асимметричному гидрированию с помощью катионных фосфонитных систем родия (I), а также системы I 2 и уксусной кислоты со значениями ee обычно выше 90% и потенциально до 99,9%. [47] Подобная система с использованием иридия (I) и очень близкого фосфорамидитного лиганда эффективна для асимметричного гидрирования енаминов пирролидинового типа, где двойная связь находилась внутри кольца: другими словами, дигидропирролов. [48] В обоих случаях энантиоселективность существенно падала при увеличении размера кольца с пяти до шести.
Имины и кетоны
[ редактировать ]
Кетоны и имины являются родственными функциональными группами, и эффективные технологии асимметричного гидрирования каждой из них также тесно связаны. Ранними примерами являются рутений-хиральная дифосфин-диаминовая система Нойори. [49] [50]
Для карбонильных и иминных субстратов, с конца, η 1 координация может конкурировать с η 2 режим. Для н 1 -связанных субстратов, углерод, принимающий водород, удаляется из катализатора и сопротивляется гидрированию. [51]
Системы на основе иридия/P,N-лигандов оказались эффективными для некоторых кетонов и иминов. Например, в последовательной системе для бензилариминов используется лиганд P,N SIPHOX в сочетании с иридием (I) в катионном комплексе для достижения асимметричного гидрирования с ее >90%. [52] Эффективным катализатором кетонов ( оборотное число (TON) до 4 550 000 и ее до 99,9%) является система иридия (I) с близкородственным тридентатным лигандом . [53]

Катализатор БИНАП/диамин-Ru эффективен для асимметричного восстановления как функционализированных, так и простых кетонов. [54] и катализатор BINAP/диамин-Ru может энантиоселективно катализировать ароматические , гетероароматические и олефиновые кетоны . [55] Лучшая стереоселективность достигается, когда один заместитель больше другого (см. Угол Флиппина-Лоджа ).

Ароматические субстраты
[ редактировать ]Асимметричное гидрирование ароматических (особенно гетероароматических ) субстратов является очень активной областью текущих исследований. Катализаторам в этой области приходится иметь дело с рядом усложняющих факторов, включая склонность высокостабильных ароматических соединений сопротивляться гидрированию, потенциальные координирующие (и, следовательно, отравляющие катализатор) способности как субстрата, так и продукта, а также большое разнообразие моделей замещения, которые может присутствовать на любом одном ароматическом кольце. [56] Из этих субстратов наиболее устойчивый успех был достигнут с азотсодержащими гетероциклами, где ароматическое кольцо часто активируется либо протонированием, либо дальнейшей функционализацией азота (обычно с помощью электроноакцепторной защитной группы). Такие стратегии менее применимы к кислород- и серосодержащим гетероциклам, поскольку они менее основные и менее нуклеофильные; эта дополнительная трудность может помочь объяснить, почему существует мало эффективных методов их асимметричного гидрирования.
Хинолины, изохинолины и хиноксалины
[ редактировать ]Существуют две системы асимметричного гидрирования 2-замещенных хинолинов с выходами изолированных веществ, обычно превышающими 80%, и значениями ее, как правило, более 90%. Первая представляет собой систему иридий(I)/хиральный фосфин/I2 , о которой впервые сообщили Zhou et al. . [57] Хотя первым хиральным фосфином, использованным в этой системе, был MeOBiPhep, новые версии были направлены на улучшение характеристик этого лиганда. С этой целью в системах используются фосфины (или родственные лиганды) с повышенной устойчивостью на воздухе. [58] возможность вторичной переработки, [58] простота приготовления, [59] более низкая загрузка катализатора [60] [61] и потенциальная роль добавок ахирального фосфина. [62] По состоянию на октябрь 2012 года никакой механизм, по-видимому, не был предложен, хотя были задокументированы как необходимость I 2 или галогенного заменителя, так и возможная роль гетероароматического N в обеспечении реакционной способности. [56]
Второй представляет собой органокалитическую систему гидрирования с переносом, основанную на эфирах Ханча и хиральной кислоте Бренстеда . В этом случае авторы предполагают механизм, при котором изохинолин попеременно протонируется на стадии активации, а затем восстанавливается за счет сопряженного добавления гидрида из сложного эфира Ганча. [63]
Большая часть химии асимметричного гидрирования хиноксалинов тесно связана с химией структурно подобных хинолинов . Эффективные (и действенные) результаты можно получить с помощью Ir(I)/фофинит/I 2 . системы [64] и органокаталитическая система на основе сложного эфира Ганча, [65] обе из них подобны системам, обсуждавшимся ранее в отношении хинолинов .
Пиридины
[ редактировать ]Пиридины представляют собой весьма изменчивые субстраты для асимметричного восстановления (даже по сравнению с другими гетероароматическим соединениями), поскольку в начальном кольце доступны пять углеродных центров для дифференциального замещения. По состоянию на октябрь 2012 года не существует метода, который мог бы контролировать все пять, хотя существует по крайней мере один достаточно общий метод.
Самый общий метод асимметричного гидрирования пиридина на самом деле является гетерогенным методом, в котором асимметрия создается за счет хирального оксазолидинона, связанного с положением C2 пиридина. Гидрирование таких функционализированных пиридинов на ряде различных гетерогенных металлических катализаторов дало соответствующий пиперидин с заместителями в положениях C3, C4 и C5 в полностью цис -геометрии, с высоким выходом и превосходной энантиоселективностью. Вспомогательный оксазолидинон также легко расщепляется в условиях гидрирования. [66]

Методы, специально разработанные для гидрирования 2-замещенного пиридина, могут включать асимметричные системы, разработанные для родственных субстратов, таких как 2-замещенные хинолины и хиноксалины. Например, система иридий(I)\хиральный фосфин\I 2 эффективна при асимметричном гидрировании активированных (алкилированных) 2-пиридиниев. [67] или некоторые пиридины, конденсированные с циклогексаноном. [68] Аналогично, катализ хиральной кислотой Бренстеда с эфиром Ганча в качестве источника гидрида эффективен для некоторых 2-алкилпиридинов с дополнительным активирующим замещением. [69]
Индолы и пирролы
[ редактировать ]асимметричное гидрирование индолов Установлено с N -Boc-защитой . [70]

Система Pd(TFA) 2 /H8-BINAP обеспечивает энантиоселективное цис- гидрирование 2,3- и 2-замещенных индолов. [71] [72]

Подобно поведению индолов, пирролы могут быть преобразованы в пирролидины путем асимметричного гидрирования. [73]

Кислород- и серосодержащие гетероциклы
[ редактировать ]Асимметричное гидрирование фуранов и бензофуранов представляет собой сложную задачу. [74]
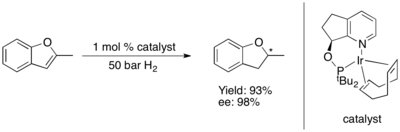
Асимметричное гидрирование тиофенов и бензотиофенов катализируется некоторыми комплексами рутения (II) с N -гетероциклическими карбенами (NHC). Эта система, по-видимому, обладает превосходной селективностью (ee > 90%) и идеальной диастереоселективностью (все цис ), если субстрат имеет конденсированное (или непосредственно связанное) фенильное кольцо, но во всех других проверенных случаях дает только рацемический продукт. [75]

Гетерогенный катализ
[ редактировать ]Ни один гетерогенный катализатор для асимметричного гидрирования не был коммерциализирован.
Первое асимметричное гидрирование было сосредоточено на палладии, нанесенном на шелковую подложку. хинного дерева Алкалоиды использовались в качестве хиральных модификаторов для энантиоселективного гидрирования. [76]

Альтернативным методом, позволяющим лучше контролировать структурные и электронные свойства активных каталитических центров, является иммобилизация катализаторов, разработанных для гомогенного катализа, на гетерогенном носителе. Ковалентное связывание катализатора с полимером или другим твердым носителем, пожалуй, наиболее распространено, хотя иммобилизация катализатора также может быть достигнута путем адсорбции на поверхности, ионного обмена или даже физического инкапсулирования. Одним из недостатков этого подхода является возможность того, что близость носителя может изменить поведение катализатора, снизив энантиоселективность реакции. Чтобы избежать этого, катализатор часто связывают с носителем длинным линкером, хотя известны случаи, когда близость носителя может фактически повысить эффективность катализатора. [76]
Последний подход включает в себя создание MOF, которые включают хиральные реакционные центры из ряда различных компонентов, потенциально включая хиральные и ахиральные органические лиганды, структурные ионы металлов, каталитически активные ионы металлов и/или предварительно собранные каталитически активные металлоорганические ядра. [77] Один из них касался катализаторов на основе рутения . Всего лишь 0,005 мол. % таких катализаторов оказалось достаточно для осуществления асимметричного гидрирования арилкетонов, хотя в обычных условиях использовалось 0,1 мол. % катализатора, что приводило к энантиомерному избытку 90,6–99,2 %. [78]

Промышленное применение
[ редактировать ]
Асимметричная гидрогенизация используется при производстве нескольких лекарств, таких как антибактериальный левофлоксин, антибиотик карбапенем и антипсихотический агент BMS181100. [15] [16] [17]

Исследования Ноулза в области асимметричного гидрирования и его применения в промышленном синтезе L-дофа. [4] дал асимметричному гидрированию мощный старт в промышленном мире. Обзор 2001 года показал, что на асимметричное гидрирование приходится 50% производственных, 90% пилотных и 74% лабораторных каталитических энантиоселективных процессов в промышленности, с оговоркой, что асимметричные каталитические методы в целом еще не получили широкого распространения. [79]
Асимметричное гидрирование заменило методы, основанные на кинетическом разрешении, что привело к существенному повышению эффективности процесса. [12] можно увидеть в ряде конкретных случаев, когда, например, группа катализа компании Roche смогла добиться синтеза ( S , S )-Ro 67-8867 с общим выходом 53%, что является резким увеличением по сравнению с достигнутыми 3,5%. в синтезе на основе разрешения. [80] Синтез мибефрадил компании «Рош» также был улучшен за счет замены разделения на асимметричное гидрирование, сокращения количества стадий на три и увеличения выхода ключевого промежуточного продукта до 80% с первоначальных 70%. [81]
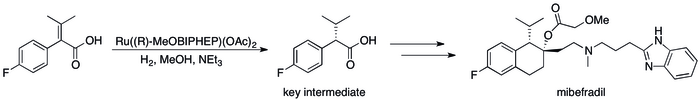
Катализаторы гидрирования, вдохновленные Нойори, были применены в коммерческом синтезе ряда тонких химических веществ. (R)-1,2-Пропандиол, предшественник антибактериального левофлоксацина , может быть эффективно синтезирован из гидроксиацетона с использованием асимметричного гидрирования Нойори: [17]

Новые пути сосредоточены на гидрировании (R) -метиллактата . [12]
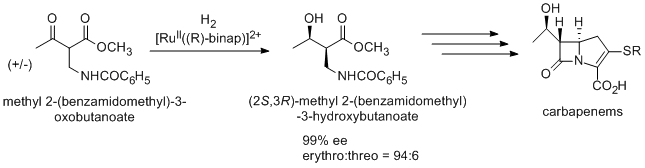
Антибиотик карбапенем также получают с использованием асимметричного гидрирования Нойори через (2S,3R)-метил-2-(бензамидометил)-3-гидроксибутаноат, который синтезируют из рацемического метил-2-(бензамидометил)-3-оксобутаноата путем динамического кинетического разрешения .
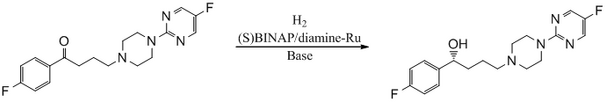
Антипсихотическое средство БМС 181100 синтезировано с использованием катализатора БИНАП/диамин-Ru.
Ссылки
[ редактировать ]- ^ «Нобелевская премия по химии 2001 г.» . 10 октября 2001 г.
- ^ Акабори, С.; Сакурай, С.; Идзуми, Ю.; Фуджи, Ю. (1956). «Асимметричный катализатор». Природа . 178 (4528): 323. Бибкод : 1956Natur.178..323A . дои : 10.1038/178323b0 . ПМИД 13358737 . S2CID 4221816 .
- ^ Jump up to: а б с Ноёри, Р. (2003). «Асимметричный катализ: наука и возможности (Нобелевская лекция 2001 г.)». Расширенный синтез и катализ . 345 (12): 15–41. дои : 10.1002/adsc.200390002 .
- ^ Jump up to: а б с Ноулз, WS (2002). «Асимметричное гидрирование (Нобелевская лекция)». Angewandte Chemie, международное издание . 41 (12): 1998–2007. doi : 10.1002/1521-3773(20020617)41:12<1998::AID-ANIE1998>3.0.CO;2-8 . ПМИД 19746594 .
- ^ Крэбтри, Роберт (1979). «Соединения иридия в катализе» . Отчеты о химических исследованиях . 12 (9): 331–337. дои : 10.1021/ar50141a005 .
- ^ Пфальц, А. (2004). «Специальный выпуск асимметричного катализа, часть II: Разработка хиральных лигандов для асимметричного катализа: от C 2 -симметричных P , P- и N , N -лигандов к стерически и электронно несимметричным P , N -лигандам» . Труды Национальной академии наук . 101 (16): 5723–5726. Бибкод : 2004PNAS..101.5723P . дои : 10.1073/pnas.0307152101 . ПМЦ 395974 . ПМИД 15069193 .
- ^ Jump up to: а б де Врис, Йоханнес Г.; Эльзевир, Корнелис Дж., ред. (20 октября 2006 г.). Справочник по гомогенному гидрированию (1-е изд.). Уайли. дои : 10.1002/9783527619382 . ISBN 978-3-527-31161-3 .
- ^ Гриднев И.Д.; Имамото, Т. (2004). «О механизме стереоселекции при резус-катализируемом асимметричном гидрировании: общий подход к предсказанию смысла энантиоселективности». Отчеты о химических исследованиях . 37 (9): 633–644. дои : 10.1021/ar030156e . ПМИД 15379579 .
- ^ Вэнь, Цзялинь; Ван, Фанъюань; Чжан, Сюму (2021). «Асимметричное гидрирование, катализируемое комплексами переходных металлов первого ряда» . Обзоры химического общества . 50 (5): 3211–3237. дои : 10.1039/D0CS00082E . ISSN 0306-0012 . ПМИД 33480901 .
- ^ Гриднев Илья Дмитриевич; Имамото, Цунео (1 сентября 2004 г.). «О механизме стереоселекции при резус-катализируемом асимметричном гидрировании: общий подход к предсказанию смысла энантиоселективности» . Отчеты о химических исследованиях . 37 (9): 633–644. дои : 10.1021/ar030156e . ISSN 0001-4842 .
- ^ Имамото, Цунео; Тамура, Кен; Чжан, Чжэньфэн; Хориучи, Юми; Сугия, Масаси; Ёсида, Кадзухиро; Янагисава, Акира; Гриднев, Илья Д. (25 января 2012 г.). «Жесткие P-хиральные фосфиновые лиганды с трет-бутилметилфосфиногруппами для катализируемого родием асимметричного гидрирования функционализированных алкенов» . Журнал Американского химического общества . 134 (3): 1754–1769. дои : 10.1021/ja209700j . ISSN 0002-7863 . ПМИД 22192064 .
- ^ Jump up to: а б с д Дуб, Павел А.; Гордон, Джон К. (2018). «Роль связанной с металлом функциональности N – H в молекулярных катализаторах типа Нойори». Обзоры природы Химия . 2 (12): 396–408. дои : 10.1038/s41570-018-0049-z . S2CID 106394152 .
- ^ Ноёри, Рёдзи; Масаси Ямакава; Шохей Хасигути (1 ноября 2001 г.). «Бифункциональный катализ металл-лиганд: неклассический механизм асимметричного переноса водорода между спиртами и карбонильными соединениями». Журнал органической химии . 66 (24): 7931–7944. дои : 10.1021/jo010721w . ПМИД 11722188 .
- ^ Окума, Т.; Оока, Х.; Икария, Т.; Нойори, Р. (1995), «Преимущественное гидрирование альдегидов и кетонов», Журнал Американского химического общества , 117 (41): 10417–10418, doi : 10.1021/ja00146a041.
- ^ Jump up to: а б Икария, Т.; Блэкер, Эй Джей (2007). «Асимметричное трансферное гидрирование кетонов с помощью бифункциональных молекулярных катализаторов на основе переходных металлов». Отчеты о химических исследованиях . 40 (12): 1300–1308. дои : 10.1021/ar700134q . ПМИД 17960897 .
- ^ Jump up to: а б Пилкингтон, К.; Леннон, И. (2003). «Применение асимметричного гидрирования для производства фармацевтических промежуточных продуктов: необходимость разнообразия катализаторов». Синтез . 2003 (11): 1639. doi : 10.1055/s-2003-40871 .
- ^ Jump up to: а б с Нойори, Р. (2002), «Асимметричный катализ: наука и возможности (Нобелевская лекция)», Angewandte Chemie International Edition , 41 (12): 2008–22, doi : 10.1002/1521-3773(20020617)41:12<2008 ::aid-anie2008>3.0.co;2-4 , PMID 19746595
- ^ Энталер, С.; Юнге, К.; Беллер, М. (2008). «Устойчивый катализ металлов железом: от ржавчины к восходящей звезде?». Angewandte Chemie, международное издание . 47 (18): 3317–21. дои : 10.1002/anie.200800012 . ПМИД 18412184 .
- ^ Михайлин А.; Лох, Эй Джей; Моррис, Р.Х. (2009). «Эффективное асимметричное переносное гидрирование кетонов, катализируемое комплексом железа, содержащим тетрадентатный лиганд P-N-N-P, образованный путем матричного синтеза». Журнал Американского химического общества . 131 (4): 1394–1395. дои : 10.1021/ja809493h . ПМИД 19133772 .
- ^ Зонненберг, Дж. Ф.; Кумбс, Н.; Дубе, Пенсильвания; Моррис, Р.Х. (2012). «Наночастицы железа, катализирующие асимметричное переносное гидрирование кетонов». Журнал Американского химического общества . 134 (13): 5893–5899. дои : 10.1021/ja211658t . ПМИД 22448656 .
- ^ Уайтселл, Дж. К. (1989). «С 2 симметрия и асимметричная индукция». Химические обзоры . 89 (7): 1581–1590. дои : 10.1021/cr00097a012 .
- ^ Ноулз, WS; Сабаки, MJ; Виноградник, BD (1972). «Каталитическое асимметрическое гидрирование». Журнал Химического общества, Химические коммуникации . 214 (1): 119–124. дои : 10.1039/C39720000010 . ПМИД 4270504 .
- ^ Jump up to: а б Джерфагон, Т.; Рено, JL; Брюно, К. (2004). «Хиральные монодентатные фосфорные лиганды для асимметричного гидрирования, катализируемого родием». Тетраэдр: Асимметрия . 15 (14): 2101. doi : 10.1016/j.tetasy.2004.04.037 .
- ^ Ван Ден Берг, М.; Миннаард, Эй Джей; Шудде, Е.П.; Ван Эш, Дж.; Де Врис, AHM; Де Врис, JG; Феринга, Б.Л. (2000). «Высокоэнантиоселективное родий-катализируемое гидрирование с монодентатными лигандами» (PDF) . Журнал Американского химического общества . 122 (46): 11539. doi : 10.1021/ja002507f . hdl : 11370/3c92d080-f024-45fe-b997-b100634bd612 . S2CID 95403641 .
- ^ Фу, Ю.; Се, Дж. Х.; Ху, АГ; Чжоу, Х.; Ван, LX; Чжоу, Квинсленд (2002). «Новые монодентатные спирофосфорные лиганды для реакций гидрирования, катализируемых родием». Химические коммуникации (5): 480–481. дои : 10.1039/B109827F . ПМИД 12120551 .
- ^ Ритц, Монтана; Селл, Т.; Мейсвинкель, А.; Мелер, Г. (2003). «Новый принцип комбинаторного асимметричного катализа переходных металлов: смеси хиральных монодентатных P-лигандов» . Angewandte Chemie, международное издание . 42 (7): 790–3. дои : 10.1002/anie.200390209 . ПМИД 12596201 .
- ^ Виноградник, BD; Ноулз, WS; Сабаки, MJ; Бахман, Г.Л.; Вайнкауф, диджей (1977). «Асимметричное гидрирование. Родий-хиральный бисфосфиновый катализатор». Журнал Американского химического общества . 99 (18): 5946. doi : 10.1021/ja00460a018 .
- ^ Ноулз, WS; Сабаки, MJ; Виноградник, BD; Вайнкауф, диджей (1975). «Асимметричное гидрирование комплексом родия и хирального бисфосфина». Журнал Американского химического общества . 97 (9): 2567. doi : 10.1021/ja00842a058 .
- ^ Мюллер, Д.; Умбрихт, Г.; Вебер, Б.; Пфальц, А. (1991). «C 2 -симметричные 4,4',5,5'-тетрагидроби(оксазолы) и 4,4',5,5'-тетрагидро-2,2'-метиленбис[оксазолы] в качестве хиральных лигандов для энантиоселективного катализа, предварительное сообщение» . Helvetica Chimica Acta . 74 : 232–240. дои : 10.1002/hlca.19910740123 .
- ^ Jump up to: а б Хельмхен, Г.Н.; Пфальц, А. (2000). «Фосфинооксазолины: новый класс универсальных модульных P , N -лигандов для асимметричного катализа». Отчеты о химических исследованиях . 33 (6): 336–345. дои : 10.1021/ar9900865 . ПМИД 10891051 .
- ^ Лайтфут, А.; Шнайдер, П.; Пфальц, А. (1998). «Энантиоселективное гидрирование олефинов с иридий-фосфанодигидрооксазоловыми катализаторами». Angewandte Chemie, международное издание . 37 (20): 2897–2899. doi : 10.1002/(SICI)1521-3773(19981102)37:20<2897::AID-ANIE2897>3.0.CO;2-8 . ПМИД 29711115 .
- ^ Францке, А.; Пфальц, А. (2011). «Цвиттер-ионные комплексы иридия с P , N -лигандами как катализаторы асимметричного гидрирования алкенов». Химия: Европейский журнал . 17 (15): 4131–44. дои : 10.1002/chem.201003314 . ПМИД 21381140 .
- ^ Маурер, Ф.; Хуч, В.; Ульрих, А.; Казмайер, У. (2012). «Разработка катализаторов стереоселективного гидрирования α,β-ненасыщенных кетонов». Журнал органической химии . 77 (11): 5139–5143. дои : 10.1021/jo300246c . ПМИД 22571628 .
- ^ Ражео, Д.; Вудманси, ДХ; Пугин, БТ; Пфальц, А. (2011). «Комплексы P,O-лиганд/иридий на основе пролина как высокоселективные катализаторы: асимметричное гидрирование тризамещенных алкенов». Angewandte Chemie, международное издание . 50 (41): 9598–601. дои : 10.1002/anie.201104105 . ПМИД 21882320 .
- ^ Jump up to: а б с Перри, MC; Кюи, X.; Пауэлл, Монтана; Хоу, ДР; Рейбенспис, Дж. Х.; Берджесс, К. (2003). «Оптически активные иридийимидазол-2-илиден-оксазолиновые комплексы: получение и использование в асимметричном гидрировании арилалкенов». Журнал Американского химического общества . 125 (1): 113–123. дои : 10.1021/ja028142b . ПМИД 12515512 .
- ^ Jump up to: а б Нанчен, С.; Пфальц, А. (2006). «Синтез и применение хиральных N -гетероциклических карбен-оксазолиновых лигандов: энантиоселективное гидрирование, катализируемое иридием» . Химия: Европейский журнал . 12 (17): 4550–8. дои : 10.1002/chem.200501500 . ПМИД 16557626 .
- ^ Чжу, Ю.; Берджесс, К. (2008). «Асимметричное гидрирование виниловых эфиров, катализируемое иридием». Расширенный синтез и катализ . 350 (7–8): 979. doi : 10.1002/adsc.200700546 .
- ^ Чжао, Дж.; Берджесс, К. (2009). «Хироны альдольного типа в результате асимметричного гидрирования тризамещенных алкенов». Органические письма . 11 (10): 2053–2056. дои : 10.1021/ol900308w . ПМИД 19368378 .
- ^ Чжао, Дж.; Берджесс, К. (2009). «Синтез вицинальных диметилхиронов путем асимметричного гидрирования тризамещенных алкенов». Журнал Американского химического общества . 131 (37): 13236–13237. дои : 10.1021/ja905458n . ПМИД 19719102 .
- ^ Чжоу, Дж.; Берджесс, К. (2007). «Α,ω-функционализированные 2,4-диметилпентановые диады и 2,4,6-триметилгептановые триады посредством асимметричного гидрирования». Angewandte Chemie, международное издание . 46 (7): 1129–31. дои : 10.1002/anie.200603635 . ПМИД 17200966 .
- ^ Чжоу, Дж.; Чжу, Ю.; Берджесс, К. (2007). «Синтез ( S , R , R , S , R , S )-4,6,8,10,16,18-гексаметилдокозана из Antitrogus parvulus посредством диастереоселективного гидрирования». Органические письма . 9 (7): 1391–1393. дои : 10.1021/ol070298z . ПМИД 17338543 .
- ^ Урбан, С.; Ортега, Н.; Глориус, Ф. (2011). «Лиганд-контролируемое высокорегиоселективное и асимметричное гидрирование хиноксалинов, катализируемое N -гетероциклическими карбеновыми комплексами рутения». Angewandte Chemie, международное издание . 50 (16): 3803–6. дои : 10.1002/anie.201100008 . ПМИД 21442699 .
- ^ Кюи, X.; Берджесс, К. (2005). «Каталитическое гомогенное асимметричное гидрирование в значительной степени нефункционализированных алкенов». Химические обзоры . 105 (9): 3272–3296. дои : 10.1021/cr0500131 . ПМИД 16159153 .
- ^ Памиес, О.; Андерссон, PG; Дьегес, М. (2010). «Асимметричное гидрирование минимально функционализированных концевых олефинов: альтернативная устойчивая и прямая стратегия получения энантиообогащенных углеводородов». Химия: Европейский журнал . 16 (48): 14232–40. дои : 10.1002/chem.201001909 . ПМИД 21140401 .
- ^ Вудманси, ДХ; Пфальц, А. (2011). «Асимметричное гидрирование алкенов, лишенных координационных групп». Химические коммуникации . 47 (28): 7912–7916. дои : 10.1039/c1cc11430a . ПМИД 21556431 .
- ^ Мазуэла, Дж.; Верендел, Джей Джей; Колл, М.; Шеффнер, Б.Н.; Бёрнер, А.; Андерссон, PG; ПаМис, О.; ДиГес, М. (2009). «Иридий-фосфит-оксазолиновые катализаторы высокоэнантиоселективного гидрирования терминальных алкенов». Журнал Американского химического общества . 131 (34): 12344–12353. дои : 10.1021/ja904152r . ПМИД 19658416 .
- ^ Хоу, GH; Се, Дж. Х.; Ван, LX; Чжоу, Квинсленд (2006). «Высокоэффективное асимметрическое гидрирование енаминов, катализируемое Rh (I) с использованием моноденте-спирофосфонитных лигандов». Журнал Американского химического общества . 128 (36): 11774–11775. дои : 10.1021/ja0644778 . ПМИД 16953614 .
- ^ Хоу, GH; Се, Дж. Х.; Ян, ПК; Чжоу, Квинсленд (2009). «Асимметричное гидрирование циклических енаминов, катализируемое иридием». Журнал Американского химического общества . 131 (4): 1366–1367. дои : 10.1021/ja808358r . ПМИД 19132836 .
- ^ Ноёри, Р.; Окума, Т. (2001). «Асимметричный катализ с помощью архитектурной и функциональной молекулярной инженерии: практическое хемо- и стереоселективное гидрирование кетонов» . Angewandte Chemie, международное издание . 40 (1): 40–73. doi : 10.1002/1521-3773(20010105)40:1<40::AID-ANIE40>3.0.CO;2-5 . ПМИД 11169691 .
- ^ Хемс, WP; Гроарк, М.; Занотти-Героза, А.; Граса, Джорджия (2007). «Комплексы [(бисфосфин) Ru(II) диамин] при асимметричном гидрировании: расширение области применения диаминового лиганда». Отчеты о химических исследованиях . 40 (12): 1340–1347. дои : 10.1021/ar7000233 . ПМИД 17576143 .
- ^ Ноёри, Р.; Ямакава, М.; Хасигути, С. (2001). «Бифункциональный катализ металл-лиганд: неклассический механизм асимметричного переноса водорода между спиртами и карбонильными соединениями». Журнал органической химии . 66 (24): 7931–7944. дои : 10.1021/jo010721w . ПМИД 11722188 .
- ^ Чжу, Сан-Франциско; Се, JB; Чжан, Ю.З.; Ли, С.; Чжоу, Квинсленд (2006). «Точно определенные хиральные катионные комплексы спиро-иридий/фосфин-оксазолин для высокоэнантиоселективного гидрирования иминов при давлении окружающей среды». Журнал Американского химического общества . 128 (39): 12886–12891. дои : 10.1021/ja063444p . ПМИД 17002383 .
- ^ Се, Дж. Х.; Лю, XY; Се, JB; Ван, LX; Чжоу, Квинсленд (2011). «Дополнительная координационная группа приводит к созданию чрезвычайно эффективных хиральных иридиевых катализаторов асимметричного гидрирования кетонов». Angewandte Chemie, международное издание . 50 (32): 7329–32. дои : 10.1002/anie.201102710 . ПМИД 21751315 .
- ^ Окума, Т.; Оока, Х.; Ямакава, М.; Икария, Т.; Нойори, Р. (1996), «Стереоселективное гидрирование простых кетонов, катализируемое комплексами рутения (II)», Журнал органической химии , 61 (15): 4872–4873, doi : 10.1021/jo960997h
- ^ Ноёри, Р.; Окума, Т. (2001), «Асимметричный катализ с помощью архитектурной и функциональной молекулярной инженерии: практическое химио- и стереоселективное гидрирование кетонов», Angewandte Chemie International Edition , 40 (1): 40–73, doi : 10.1002/1521-3773( 20010105)40:1<40::aid-anie40>3.0.co;2-5 , PMID 11169691
- ^ Jump up to: а б Чжоу, Ю.Г. (2007). «Асимметричное гидрирование гетероароматических соединений». Отчеты о химических исследованиях . 40 (12): 1357–1366. CiteSeerX 10.1.1.653.5495 . дои : 10.1021/ar700094b . ПМИД 17896823 .
- ^ Ван, ВБ; Лу, С.М.; Ян, П.Ю.; Хан, XW; Чжоу, Ю.Г. (2003). «Высокоэнантиоселективное иридий-катализируемое гидрирование гетероароматических соединений, хинолинов». Журнал Американского химического общества . 125 (35): 10536–10537. CiteSeerX 10.1.1.651.3119 . дои : 10.1021/ja0353762 . ПМИД 12940733 .
- ^ Jump up to: а б Сюй, Л.; Лам, К.Х.; Джи, Дж.; Ву, Дж.; Фан, QH; Ло, WH; Чан, ASC (2005). «Аэростабильный комплекс Ir-(P-Phos) для высокоэнантиоселективного гидрирования хинолинов и их иммобилизации в диметиловом эфире поли(этиленгликоля) (ДМПЭГ)». Химические коммуникации (11): 1390–2. дои : 10.1039/B416397D . hdl : 10397/8906 . ПМИД 15756313 .
- ^ Лам, К.Х.; Сюй, Л.; Фэн, Л.; Фан, QH; Лам, Флорида; Ло, WH; Чан, ASC (2005). «Высокоэнантиоселективное иридий-катализируемое гидрирование производных хинолина с использованием хирального фосфинита H8-BINAPO». Расширенный синтез и катализ . 347 (14): 1755. doi : 10.1002/adsc.200505130 . hdl : 10397/26878 .
- ^ Ван, ZJ; Дэн, Дж. Дж.; Ли, Ю.; Он, Ю.М.; Тан, WJ; Фан, QH (2007). «Энантиоселективное гидрирование хинолинов, катализируемое дендримерами с ядром Ir (BINAP): резкое усиление каталитической активности». Органические письма . 9 (7): 1243–1246. дои : 10.1021/ol0631410 . ПМИД 17328554 .
- ^ Цю, Л.; Квонг, Финляндия; Ву, Дж.; Лам, Вашингтон; Чан, С.; Ю, Вайоминг; Ли, Ю.М.; Го, Р.; Чжоу, З.; Чан, ASC (2006). «Новый класс универсальных атропоизомерных дифосфиновых лигандов с хиральными мостиками: чрезвычайно эффективный синтез лигандов и их применение в высокоэнантиоселективных реакциях гидрирования». Журнал Американского химического общества . 128 (17): 5955–5965. дои : 10.1021/ja0602694 . hdl : 10397/60397 . ПМИД 16637664 .
- ^ Ритц, Монтана; Ли, X. (2006). «Асимметричное гидрирование хинолинов, катализируемое иридиевыми комплексами дифосфонитов, полученных из БИНОЛа». Химические коммуникации (20): 2159–60. дои : 10.1039/b602320g . ПМИД 16703140 .
- ^ Рюпинг; Антончик, А.; Тайссманн, Т. (2006). «Высокоэнантиоселективная каскадная реакция, катализируемая кислотой Бренстеда: органокаталитическое трансферное гидрирование хинолинов и их применение в синтезе алкалоидов». Angewandte Chemie International Edition на английском языке . 45 (22): 3683–3686. дои : 10.1002/anie.200600191 . ПМИД 16639754 .
- ^ Тан, В.; Сюй, Л.; Фан, QH; Ван, Дж.; Фан, Б.; Чжоу, З.; Лам, К.Х.; Чан, ASC (2009). «Асимметричное гидрирование хиноксалинов дифосфинитными лигандами: практический синтез энантиообогащенных замещенных тетрагидрохиноксалинов». Angewandte Chemie, международное издание . 48 (48): 9135–8. дои : 10.1002/anie.200904518 . hdl : 10397/20432 . ПМИД 19876991 .
- ^ Рюпинг, М.; Тато, Ф.; Шепке, Франция (2010). «Первое общее, эффективное и высокоэнантиоселективное восстановление хиноксалинов и хиноксалинонов». Химия: Европейский журнал . 16 (9): 2688–91. дои : 10.1002/chem.200902907 . ПМИД 20140920 .
- ^ Глориус, Ф.; Спилкамп, Н.; Холле, С.; Годдард, Р.; Леманн, CW (2004). «Эффективное асимметричное гидрирование пиридинов». Международное издание «Прикладная химия» . 43 (21): 2850–2. дои : 10.1002/anie.200453942 . ПМИД 15150766 .
- ^ Да, ЗС; Чен, МВт; Чен, QA; Ши, Л.; Дуань, Ю.; Чжоу, Ю.Г. (2012). «Асимметричное гидрирование солей пиридиния, катализируемое иридием». Angewandte Chemie, международное издание . 51 (40): 10181–4. дои : 10.1002/anie.201205187 . ПМИД 22969060 .
- ^ Тан, WJ; Тан, Дж.; Сюй, Эл-Джей; Лам, К.Х.; Фан, QH; Чан, ASC (2010). «Высокоэнантиоселективное гидрирование производных хинолина и пиридина с иридий-(P-фос) катализатором». Расширенный синтез и катализ . 352 (6): 1055. doi : 10.1002/adsc.200900870 . hdl : 10397/22884 .
- ^ Рюпинг, М.; Антончик, AP (2007). «Органокаталитическое энантиоселективное восстановление пиридинов». Angewandte Chemie, международное издание . 46 (24): 4562–5. дои : 10.1002/anie.200701158 . ПМИД 17492817 .
- ^ Баеза, А.; Пфальц, А. (2010). -защищенных индолов , катализируемое иридием «Асимметричное гидрирование N ». Химия: Европейский журнал . 16 (7): 2036–9. дои : 10.1002/chem.200903105 . ПМИД 20104554 .
- ^ Сяо, ЮК; Ван, К.; Яо, Ю.; Сан, Дж.; Чен, ЮК (2011). «Прямое асимметричное гидросилилирование индолов: комбинированная активация основания Льюиса и кислоты Бренстеда». Angewandte Chemie, международное издание . 50 (45): 10661–4. дои : 10.1002/anie.201105341 . ПМИД 21932274 .
- ^ Дуань, Ю.; Чен, МВт; Да, ЗС; Ван, Д.С.; Чен, QA; Чжоу, Ю.Г. (2011). «Энантиоселективный подход к 2,3-дизамещенным индолинам посредством последовательных тандемных реакций, стимулируемых кислотой Бренстеда и Pd-комплексом». Химия: Европейский журнал . 17 (26): 7193–7. дои : 10.1002/chem.201100576 . ПМИД 21567504 .
- ^ Ван, Д.С.; Да, ЗС; Чен, QA; Чжоу, Ю.Г.; Ю, КБ; Фан, HJ; Дуань, Ю. (2011). «Высокоэнантиоселективное частичное гидрирование простых пирролов: легкий доступ к хиральным 1-пирролинам». Журнал Американского химического общества . 133 (23): 8866–8869. дои : 10.1021/ja203190t . ПМИД 21591641 .
- ^ Ван, Д.С.; Чен, QA; Лу, С.М.; Чжоу, Ю.Г. (2012). «Асимметричное гидрирование гетероаренов и аренов». Химические обзоры . 112 (4): 2557–2590. дои : 10.1021/cr200328h . ПМИД 22098109 .
- ^ Урбан, С.; Бейринг, Б.; Ортега, Н.; Пол, Д.; Глориус, Ф. (2012). «Асимметричное гидрирование тиофенов и бензотиофенов». Журнал Американского химического общества . 134 (37): 15241–15244. дои : 10.1021/ja306622y . ПМИД 22934527 .
- ^ Jump up to: а б Хейтбаум, М.; Глориус, Ф.; Эшер, И. (2006). «Асимметричный гетерогенный катализ». Angewandte Chemie, международное издание . 45 (29): 4732–62. дои : 10.1002/anie.200504212 . ПМИД 16802397 .
- ^ Юн, М.; Шрирамбаладжи, Р.; Ким, К. (2012). «Гомохиральные металлоорганические каркасы для асимметричного гетерогенного катализа». Химические обзоры . 112 (2): 1196–1231. дои : 10.1021/cr2003147 . ПМИД 22084838 .
- ^ Ху, А.; Нго, HL; Лин, В. (2003). «Хиральные пористые гибридные твердые вещества для практического гетерогенного асимметричного гидрирования ароматических кетонов». Журнал Американского химического общества . 125 (38): 11490–11491. дои : 10.1021/ja0348344 . ПМИД 13129339 .
- ^ Блазер, Ху; Шпиндлер, Ф.; Студер, М. (2001). «Энантиоселективный катализ в производстве тонкой химии». Прикладной катализ А: Общие сведения . 221 (1–2): 119–143. дои : 10.1016/S0926-860X(01)00801-8 . ПМИД 12613584 .
- ^ Блазер, Ганс Ульрих; Федерсель, Ханс-Юрген, ред. (2010). Асимметричный катализ в промышленных масштабах . Вайнхайм: Wiley-VCH. стр. 13–16. дои : 10.1002/9783527630639 . ISBN 978-3-527-63063-9 .
- ^ Якобсен, Э.Н.; Пфальц, Андреас; Ямамато, Х., ред. (1999). Комплексный асимметричный катализ . Берлин; Нью-Йорк: Спрингер. стр. 1443–1445. ISBN 978-3-540-64336-4 .





