Оксазолин

| |
| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
4,5-Дигидро-1,3-оксазол | |
| Другие имена
Δ2-оксазолин
| |
| Идентификаторы | |
| |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.007.274 |
ПабХим CID
|
|
| НЕКОТОРЫЙ |
|
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 3 Ч 5 НЕТ | |
| Молярная масса | 71.079 g·mol −1 |
| Плотность | 1.075 единица? [ 1 ] |
| Точка кипения | 98 ° C (208 ° F; 371 К) [ 1 ] |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
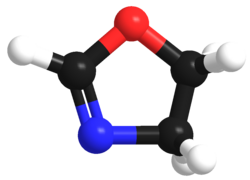
Оксазолин — пятичленное гетероциклическое органическое соединение формулы С 3 Ч 5 НЕТ . Он является родителем семейства соединений, называемых оксазолинами (ударение на множественное число), которые содержат неводородные заместители у углерода и/или азота. Оксазолины являются ненасыщенными аналогами оксазолидинов и изомерны изоксазолинам , где N и O связаны напрямую. Известны два изомера оксазолина в зависимости от расположения двойной связи.
Сам по себе оксазолин не имеет применения, однако потенциальное применение оксазолинов широко исследовалось. Эти применения включают использование в качестве лигандов в асимметричном катализе , в качестве защитных групп для карбоновых кислот и все чаще в качестве мономеров для производства полимеров .
Изомеры
[ редактировать ]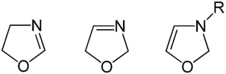 |
Возможны три структурных изомера оксазолина в зависимости от расположения двойной связи, однако распространены только 2-оксазолины. 4-Оксазолины образуются в качестве промежуточных продуктов при производстве некоторых азометинилидов. [ 2 ] но в остальном они редки. 3-Оксазолины еще менее распространены, но синтезированы фотохимическим путем. [ 3 ] и раскрытием кольца азиринов . [ 4 ] Эти три формы не легко взаимопревращаются и, следовательно, не являются таутомерами .
Существует четвертый изомер, в котором атомы O и N расположены рядом, он известен как изоксазолин . |
Синтез
[ редактировать ]Синтез 2-оксазолиновых колец хорошо известен и обычно происходит посредством циклизации 2-аминоспирта ( обычно получаемого восстановлением аминокислоты ) с подходящей функциональной группой. [ 5 ] [ 6 ] [ 7 ] Общий механизм обычно подчиняется правилам Болдуина .
Из карбоновых кислот
[ редактировать ]Обычный путь получения оксазолинов включает реакцию ацилхлоридов с 2-аминоспиртами. Тионилхлорид обычно используется для получения хлорангидрида in situ, при этом необходимо поддерживать безводные условия, поскольку оксазолины могут быть раскрыты хлоридом, если имин становится протонированным. [ 8 ] Реакцию обычно проводят при комнатной температуре. Если реагенты более мягкие, чем SOCl 2 требуются оксалилхлорид . , можно использовать [ 9 ] Аминометилпропанол — популярный предшественник аминоспирта. [ 10 ] [ 11 ]
Модификация реакции Аппеля позволяет синтезировать оксазолиновые кольца. [ 12 ] Этот метод протекает в относительно мягких условиях, однако из-за большого количества образующегося оксида трифенилфосфина он не идеален для крупномасштабных реакций. Использование этого метода становится все менее распространенным из-за четыреххлористого углерода ограничений на использование Монреальским протоколом .
Из альдегидов
[ редактировать ]Циклизация аминоспирта и альдегида дает промежуточный оксазолидин , который можно превратить в оксазолин обработкой окислителем на основе галогена ( например, NBS , [ 13 ] или йод [ 14 ] ); потенциально это происходит через имидоилгалогенид . Было показано, что этот метод эффективен для широкого спектра ароматических и алифатических альдегидов, однако богатые электронами ароматические R-группы, такие как фенолы , непригодны, поскольку они преимущественно подвергаются быстрому электрофильному ароматическому галогенированию с окислителем.
Из нитрилов
[ редактировать ]Использование каталитических количеств ZnCl 2 для получения оксазолинов из нитрилов было впервые описано Витте и Зеелигером. [ 15 ] [ 16 ] и далее развито Bolm et al . [ 17 ] Для успешного проведения реакции требуются высокие температуры, и ее обычно проводят при кипячении хлорбензола в безводных условиях. Точный механизм реакции никогда не был предложен, хотя он, вероятно, подобен реакции Пиннера ; предшествующий через промежуточный амидин . [ 18 ] [ 19 ] Были проведены ограниченные исследования по выявлению альтернативных растворителей или катализаторов реакции. [ 20 ] [ 21 ]
Приложения
[ редактировать ]Лиганды
[ редактировать ]Лиганды, содержащие хиральное 2-оксазолиновое кольцо, находят применение в асимметричном катализе благодаря простоте синтеза, широкому спектру форм и эффективности для многих типов каталитических превращений. [ 22 ] [ 23 ]
2-Замещенные оксазолины обладают умеренно жестким N-донором. Хиральность легко достигается с помощью 2- аминоспиртов, полученных восстановлением аминокислот ; которые оптически чисты и недороги. Поскольку стереоцентр в таких оксазолинах примыкает к координирующему атому N, это может влиять на селективность процессов, протекающих на металлоцентре. Кольцо термически стабильно. [ 24 ] и устойчив к нуклеофилам, основаниям, радикалам и слабым кислотам. [ 25 ] а также достаточно устойчив к гидролизу и окислению; [ 5 ] таким образом, можно ожидать, что он останется стабильным в широком диапазоне условий реакции.
Основные классы лигандов на основе оксазолина включают:
Известные специальные оксазолиновые лиганды включают:
- Трис-оксазолины (TRISOX)
- Бис(оксазолинато)с
- Тризоксазолинилборатные лиганды
Полимеры
[ редактировать ]Некоторые 2-оксазолины, такие как 2-этил-2-оксазолин , подвергаются живой катионной полимеризации с раскрытием кольца с образованием поли(2-оксазолинов). [ 26 ] Это полиамиды, и их можно рассматривать как аналоги пептидов ; они имеют множество потенциальных применений [ 27 ] и получили особое внимание из-за их биомедицинского использования. [ 28 ] [ 29 ]
Анализ жирных кислот
[ редактировать ]Диметилоксазолиновые ( ДМОКС ) производные жирных кислот поддаются анализу методом газовой хроматографии.
См. также
[ редактировать ]Структурные аналоги
- Бензоксазол : оксазолин присоединен к бензольному кольцу.
- Оксазол : имеет две двойные связи.
- Оксазолидин : не имеет двойных связей.
- Тиазолин : кислород заменен серой.
Другие страницы
- Аминорекс - препарат, содержащий оксазолиновое кольцо.
Ссылки
[ редактировать ]- ^ Jump up to: а б Венкер, Х. (1938). «Синтез из этаноламина. V. Синтез Δ2-оксазолина и 2,2'-Δ2-диоксазолина». Журнал Американского химического общества . 60 (9): 2152–2153. дои : 10.1021/ja01276a036 .
- ^ Ведейс, Э.; Гриссом, JW (1988). «4-Оксазолиновый путь к стабилизированным азометинилидам. Контролируемое восстановление солей оксазолия». Журнал Американского химического общества . 110 (10): 3238–3246. дои : 10.1021/ja00218a038 .
- ^ Арместо, Диего; Ортис, Мария Дж.; Перес-Оссорио, Рафаэль; Хорспул, Уильям М. (1983). «Новая фотохимическая миграция 1,2-ацила в еноловом эфире. Синтез производных 3-оксазолина». Буквы тетраэдра . 24 (11): 1197–1200. дои : 10.1016/S0040-4039(00)86403-5 .
- ^ Са, Маркус CM; Кашерес, Альберт (1996). «Электронно-опосредованная селективность при раскрытии кольца 1-азиринов. Режим 3-X: удобный путь к 3-оксазолинам». Журнал органической химии . 61 (11): 3749–3752. дои : 10.1021/jo9518866 . ПМИД 11667224 .
- ^ Jump up to: а б Уайли, Ричард Х.; Беннетт, Леонард Л. (1949). «Химия оксазолинов». Химические обзоры . 44 (3): 447–476. дои : 10.1021/cr60139a002 . S2CID 95217957 .
- ^ Фрамп, Джон А. (1971). «Оксазолины. Их получение, реакции и применение». Химические обзоры . 71 (5): 483–505. дои : 10.1021/cr60273a003 .
- ^ Гант, Томас Г.; Мейерс, А.И. (1994). «Химия 2-оксазолинов (1985 – настоящее время)». Тетраэдр . 50 (8): 2297–2360. дои : 10.1016/S0040-4020(01)86953-2 .
- ^ Холерка, Мариан Н.; Персек, Вирджил (2000). " 1 H ЯМР-спектроскопическое исследование механизма образования 2-замещенного 2-оксазолинового кольца и гидролиза соответствующих солей оксазолиния». Европейский журнал органической химии . 2000 (12): 2257–2263. doi : 10.1002/1099-0690(200006)2000:12<2257::AID-EJOC2257>3.0.CO;2-2 .
- ^ Эванс, Дэвид; Петерсон, Гретхен С.; Джонсон, Джеффри С.; Барнс, Дэвид М.; Кампос, Кевин Р.; Верпель, Кейт А. (1998). «Улучшенная методика получения 2,2-бис[2-[4(S)-трет-бутил-1,3-оксазолинилпропана [(S,S)-трет-бутилбис(оксазолина)] и производного меди(II) ) Комплексы». Дж. Орг. Хим . 63 (13): 4541–4544. дои : 10.1021/jo980296f .
- ^ Альберт И. Мейерс; Марк Э. Фланаган (1993). «2,2'-Диметокси-6-формилбифенил». Орг. Синтез . 71 : 107. дои : 10.15227/orgsyn.071.0107 .
- ^ р. Сардини, Стивен; Штольц, Брайан М. (2021). «Дополнение к обсуждению: получение (S)-трет-бутилPy Ox и катализируемого палладием асимметричного сопряженного присоединения арилбороновых кислот» . Органические синтезы . 98 : 117–130. дои : 10.15227/orgsyn.098.0117 . ПМЦ 9558615 . ПМИД 36247231 . S2CID 235855642 .
- ^ Форбрюгген, Хельмут; Кроликевич, Конрад (1993). «Простой синтез Δ2-оксазинов, Δ2-оксазинов, Δ2-тиазолинов и 2-замещенных бензоксазолов». Тетраэдр . 49 (41): 9353–9372. дои : 10.1016/0040-4020(93)80021-К .
- ^ Швекендик, Кирстен; Глориус, Фрэнк (2006). «Эффективный окислительный синтез 2-оксазолинов». Синтез . 2006 (18): 2996–3002. дои : 10.1055/s-2006-950198 .
- ^ Исихара, Мидори; Того, Хидео (2007). «Прямое окислительное превращение альдегидов и спиртов в 2-имидазолины и 2-оксазолины с использованием молекулярного йода». Тетраэдр . 63 (6): 1474–1480. дои : 10.1016/j.tet.2006.11.077 .
- ^ Витте, Гельмут; Зилигер, Вольфганг (1972). «Простой синтез 2-замещенных 2-оксазолинов и 5,6-дигидро-4H-1,3-оксазинов». Angewandte Chemie International Edition на английском языке . 11 (4): 287–288. дои : 10.1002/anie.197202871 .
- ^ Витте, Гельмут; Зилигер, Вольфганг (1974). «Циклические имидовые эфиры нитрилов и аминоспиртов». «Анналы химии» Юстуса Либиха . 1974 (6): 996–1009. дои : 10.1002/jlac.197419740615 .
- ^ Болм, Карстен; Вайкхардт, Конрад; Цендер, Маргарета; Ранфф, Тобиас (1991). «Синтез оптически активных бис(2-оксазолинов): кристаллическая структура комплекса 1,2-бис(2-оксазолинил)бензола ZnCl 2 ». Химические отчеты . 124 (5): 1173–1180. дои : 10.1002/cber.19911240532 .
- ^ Макарычева-Михайлова, А.В.; Кукушкин В.Ю.; Назаров А.А.; Гарновский Д.А.; Помбейро, AJL; Хаукка, М.; Кепплер, Британская Колумбия; Галански, М. (2003). «Амидины, полученные в результате опосредованного Pt (IV) сочетания нитрила и аминоспирта, и их катализируемого Zn (II) превращения в оксазолины». Неорганическая химия . 42 (8): 2805–13. дои : 10.1021/ic034070t . ПМИД 12691592 .
- ^ я. Мейерс, А.; Энн Ханаган, М.; л. Маццу, А. (1981). «2-Оксазолины из амидов через имидаты» . Гетероциклы . 15 : 361. doi : 10.3987/S-1981-01-0361 .
- ^ Корнехо, А.; Фрайле, Дж. М.; Гарсия, Дж.И.; Гил, MJ; Мартинес-Мерино, В.; Майораль, Дж.А.; Пирес, Э.; Вильяльба, И. (2005). «Эффективный и общий однореакторный метод синтеза хиральных бис(оксазолиновых) и пиридиновых бис(оксазолиновых) лигандов». Синлетт (15): 2321–2324 гг. дои : 10.1055/s-2005-872672 . hdl : 10261/270962 . S2CID 95389965 .
- ^ Аспиналл, Хелен С.; Бакса, Джон; Бекингем, Оливер Д.; Иден, Эдвард ГБ; Гривз, Николас; Хоббс, Мэтью Д.; Потьевид, Фрэнсис; Шмидтманн, Марк; Томас, Кристофер Д. (2014). «Добавление правого (или левого) поворота к трис-хелатным комплексам - координационная химия хиральных оксазолилфенолятов с ионами M3+ (M = Al или лантанид)» (PDF) . Далтон Транс . 43 (3): 1434–1442. дои : 10.1039/C3DT52366G . ПМИД 24201227 . Подробности смотрите в дополнительной информации.
- ^ Макманус, Хелен А.; Гири, Патрик Дж. (2004). «Последние разработки в применении оксазолинсодержащих лигандов в асимметричном катализе». Химические обзоры . 104 (9): 4151–4202. дои : 10.1021/cr040642v . ПМИД 15352789 .
- ^ Харгаден, Грайн К.; Гири, Патрик Дж. (2009). «Недавние применения оксазолинсодержащих лигандов в асимметричном катализе». Химические обзоры . 109 (6): 2505–2550. дои : 10.1021/cr800400z . ПМИД 19378971 .
- ^ Лоо, Йим Фан; О'Кейн, Руайри; Джонс, Энтони С.; Аспиналл, Хелен С.; Поттер, Ричард Дж.; Чалкер, Пол Р.; Бикли, Джейми Ф.; Тейлор, Стивен; Смит, Лесли М. (2005). «Осаждение пленок HfO 2 и ZrO 2 методом инжекции жидкости MOCVD с использованием новых мономерных предшественников алкоксидов». Журнал химии материалов . 15 (19): 1896. doi : 10.1039/B417389A .
- ^ Грин, ТВ (1991). Защитные группы в органическом синтезе, 2-е изд . Нью-Йорк: Уайли. стр. 265–266 и 433–436.
- ^ Кобаяши, Сиро; Уяма, Хироши (15 января 2002 г.). «Полимеризация циклических иминоэфиров: от открытия до современного уровня техники» . Журнал науки о полимерах. Часть A: Химия полимеров . 40 (2): 192–209. Бибкод : 2002JPoSA..40..192K . дои : 10.1002/pola.10090 .
- ^ Хугенбум, Ричард (12 октября 2009 г.). «Поли(2-оксазолины): класс полимеров с многочисленными потенциальными применениями». Angewandte Chemie, международное издание . 48 (43): 7978–7994. дои : 10.1002/anie.200901607 . ПМИД 19768817 .
- ^ Адамс, Нико; Шуберт, Ульрих С. (1 декабря 2007 г.). «Поли(2-оксазолины) в контексте биологического и биомедицинского применения» . Обзоры расширенной доставки лекарств . 59 (15): 1504–1520. дои : 10.1016/j.addr.2007.08.018 . ПМИД 17904246 .
- ^ Келли, Эндрю М; Висброк, Франк (15 октября 2012 г.). «Стратегии синтеза гидрогелей на основе поли(2-оксазолина)». Макромолекулярная быстрая связь . 33 (19): 1632–1647. дои : 10.1002/marc.201200333 . ПМИД 22811405 .