Нитрил

В органической химии нитрилом , называют любое органическое соединение имеющее − C ≡ N функциональная группа . Название соединения состоит из основания, в состав которого входит углерод −C≡N с суффиксом «нитрил», например CH 3 CH 2 C≡N называется « пропионитрил » (или пропаннитрил). [1] Приставка циано- в используется как синоним термина нитрил промышленной литературе. Нитрилы содержатся во многих полезных соединениях, включая метилцианоакрилат , используемый в суперклее , и нитриловый каучук , нитрилсодержащий полимер , используемый в не содержащих латекса лабораторных и медицинских перчатках, . Нитриловый каучук также широко используется в качестве автомобильных и других уплотнений, поскольку он устойчив к воздействию топлива и масел. Органические соединения, содержащие несколько нитрильных групп, известны как цианоуглероды .
Неорганические соединения, содержащие Группа −C≡N называется не нитрилами, а цианидами . [2] Хотя и нитрилы, и цианиды могут быть получены из солей цианидов, большинство нитрилов не так токсичны.
Структура и основные свойства
[ редактировать ]Геометрия N-C-C в нитрилах линейна, что отражает sp-гибридизацию тройного связанного углерода. Расстояние C-N короткое, 1,16 Å , что соответствует тройной связи . [3] Нитрилы полярны, на что указывают высокие дипольные моменты. Будучи жидкостями, они имеют высокую относительную диэлектрическую проницаемость , часто около 30 градусов.
История
[ редактировать ]Первое соединение гомологического ряда нитрилов — нитрил муравьиной кислоты — цианистый водород было впервые синтезировано К. В. Шееле в 1782 году. [4] [5] В 1811 г. Ж. Л. Гей-Люссаку удалось получить очень токсичную и летучую чистую кислоту. [6] Около 1832 года бензонитрил , нитрил бензойной кислоты , был получен Фридрихом Вёлером и Юстусом фон Либихом , но из-за минимального выхода синтеза не были определены ни физические, ни химические свойства, а также предложена структура. В 1834 году Теофиль-Жюль Пелуз синтезировал пропионитрил , предположив, что это простой эфир пропионового спирта и синильной кислоты. [7] Синтез бензонитрила Германом Фелингом в 1844 году путем нагревания бензоата аммония был первым методом, давшим достаточное количество вещества для химических исследований. Фелинг определил структуру, сравнив свои результаты с уже известным синтезом цианистого водорода нагреванием формиата аммония . Он придумал для новооткрытого вещества название «нитрил», которое и стало названием этой группы соединений. [8]
Синтез
[ редактировать ]В промышленности основными методами получения нитрилов являются аммоксидирование и гидроцианирование . Оба маршрута являются зелеными в том смысле, что они не производят стехиометрических количеств солей.
Аммоксидирование
[ редактировать ]При аммоксидировании углеводород . частично окисляется присутствии аммиака в Это преобразование практикуется в больших масштабах для акрилонитрила : [9]
При производстве акрилонитрила побочным продуктом является ацетонитрил . В промышленном масштабе методом аммоксидирования получают несколько производных бензонитрила , фталонитрила , а также изобутиронитрила. Процесс катализируется оксидами металлов и, как предполагается, протекает через имин.
Гидроцианирование
[ редактировать ]Гидроцианирование — промышленный метод получения нитрилов из цианида водорода и алкенов. Для этого процесса необходимы гомогенные катализаторы . Примером гидроцианирования является производство адипонитрила , предшественника нейлона-6,6, из 1,3-бутадиена :
Из органических галогенидов и солей цианидов
[ редактировать ]Две реакции метатезиса солей популярны для реакций лабораторного масштаба. В синтезе нитрила Кольбе алкилгалогениды подвергаются нуклеофильному алифатическому замещению щелочных металлов цианидами . Арилнитрилы получают синтезом Розенмунда-фон Брауна .
Обычно цианиды металлов объединяются с алкилгалогенидами, образуя смесь нитрила и изонитрила , хотя соответствующий выбор противоиона и температуры может свести к минимуму последнее. Алкилсульфат синтез полностью устраняет проблему, особенно в неводных условиях ( Пелузы ). [5]
Цианогидрины
[ редактировать ]
Цианогидрины представляют собой особый класс нитрилов. Классически они возникают в результате присоединения цианидов щелочных металлов к альдегидам в реакции циангидрина . Из-за полярности органического карбонила эта реакция не требует катализатора, в отличие от гидроцианирования алкенов. О-силилциангидрины образуются путем присоединения триметилсилилцианида в присутствии катализатора (силилцианирование). Цианогидрины получают также трансциангидриновыми реакциями, начиная, например, с ацетонциангидрина в качестве источника HCN. [10]
Дегидратация амидов
[ редактировать ]Нитрилы могут быть получены дегидратацией первичных амидов . Обычные реагенты для этого включают пятиокись фосфора ( П 2 О 5 ) [11] и тионилхлорид ( SOCl2 ) . [12] При родственной дегидратации вторичные амиды образуют нитрилы в результате разложения амида фон Брауна . В этом случае разрывается одна связь CN.
Окисление аминов
[ редактировать ]Существует множество традиционных методов получения нитрила окислением амина . [13] Кроме того, за последние десятилетия было разработано несколько селективных методов электрохимических процессов. [14]
Из альдегидов и оксимов
[ редактировать ]Превращение альдегидов в нитрилы с помощью альдоксимов — популярный лабораторный путь. Альдегиды легко реагируют с солями гидроксиламина , иногда при температуре окружающей среды, с образованием альдоксимов. Их можно обезвоживать до нитрилов простым нагреванием. [15] хотя в этом может помочь широкий спектр реагентов, включая триэтиламин / диоксид серы , цеолиты или сульфурилхлорид . Родственная гидроксиламин-О-сульфоновая кислота реагирует аналогично. [16]
В особых случаях реакцию Ван Лейзена можно использовать . Биокатализаторы, такие как алифатическая альдоксимдегидратаза, также эффективны.
Реакция Зандмейера
[ редактировать ]Ароматические нитрилы часто получают в лаборатории из анилина через соединения диазония . Это реакция Зандмейера . Для этого требуются цианиды переходных металлов. [17]
Другие методы
[ редактировать ]- Коммерческим источником цианидной группы является цианид диэтилалюминия. Et 2 AlCN , который можно получить из триэтилалюминия и HCN. [18] Его использовали для нуклеофильного присоединения к кетонам . [19] Пример использования см.: Общий синтез таксола Кувадзима.
- Ионы цианида облегчают связывание дибромидов. Реакция α,α’-дибромадипиновой кислоты с цианидом натрия в этаноле дает цианоциклобутан : [20]

- Ароматические нитрилы могут быть получены щелочным гидролизом трихлорметиларилкетиминов ( RC(CCl 3 )=NH ) в синтезе Губена-Фишера [21]
- Нитрилы можно получить из первичных аминов путем окисления . Общие методы включают использование персульфата калия , [22] трихлоризоциануровая кислота , [23] или анодный электросинтез . [24]
- α - Аминокислоты образуют нитрилы и углекислый газ посредством различных способов окислительного декарбоксилирования . [25] [26] Генри Дрисдейл Дакин обнаружил это окисление в 1916 году. [27]
- Из арилкарбоновых кислот ( синтез нитрила Латтса )
Реакции
[ редактировать ]Нитрильные группы в органических соединениях могут вступать в различные реакции в зависимости от реагентов или условий. Нитрильная группа может быть гидролизована, восстановлена или выброшена из молекулы в виде цианид-иона.
Гидролиз
[ редактировать ]Гидролиз . нитрилов RCN протекает в отдельные стадии при кислотной или основной обработке с образованием карбоксамидов RC(=O)NH 2 и затем карбоновые кислоты RCOOH. Гидролиз нитрилов до карбоновых кислот эффективен. В кислоте или щелочи сбалансированные уравнения выглядят следующим образом:
Строго говоря, эти реакции опосредуются (а не катализируются ) кислотой или основанием, поскольку один эквивалент кислоты или основания расходуется на образование аммониевой или карбоксилатной соли соответственно.
Кинетические исследования показывают, что константа скорости второго порядка гидролиза ацетонитрила до ацетамида, катализируемого гидроксид-ионами , составляет 1,6 × 10. −6 М −1 с −1 , что медленнее, чем гидролиз амида до карбоксилата (7,4 × 10 −5 М −1 с −1 ). Таким образом, основной путь гидролиза дает карбоксилат (или амид, загрязненный карбоксилатом). С другой стороны, реакции, катализируемые кислотами, требуют тщательного контроля температуры и соотношения реагентов во избежание образования полимеров, чему способствует экзотермический характер гидролиза. [28] Классическая процедура превращения нитрила в соответствующий первичный амид предполагает добавление нитрила к холодной концентрированной серной кислоте . [29] Дальнейшему превращению в карбоновую кислоту препятствуют низкая температура и низкая концентрация воды.
Два семейства ферментов катализируют гидролиз нитрилов. Нитрилазы гидролизуют нитрилы до карбоновых кислот:
Нитрилгидратазы – это металлоферменты , гидролизующие нитрилы до амидов.
Эти ферменты используются в коммерческих целях для производства акриламида .
«Безводная гидратация» нитрилов в амиды была продемонстрирована с использованием оксима в качестве источника воды: [30]
Снижение
[ редактировать ]Нитрилы подвержены гидрированию на различных металлических катализаторах. В результате реакции может быть получен либо первичный амин ( RCH 2 NH 2 ) или третичный амин ( (RCH 2 ) 3 N ), в зависимости от условий. [31] При обычном органическом восстановлении нитрил восстанавливают обработкой литийалюминийгидридом до амина. Восстановление до имина с последующим гидролизом до альдегида происходит при синтезе альдегида Стивена , в котором используется хлорид олова в кислоте.
Депротонирование
[ редактировать ]Алкилнитрилы достаточно кислые, чтобы подвергаться депротонированию связи CH, прилегающей к группе CN. [32] [33] Требуются сильные основания, такие как диизопропиламид лития и бутиллитий . Продукт называется нитрил-анионом . Эти карбанионы алкилируют широкий спектр электрофилов. Ключом к исключительной нуклеофильности является небольшая стерическая потребность блока CN в сочетании с его индуктивной стабилизацией. Эти свойства делают нитрилы идеальными для создания новых углерод-углеродных связей в стерически сложных средах.
Нуклеофилы
[ редактировать ]Углеродный центр нитрила электрофильен , поэтому он восприимчив к нуклеофильного присоединения реакциям :
- с цинкорганическим соединением в реакции Блеза
- со спиртами в реакции Пиннера .
- с аминами, например, реакция амина саркозина с цианамидом дает креатин [34]
- Нитрилы реагируют на ацилирование Фриделя-Крафтса в реакции Губена-Хеша с кетонами.
Различные методы и соединения
[ редактировать ]- При восстановительном децианировании нитрильная группа заменяется протоном. [35] Децианирование может быть осуществлено путем растворения восстановления металлов (например, HMPA и металлического калия в трет -бутаноле ) или путем плавления нитрила в КОН . [36] Точно так же α-аминонитрилы можно децианировать другими восстановителями, такими как литийалюминийгидрид . [35]
- В так называемой реакции Франшимона (разработанной бельгийским докторантом Антуаном Полем Николя Франшимоном (1844-1919) в 1872 году) α-цианокарбоновая кислота, нагретая в кислоте, гидролизуется и декарбоксилируется до димера. [37]
- Нитрилы самореагируют в присутствии основания по реакции Торпа при нуклеофильном присоединении.
- В металлоорганической химии известно, что нитрилы присоединяются к алкинам при карбоцианировании: [38]
Комплексообразование
[ редактировать ]Нитрилы являются предшественниками нитрильных комплексов переходных металлов , которые являются реагентами и катализаторами. Примеры включают гексафторфосфат тетракис(ацетонитрил)меди(I) ( [Cu(MeCN) 4 ] + ) и дихлорид бис(бензонитрил)палладия ( PdCl 2 (PhCN) 2 ). [39]

Производные нитрила
[ редактировать ]Органические цианамиды
[ редактировать ]Цианамиды представляют собой N -цианосоединения общего строения. Р 1 Р 2 N−C≡N и связан с исходным цианамидом . [40]
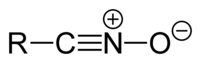
Оксиды нитрила
[ редактировать ]Оксиды нитрила имеют химическую формулу РКНО . Их общая структура R−C≡N + −О − . R означает любую группу (обычно органильную , например, оксид ацетонитрила). СН 3 −C≡N + −О − , водород в случае фульминовой кислоты H−C≡N + −О − , или галоген , например, гремучий хлор Cl−C≡N + −О − ). Они и используются в 1,3-диполярном циклоприсоединениях . [41] : 1187–1192 Они подвергаются диотропной перегруппировке 1 типа с образованием изоцианатов . [41] : 1700 Оксиды нитрила могут быть синтезированы дегидрированием оксимов или дегидратацией нитроалканов . [42] : 934–936 Их можно использовать для синтеза изоксазолов . [42] : 1201–1202
Возникновение и применение
[ редактировать ]Нитрилы встречаются в природе в разнообразных растительных и животных источниках. Из наземных и морских источников было выделено более 120 встречающихся в природе нитрилов. Нитрилы обычно встречаются в косточках фруктов, особенно миндаля, а также во время приготовления капустных культур (таких как капуста, брюссельская и цветная капуста), которые выделяют нитрилы в результате гидролиза. Манделонитрил , циангидрин, получаемый при употреблении в пищу миндаля или некоторых фруктовых косточек, выделяет цианистый водород и отвечает за токсичность цианогенных гликозидов. [43]
В настоящее время на рынке представлено более 30 нитрилсодержащих фармацевтических препаратов для различных медицинских показаний, и более 20 дополнительных нитрилсодержащих препаратов находятся в стадии клинической разработки. Виды фармацевтических препаратов, содержащих нитрилы, разнообразны: от вилдаглиптина , противодиабетического препарата, до анастрозола , который является золотым стандартом лечения рака молочной железы. Во многих случаях нитрил имитирует функциональность субстратов ферментов, тогда как в других случаях нитрил увеличивает растворимость в воде или снижает восприимчивость к окислительному метаболизму в печени. [44] Нитрильная функциональная группа встречается в нескольких лекарствах.
- Структура циталопрама , антидепрессанта класса селективных ингибиторов обратного захвата серотонина (СИОЗС).
- Структура циамемазина , антипсихотического препарата.
- Структура фадрозола , ингибитора ароматазы для лечения рака молочной железы.
- Структура летрозола , перорального нестероидного ингибитора ароматазы для лечения некоторых видов рака молочной железы.
См. также
[ редактировать ]- Протонированные нитрилы: Нитрилий
- Депротонированные нитрилы: нитрил-анион
- Цианоуглерод
- Нитрил-илид
Ссылки
[ редактировать ]- ^ Золотой книги ИЮПАК Нитрилы
- ^ NCBI-MeSH Нитрилы
- ^ Каракида, Кен-ичи; Фукуяма, Цутому; Кучицу, Кодзо (1974). «Молекулярная структура цианида водорода и ацетонитрила, изученная методом газовой электронографии» . Бюллетень Химического общества Японии . 47 (2): 299–304. дои : 10.1246/bcsj.47.299 .
- ^ См.:
- Карл В. Шееле (1782) «Эксперимент с цветным веществом берлинского синего», Труды Шведской королевской академии наук, 3: 264–275 (на шведском языке).
- Перепечатано на латыни как: «De materia tingente caerulei berolinensis» в: Карл Вильгельм Шееле с Эрнстом Бенджамином Готлибом Хебенштрайтом (редактор) и Готфридом Генрихом Шефером (перевод), Opuscula Chemica et Physica (Лейпциг («Leipsiae»), (Германия) : Иоганн Годфрид Мюллер, 1789), том. 2, страницы 148–174.
- ^ Перейти обратно: а б Дэвид Т. Моури (1948). «Получение нитрилов». Химические обзоры . 42 (2): 189–283. дои : 10.1021/cr60132a001 . ПМИД 18914000 .
- ^ Гей-Люссак произвел чистый сжиженный цианистый водород в: Гей-Люссак, Ж (1811). « Заметка о синильной кислоте» . Анналы химии . 44 : 128–133.
- ^ Ж. Пелуз (1834). «Заметка о новом цианоэфире». Анналы аптеки . 10 (3): 249. doi : 10.1002/jlac.18340100302 .
- ^ Герман Фелинг (1844 г.). «О разложении бензоата аммония при нагревании» . Анналы химии и фармации . 49 (1): 91–97. дои : 10.1002/jlac.18440490106 . На странице 96 Фелинг пишет: «Поскольку Лоран уже назвал открытое им тело нитробензоилом, а азобензоил уже существует, возможно, можно было бы назвать тело, образованное из бензойного аммиака, бензонитрилом». (Поскольку Лоран назвал открытое им вещество «нитробензоилом» – а «азобензоил» уже существует – то вещество, происходящее из бензоата аммония, можно было бы назвать, пожалуй, «бензонитрилом».)
- ^ Поллак, Питер; Ромедер, Жерар; Хагедорн, Фердинанд; Гельбке, Хайнц-Петер (2000). «Нитрилы». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a17_363 . ISBN 3527306730 .
- ^ Грегори, Роберт Дж. Х. (1999). «Цианогидрины в природе и лаборатории: биология, препараты и синтетические применения». Химические обзоры . 99 (12): 3649–3682. дои : 10.1021/cr9902906 . ПМИД 11849033 .
- ^ «ИЗОБУТИРОНИТРИЛ». Органические синтезы . 25 : 61. 1945. doi : 10.15227/orgsyn.025.0061 .
- ^ «2-ЭТИЛГЕКСАНОНИТРИЛ». Органические синтезы . 32 : 65. 1952. doi : 10.15227/orgsyn.032.0065 .
- ^ Шюмперли, Мартин Т.; Хаммонд, Кери; Херманс, Айв (2021). «Развития аэробного окисления аминов». АСУ Катал . 2 (6): 1108–1117. дои : 10.1021/cs300212q .
- ^ Сюй, Чжинин; Ковач, Эрвин (2024). «За пределами традиционного синтеза: электрохимические подходы к окислению аминов нитрилов и иминов» . ACS Org Inorg Au . doi : 10.1021/acsorginorgau.4c00025 .
- ^ Чилл, Сэмюэл Т.; Мебане, Роберт К. (18 сентября 2009 г.). «Простое преобразование альдегидов в нитрилы в одной емкости». Синтетические коммуникации . 39 (20): 3601–3606. дои : 10.1080/00397910902788174 . S2CID 97591561 .
- ^ К. Физе; Дж. Стрейт (1974). «Гидроксиламин -О -сульфоновая кислота: удобный реагент для окислительного превращения альдегидов в нитрилы». Тетраэдр Летт. (на немецком языке). 15 (36): 3187–3188. дои : 10.1016/S0040-4039(01)91857-X .
- ^ « о -толунитрил и п -толунитрил» HT Clarke и RR Read Org. Синтез. 1941, Сб. Том. 1, 514.
- ^ В. Нагата и М. Ёсиока (1988). «Цианид диэтилалюминия» . Органические синтезы ; Сборник томов , т. 6, с. 436 .
- ^ В. Нагата, М. Ёсиока и М. Мураками (1988). «Получение цианосоединений с использованием алкилалюминиевых промежуточных продуктов: 1-циано-6-метокси-3,4-дигидронафталина» . Органические синтезы
{{cite journal}}: CS1 maint: multiple names: authors list (link); Сборник томов , т. 6, с. 307 . - ^ Рейнольд К. Фьюсон; Оскар Р. Краймайер и Гилберт Л. Ниммо (1930). «Замыкание колец в циклобутановом ряду. II. Циклизация α,α'-дибромадипиновых эфиров». Дж. Ам. хим. Соц. 52 (10): 4074–4076. дои : 10.1021/ja01373a046 .
- ^ Дж. Хубен, Вальтер Фишер (1930) «О новом методе получения циклических нитрилов каталитическим разложением (I. Сообщение)», Отчеты Немецкого химического общества (серии A и B) 63 (9): 2464 - 2472. два : 10.1002/cber.19300630920
- ^ Ямадзаки, Сигеказу; Ямадзаки, Ясуюки (1990). «Никель-катализируемое дегидрирование аминов до нитрилов» . Бюллетень Химического общества Японии . 63 (1): 301–303. дои : 10.1246/bcsj.63.301 .
- ^ Чен, Фен-Эр; Куанг, Юн-Янь; Хуэй-Фан, Дай; Лу, Лян (2003). «Селективное и мягкое окисление первичных аминов до нитрилов трихлоризоциануровой кислотой». Синтез . 17 (17): 2629–2631. дои : 10.1055/s-2003-42431 .
- ^ Шефер, HJ; Фельдхьюс, У. (1982). «Окисление первичных алифатических аминов до нитрилов на гидроксидно-никелевом электроде». Синтез . 1982 (2): 145–146. дои : 10.1055/s-1982-29721 . S2CID 97172564 .
- ^ Хигель, Джин; Льюис, Джастин; Бэ, Джейсон (2004). «Превращение α-аминокислот в нитрилы путем окислительного декарбоксилирования трихлоризоциануровой кислотой». Синтетические коммуникации . 34 (19): 3449–3453. дои : 10.1081/SCC-200030958 . S2CID 52208189 .
- ^ Хэмпсон, Н.; Ли, Дж; Макдональд, К. (1972). «Окисление аминосоединений анодным серебром». Электрохимика Акта . 17 (5): 921–955. дои : 10.1016/0013-4686(72)90014-X .
- ^ Дакин, Генри Дрисдейл (1916). «Окисление аминокислот до цианидов» . Биохимический журнал . 10 (2): 319–323. дои : 10.1042/bj0100319 . ПМЦ 1258710 . ПМИД 16742643 .
- ^ Кукушкин В. Ю.; Помбейро, AJL (2005). «Металло-опосредованный и металл-катализируемый гидролиз нитрилов». Неорг. Хим. Акта . 358 : 1–21. дои : 10.1016/j.ica.2004.04.029 .
- ^ Аббас, Хамис А. (1 января 2008 г.). «Влияние заместителей на гидролиз п-замещенных бензонитрилов в растворах серной кислоты при (25,0 ± 0,1) ° C» . Журнал естественных исследований А. 63 (9): 603–608. Бибкод : 2008ЗНатА..63..603А . дои : 10.1515/zna-2008-0912 . ISSN 1865-7109 .
- ^ Дахе Кан; Джин Ву Ли; Хи-Юн Ли (2012). «Безводная гидратация нитрилов в амиды: п -карбометоксибензамид» . Органические синтезы . 89:66 . дои : 10.15227/orgsyn.089.0066 .
- ^ Барро, Дж.; Пуйу, Ю. (1997). «Реакции каталитического аминирования: синтез жирных аминов. Контроль селективности в присутствии многофункциональных катализаторов». Катализ сегодня . 1997 (2): 137–153. дои : 10.1016/S0920-5861(97)00006-0 .
- ^ Арсениядис, Симеон; Кайлер, Кейт С.; Ватт, Дэвид С. (1984). «Реакции присоединения и замещения нитрил-стабилизированных карбанионов». Органические реакции . стр. 1–364. дои : 10.1002/0471264180.или031.01 . ISBN 978-0-471-26418-7 .
- ^ Ян, Сюнь; Флеминг, Фрейзер Ф. (2017). «C- и N-металлированные нитрилы: взаимосвязь между структурой и селективностью». Отчеты о химических исследованиях . 50 (10): 2556–2568. дои : 10.1021/acs.accounts.7b00329 . ПМИД 28930437 .
- ^ Смит, Андри Л.; Тан, Паула (2006). «Синтез креатина: лабораторный эксперимент по органической химии для студентов». Дж. Хим. Образование. 83 (11): 1654. Бибкод : 2006ЖЧЭд..83.1654С . дои : 10.1021/ed083p1654 .
- ^ Перейти обратно: а б Реакция восстановительного децианирования: химические методы и синтетические применения Жан-Марк Матталия, Кэролайн Марчи-Делапьер, Хасан Хазиме и Мишель Шанон Аркивок (AL-1755FR), стр. 90–118, 2006 г., статья [ постоянная мертвая ссылка ]
- ^ Беркофф, Чарльз Э.; Ривард, Дональд Э.; Киркпатрик, Дэвид; Айвз, Джеффри Л. (1980). «Восстановительное децианирование нитрилов щелочным плавлением». Синтетические коммуникации . 10 (12): 939–945. дои : 10.1080/00397918008061855 .
- ^ Франшимон, Антуан Поль Николас (1872). «О дибензилдикарбоновой кислоте» [О 2,3-дифенилянтарной кислоте]. Отчеты Немецкого химического общества . 5 (2): 1048–1050. дои : 10.1002/cber.187200502138 .
- ^ Ёсиаки Накао; Акира Яда; Широ Эбата и Тамеджиро Хияма (2007). «Драматическое влияние катализаторов на основе кислот Льюиса на никель-катализируемое карбоцианирование алкинов». Дж. Ам. хим. Соц. (Коммуникация). 129 (9): 2428–2429. дои : 10.1021/ja067364x . ПМИД 17295484 .
- ^ Рэйч, Сан-Франциско; Кюн, Ф.Е. (2009). «Нитриллигированные комплексы переходных металлов со слабокоординирующими противоанионами и их каталитические применения». Химические обзоры . 109 (5): 2061–2080. дои : 10.1021/cr800270h . ПМИД 19326858 .
- ^ Марч, Джерри (1992), Продвинутая органическая химия: реакции, механизмы и структура (4-е изд.), Нью-Йорк: Wiley, с. 436–7, ISBN 0-471-60180-2
- ^ Перейти обратно: а б Смит, Майкл Б.; Марч, Джерри (2007). Продвинутая органическая химия марта (6-е изд.). Джон Уайли и сыновья. ISBN 978-0-471-72091-1 .
- ^ Перейти обратно: а б Клейден, Джонатан ; Гривз, Ник; Уоррен, Стюарт ; Уотерс, Питер (2001). Органическая химия (1-е изд.). Издательство Оксфордского университета. ISBN 978-0-19-850346-0 .
- ^ Отчеты о натуральных продуктах, выпуск 5, 1999 г. Нитрилсодержащие натуральные продукты.
- ^ Флеминг, Фрейзер Ф.; Яо, Лихуа; Равикумар, ПК; Фанк, Ли; Шук, Брайан С. (ноябрь 2010 г.). «Нитрилсодержащие фармацевтические препараты: эффективная роль нитрилового фармакофора» . J Med Chem . 53 (22): 7902–17. дои : 10.1021/jm100762r . ПМЦ 2988972 . ПМИД 20804202 .
Внешние ссылки
[ редактировать ]- ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Нитрил ». два : 10.1351/goldbook.N04151
- ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « Цианид ». два : 10.1351/goldbook.C01486