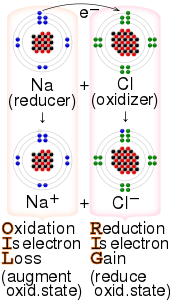
Восстановитель
В химии восстановитель химическое (также известный как восстановитель , восстановитель или донор электронов ) — это вещество , которое «жертвует» электрон получателю электрона (называемому окислителем , окислителем , окислителем или акцептором электронов ).
Примеры веществ, которые являются обычными восстановителями, включают водород , щелочные металлы , муравьиную кислоту , [1] щавелевая кислота , [2] и сульфитные соединения.
В предреакционном состоянии восстановители имеют дополнительные электроны (то есть они сами восстанавливаются), а окислители лишены электронов (то есть они сами окисляются). Обычно это выражается в терминах их степеней окисления. агента Степень окисления описывает степень потери электронов: чем выше степень окисления, тем меньше у него электронов. Таким образом, первоначально, перед реакцией, восстановитель обычно находится в одной из более низких возможных степеней окисления; его степень окисления увеличивается в ходе реакции, а степень окисления окислителя уменьшается.Таким образом, в окислительно-восстановительной реакции агент, степень окисления которого увеличивается, который «теряет/ отдает электроны», который «окисляется» и который «восстанавливает», называется восстановителем или восстанавливающим агентом , а агент, степень окисления которого уменьшается, «это» получает/ принимает /принимает электроны», который «восстанавливается» и который «окисляет», называется окислителем или окислителем .
Например, рассмотрим общую реакцию аэробного клеточного дыхания :
- C 6 H 12 O 6 (т) + 6O 2 (г) → 6CO 2 (г) + 6H 2 O(ж)
Кислород ( O 2 ) восстанавливается, поэтому является окислителем. Глюкоза ( C 6 H 12 O 6 ) окисляется, поэтому является восстановителем.
Характеристики [ править ]
Рассмотрим следующую реакцию:
Восстановителем в этой реакции является ферроцианид ( [Fe(CN) 6 ] 4− ). Он отдает электрон, окисляясь до феррицианида ( [Fe(CN) 6 ] 3− ). Одновременно этот электрон принимает окислитель хлор ( Cl
2 ), который восстанавливается до хлорида ( Cl −
).
Сильные восстановители легко теряют (или отдают) электроны. Атом с относительно большим атомным радиусом, как правило, является лучшим восстановителем. У таких видов расстояние от ядра до валентных электронов настолько велико, что эти электроны не сильно притягиваются. Эти элементы, как правило, являются сильными восстановителями. Хорошие восстановители, как правило, состоят из атомов с низкой электроотрицательностью , то есть способностью атома или молекулы притягивать связывающие электроны, а соединения с относительно небольшой энергией ионизации также служат хорошими восстановителями. [ нужна ссылка ]
Мера способности материала к восстановлению известна как его восстановительный потенциал . [3] В таблице ниже показано несколько потенциалов восстановления, которые можно изменить на потенциалы окисления, изменив знак. Восстановители можно ранжировать по возрастанию силы путем ранжирования их потенциала восстановления. Восстановители отдают электроны (то есть «восстанавливают») окислителям , которые, как говорят, «восстанавливаются» восстановителем. Восстановитель сильнее, когда он имеет более отрицательный потенциал восстановления, и слабее, когда он имеет более положительный потенциал восстановления. Чем более положителен потенциал восстановления, тем больше сродство вида к электронам и склонность к восстановлению (то есть к получению электронов). В следующей таблице представлены потенциалы восстановления указанного восстановителя при 25 °C. Например, среди натрия (Na), хрома (Cr), меди (Cu + ) и хлорид (Cl − ), именно Na является сильнейшим восстановителем, а Cl − является самым слабым; сказал по-другому, На + — самый слабый окислитель в этом списке, а Cl — самый сильный. [ нужна ссылка ]
| Окислитель | Восстановитель | Снижение Potential (V) | |
|---|---|---|---|
| Что + + и − | ⇌ | Что | −3.04 |
| Уже + + и − | Уже | −2.71 | |
| мг 2+ + 2 и − | мг | −2.38 | |
| Ал 3+ + 3 и − | Ал | −1.66 | |
| 2 Н 2 О (л) + 2 е − | Н 2 (г) + 2 ОН − | −0.83 | |
| Кр 3+ + 3 и − | Кр | −0.74 | |
| Фе 2+ + 2 и − | Фе | −0.44 | |
| 2 часа + + 2 и − | Ч 2 | 0.00 | |
| Сн 4+ + 2 и − | Сн 2+ | +0.15 | |
| С 2+ + и − | С + | +0.16 | |
| В + + и − | В | +0.80 | |
| Бр 2 +2 е − | 2 комн. − | +1.07 | |
| Cl 2 + 2 и − | 2 кл. − | +1.36 | |
| MnO − 4 + 8 Н + + 5 и − | Мин. 2+ + 4 Н 2 О | +1.49 | |
| Ф 2 + 2 е − | 2 Ж − | +2.87 |
К распространенным восстановителям относятся металлы калий, кальций, барий, натрий и магний, а также соединения, содержащие гидрид H. − ион, это NaH , LiH , [5] LiAlH 4 и CaH 2 .
Некоторые элементы и соединения могут быть как восстановителями, так и окислителями . Водород является восстановителем, когда он реагирует с неметаллами, и окислителем, когда он реагирует с металлами.
- 2 Li (т) + H2 (г) → 2 LiH (т) [а]
Водород (потенциал восстановления которого равен 0,0) действует как окислитель, поскольку он принимает донорство электронов от восстановителя лития (потенциал восстановления которого равен -3,04), что вызывает окисление Li и восстановление водорода.
- Н 2(г) + F 2(г) → 2 HF (г) [б]
Водород действует как восстановитель, поскольку отдает свои электроны фтору , что позволяет восстанавливать фтор.
Важность [ править ]
Восстановители и окислители ответственны за коррозию , которая представляет собой «разложение металлов в результате электрохимической активности». [3] коррозии необходимы анод и катод Для возникновения . Анод – это элемент, который теряет электроны (восстановитель), поэтому окисление всегда происходит в аноде, а катод – это элемент, который приобретает электроны (окислитель), поэтому восстановление всегда происходит в катоде. Коррозия возникает всякий раз, когда существует разница в окислительном потенциале. Когда он присутствует, металл анода начинает разрушаться при наличии электрического соединения и наличии электролита . [ нужна ссылка ]
Примеры окислительно-восстановительных реакций [ править ]
Исторически восстановление относилось к удалению кислорода из соединения, отсюда и название «восстановление». [7] Пример этого явления произошел во время Великого события окисления , в ходе которого биологически произведенный молекулярный кислород ( дикислород ( O 2 ), окислитель и получатель электронов) был добавлен в раннюю атмосферу Земли , которая изначально представляла собой слабовосстановительную атмосферу , содержащую восстановительные газы, такие как метан ( CH 4 ) и окись углерода ( CO ) (вместе с другими донорами электронов) [8] и практически нет кислорода, потому что любой из образующихся веществ вступает в реакцию с теми или иными восстановителями (особенно с железом, растворенным в морской воде ), что приводит к их удалению .Используя воду в качестве восстановителя, водные фотосинтезирующие цианобактерии произвели этот молекулярный кислород в качестве побочного продукта. [9] Этот O 2 первоначально окислял растворенное в океане двухвалентное железо (Fe(II) – что означает железо в его степени окисления +2) с образованием нерастворимых трехвалентного оксидов железа , таких как оксид железа (III) (Fe(II) потерял электрон из-за окислителя и стал Fe(III) — что означает железо в степени окисления +3), которое осаждалось на дно океана, образуя полосчатые железные образования , тем самым удаляя кислород (и железо). Скорость производства кислорода в конечном итоге превысила доступность восстановительных материалов, удаляющих кислород, что в конечном итоге привело к тому, что Земля получила сильно окислительную атмосферу, содержащую большое количество кислорода (подобную современной атмосфере ). [10] Современный смысл донорства электронов является обобщением этой идеи, признавая, что другие компоненты могут играть подобную химическую роль кислороду.
Образование оксида железа(III) ;
- 4Fe + 3O 2 → 4Fe 3+ + 6О 2− → 2Fe 2 O 3
В приведенном выше уравнении железо (Fe) имеет степень окисления 0 до и 3+ после реакции. Для кислорода (O) степень окисления начиналась с 0 и уменьшалась до 2-. Эти изменения можно рассматривать как две « полуреакции », происходящие одновременно:
- Полуреакция окисления: Fe 0 → Фе 3+ + 3е −
- Полуреакция восстановления: O 2 + 4e − → 2О 2−
Железо (Fe) окислилось, поскольку степень окисления увеличилась. Железо является восстановителем, поскольку оно отдает электроны кислороду (O 2 ).Кислород (O 2 ) восстановился, поскольку степень окисления снизилась, и является окислителем, поскольку отнял электроны у железа (Fe).
Распространенные восстановители [ править ]
Этот раздел нуждается в дополнительных цитатах для проверки . ( Октябрь 2016 г. ) |
- Литий-алюминийгидрид ( Li Al H 4 ), очень сильный восстановитель.
- Red-Al (NaAlH 2 (OCH 2 CH 2 OCH 3 ) 2 ), более безопасная и стабильная альтернатива алюмогидриду лития.
- Водород без или с подходящим катализатором ; например, катализатор Линдлара
- Амальгама натрия ( Na ( Hg ))
- Натриево-свинцовый сплав ( Na + Pb )
- Амальгама цинка ( Zn ( Hg )) (реагент для восстановления Клемменсена )
- Диборан
- Боргидрид натрия ( Na B H 4 )
- Соединения железа , содержащие Fe 2+ ион, такой как сульфат железа (II)
- Соединения олова, содержащие Sn 2+ ион, такой как хлорид олова (II)
- Диоксид серы (иногда также используется в качестве окислителя ), Сульфитные соединения
- Дитионаты , например Na 2 S 2 O 6
- Тиосульфаты , например Na 2 S 2 O 3 (в основном в аналитической химии) [11]
- Йодиды , такие как йодид калия ( K I ) (в основном в аналитической химии )
- Перекись водорода ( H
22О
2 ) – в основном окислитель, но иногда может действовать как восстановитель (обычно в аналитической химии. {{требуется ссылка}} - Гидразин ( восстановление Вольфа-Кишнера )
- Гидрид диизобутилалюминия (ДИБАЛ-H)
- Щавелевая кислота ( C
22Ч
22О
4 ) - Муравьиная кислота (HCOOH)
- Аскорбиновая кислота (C 6 H 8 O 6 )
- Восстанавливающие сахара , например эритроза , см. Альдоза.
- Фосфиты , гипофосфиты и фосфористая кислота
- Дитиотреитол (DTT) - используется в биохимических лабораториях, чтобы избежать SS-связей.
- Окись углерода (СО)
- Цианиды в гидрохимических металлургических процессах
- Углерод (С)
- Трис-2-карбоксиэтилфосфин гидрохлорид (TCEP)
См. также [ править ]
- Коррозия - постепенное разрушение материалов в результате химической реакции с окружающей средой.
- Электрохимия - Раздел химии.
- Электролит – ионные твердые вещества, диссоциация которых в воде высвобождает ионы, передающие электрический ток в растворе.
- Акцептор электронов - химическое вещество, способное принимать электроны.
- Донор электронов - химическое вещество, способное отдавать электроны другому объекту.
- Электросинтез - Синтез химических соединений в электрохимической ячейке.
- Органическое восстановление – окислительно-восстановительная реакция, происходящая с органическими соединениями.
- Окислитель - химическое соединение, используемое для окисления другого вещества в химической реакции.
- Redox - химическая реакция, в которой изменяются степени окисления атомов.
- Восстановительный эквивалент – химическая реакция, в которой изменяются степени окисления атомов.
- Бессолевая редукция
Примечания [ править ]
- ^ Половинные реакции : 2 Ли 0 (с) → 2 Ли + (с) + 2 и − ::::: Ч 2 0 (г) + 2 е − → 2 ч. − (г)
- ^ Полуреакции : H 2 0 (г) → 2 Н + (г) + 2 е − :::::F :::::Ф2 0 (г) + 2 е − → 2 Ф − (г)
Ссылки [ править ]
- ^ Гаррон, Энтони; Эпрон, Флоренция (2005). «Использование муравьиной кислоты в качестве восстановителя для каталитического восстановления нитратов в воде». Исследования воды . 39 (13): 3073–3081. Бибкод : 2005WatRe..39.3073G . дои : 10.1016/j.watres.2005.05.012 . ПМИД 15982701 .
- ^ «Окислители и восстановители» . Университет Пердью.
- ↑ Перейти обратно: Перейти обратно: а б «Значения потенциала восстановления и окисления электродов» . www.EESemi.com . Проверено 12 июля 2021 г.
- ^ «Стандартные электродные потенциалы» . гиперфизика.phy-astr.gsu.edu . Проверено 29 марта 2018 г.
- ^ Офрей М., Менуэль С., Форт Ю., Эшбах Дж., Руксель Д., Винсент Б. (2009). «Новый синтез наноразмерных оксидов ниобия и частиц ниобата лития и их характеристика с помощью РФЭС-анализа» (PDF) . Журнал нанонауки и нанотехнологий . 9 (8): 4780–4789. дои : 10.1166/jnn.2009.1087 . ПМИД 19928149 . Архивировано из оригинала (PDF) 29 июля 2020 г. Проверено 24 сентября 2019 г.
- ^ «Металлы» . Размер укуса . Би-би-си. Архивировано из оригинала 03.11.2022.
- ^ Олсон, Мейнард В. «Окислительно-восстановительная реакция» . Британника . Проверено 3 мая 2022 г.
В своем Traité élémentaire de chimie он четко установил, что горение состоит из химического соединения кислорода из атмосферы и горючего вещества [...]. К концу века его идеи получили широкое признание и были успешно применены к более сложным процессам дыхания и фотосинтеза. Реакции, в которых кислород потреблялся, были классифицированы как окисления, а те, в которых кислород был потерян, — как восстановления.
- ^ Кастинг, Дж. Ф. (2014). «Моделирование архейской атмосферы и климата». Трактат по геохимии . Эльзевир. стр. 157–175. дои : 10.1016/b978-0-08-095975-7.01306-1 . ISBN 9780080983004 .
- ^ Бьюик, Роджер (27 августа 2008 г.). «Когда появился кислородный фотосинтез?» . Философские труды Королевского общества Б. 363 (1504): 2731–2743. дои : 10.1098/rstb.2008.0041 . ISSN 0962-8436 . ПМК 2606769 . ПМИД 18468984 .
- ^ Соса Торрес, Марта Э.; Сауседо-Васкес, Хуан П.; Кронек, Питер М.Х. (2015). «Глава 1, Раздел 2: Увеличение содержания дикислорода в атмосфере». В Кронеке, Питер М.Х.; Соса Торрес, Марта Э. (ред.). Поддержание жизни на планете Земля: металлоферменты, усваивающие дикислород и другие жевательные газы . Ионы металлов в науках о жизни, том 15. Том. 15. Спрингер. стр. 1–12. дои : 10.1007/978-3-319-12415-5_1 . ISBN 978-3-319-12414-8 . ПМИД 25707464 .
- ^ «Катодная инверсионная вольтамперометрическая методика определения некоторых неорганических форм мышьяка в пробах воды, почвы и руд» .
Дальнейшее чтение [ править ]
- «Химические принципы: поиски понимания», третье издание. Питер Аткинс и Лоретта Джонс с. F76
Внешние ссылки [ править ]
- Таблица с указанием силы восстановителей на Wayback Machine (архивировано 11 июня 2011 г.)