Полагать
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Полагать | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Аллотропы | серебристо-белый, β (бета) ; серый, α (альфа) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес А р °(Sn) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Олово в таблице Менделеева | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 50 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 14 (carbon group) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | p-block | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Kr] 4d10 5s2 5p2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 18, 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 505.08 K (231.93 °C, 449.47 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 2875 K (2602 °C, 4716 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (at 20° C) | white (β): 7.289 g/cm3 gray (α): 5.770 g/cm3[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 6.99 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | white (β): 7.03 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | white (β): 296.1 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | white (β): 27.112 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −4, −3, −2, −1, 0,[4] +1,[5] +2, +3,[6] +4 (an amphoteric oxide) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.96 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 140 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 139±4 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 217 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | white (β): body-centered tetragonal (tI4) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lattice constants | white (β): a = 583.13 pm c = 318.11 pm (at 20 °C)[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | gray (α): face-centered diamond-cubic (cF8) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lattice constant | gray (α): a = 648.96 pm (at 20 °C)[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | white (β): 21.76×10−6/K (at 20 °C)[a] gray (α): 5.20×10−6/K (at 20 °C)[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 66.8 W/(m⋅K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 115 nΩ⋅m (at 0 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | white (β): paramagnetic gray (α): diamagnetic[7] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | white (β): +3.1×10−6 cm3/mol (298 K)[8] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young's modulus | 50 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 18 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 58 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 2730 m/s (at r.t.) (rolled) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.36 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 1.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 50–440 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-31-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | protohistoric, around 35th century BC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Symbol | "Sn": from Latin stannum | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes of tin | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Олово — химический элемент ; у него есть символ Sn (от латинского stannum ) и атомный номер 50. Металл серебристого цвета, олово достаточно мягкое, чтобы его можно было резать с небольшим усилием. [ 10 ] а брусок жести можно согнуть вручную без особых усилий. При сгибании можно услышать так называемый « оловянный крик » в результате двойникования кристаллов олова. [ 11 ]
Олово — постпереходный металл периодической 14-й группы таблицы элементов . Его получают главным образом из минерала касситерита , содержащего оксид олова SnO .
2 . Олово демонстрирует химическое сходство с обоими своими соседями в группе 14, германием и свинцом , и имеет две основные степени окисления : +2 и немного более стабильную +4. Олово является 49-м по распространенности элементом на Земле и имеет, наряду с 10 стабильными изотопами, наибольшее количество стабильных изотопов в таблице Менделеева из-за магического числа протонов.
It has two main allotropes: at room temperature, the stable allotrope is β-tin, a silvery-white, malleable metal; at low temperatures it is less dense grey α-tin, which has the diamond cubic structure. Metallic tin does not easily oxidize in air and water.
The first tin alloy used on a large scale was bronze, made of 1⁄8 tin and 7⁄8 copper (12.5% and 87.5% respectively), from as early as 3000 BC. After 600 BC, pure metallic tin was produced. Pewter, which is an alloy of 85–90% tin with the remainder commonly consisting of copper, antimony, bismuth, and sometimes lead and silver, has been used for flatware since the Bronze Age. In modern times, tin is used in many alloys, most notably tin-lead soft solders, which are typically 60% or more tin, and in the manufacture of transparent, electrically conducting films of indium tin oxide in optoelectronic applications. Another large application is corrosion-resistant tin plating of steel. Because of the low toxicity of inorganic tin, tin-plated steel is widely used for food packaging as "tin cans". Some organotin compounds can be extremely toxic.
Characteristics
[edit]Physical
[edit]
Tin is a soft, malleable, ductile and highly crystalline silvery-white metal. When a bar of tin is bent a crackling sound known as the "tin cry" can be heard from the twinning of the crystals.[11] This trait is shared by indium, cadmium, zinc, and mercury in its solid state. Tin melts at about 232 °C (450 °F), the lowest in group 14. The melting point is further lowered to 177.3 °C (351.1 °F) for 11 nm particles.[12][13]
| External videos | |
|---|---|
β-tin, also called white tin, is the allotrope (structural form) of elemental tin that is stable at and above room temperature. It is metallic and malleable, and has body-centered tetragonal crystal structure. α-tin, or gray tin, is the nonmetallic form. It is stable below 13.2 °C (55.8 °F) and is brittle. α-tin has a diamond cubic crystal structure, as do diamond and silicon. α-tin does not have metallic properties because its atoms form a covalent structure in which electrons cannot move freely. α-tin is a dull-gray powdery material with no common uses other than specialized semiconductor applications.[11] γ-tin and σ-tin exist at temperatures above 161 °C (322 °F) and pressures above several GPa.[14]
In cold conditions β-tin tends to transform spontaneously into α-tin, a phenomenon known as "tin pest" or "tin disease".[15] Some unverifiable sources also say that, during Napoleon's Russian campaign of 1812, the temperatures became so cold that the tin buttons on the soldiers' uniforms disintegrated over time, contributing to the defeat of the Grande Armée,[16] a persistent legend.[17][18][19]
The α-β transformation temperature is 13.2 °C (55.8 °F), but impurities (e.g. Al, Zn, etc.) lower it well below 0 °C (32 °F). With the addition of antimony or bismuth the transformation might not occur at all, increasing durability.[20]
Commercial grades of tin (99.8% tin content) resist transformation because of the inhibiting effect of small amounts of bismuth, antimony, lead, and silver present as impurities. Alloying elements such as copper, antimony, bismuth, cadmium, and silver increase the hardness of tin.[21] Tin easily forms hard, brittle intermetallic phases that are typically undesirable. It does not mix into a solution with most metals and elements so tin does not have much solid solubility. Tin mixes well with bismuth, gallium, lead, thallium and zinc, forming simple eutectic systems.[20]
Tin becomes a superconductor below 3.72 K[22] and was one of the first superconductors to be studied.[23] The Meissner effect, one of the characteristic features of superconductors, was first discovered in superconducting tin crystals.[23]
Chemical
[edit]Tin resists corrosion from water, but can be corroded by acids and alkalis. Tin can be highly polished and is used as a protective coat for other metals,[11] a protective oxide (passivation) layer prevents further oxidation.[24] Tin acts as a catalyst triggering a chemical reaction of a solution containing oxygen and helps to increase the speed of the chemical reaction that results.[25]
Isotopes
[edit]Tin has ten stable isotopes, the greatest number of any element. Their mass numbers are 112, 114, 115, 116, 117, 118, 119, 120, 122, and 124. Tin-120 makes up almost a third of all tin. Tin-118 and tin-116 are also common. Tin-115 is the least common stable isotope. The isotopes with even mass numbers have no nuclear spin, while those with odd mass numbers have a nuclear spin of 1/2. It is thought that tin has such a great multitude of stable isotopes because of tin's atomic number being 50, which is a "magic number" in nuclear physics.
Tin is one of the easiest elements to detect and analyze by NMR spectroscopy, which relies on molecular weight and its chemical shifts are referenced against tetramethyltin (SnMe
4).[b][26]
Of the stable isotopes, tin-115 has a high neutron capture cross section for fast neutron energies, at 30 barns. Tin-117 has a cross section of 2.3 barns, one order of magnitude smaller, while tin-119 has a slightly smaller cross section of 2.2 barns.[27] Before these cross sections were well known, it was proposed to use tin-lead solder as a reactor coolant for fast reactors because of its low melting point. Current studies are for lead or lead-bismuth reactor coolants because both heavy metals are nearly transparent to fast neutrons, with very low capture cross sections.[28] In order to use a tin or tin-lead coolant, the tin would first have to go through isotopic separation to remove the isotopes with odd mass number. Combined, these three isotopes make up about 17% of natural tin but represent nearly all of the capture cross section. Of the remaining seven isotopes tin-112 has a capture cross section of 1 barn. The other six isotopes forming 82.7% of natural tin have capture cross sections of 0.3 barns or less, making them effectively transparent to neutrons.
Tin has 31 unstable isotopes, ranging in mass number from 99 to 139. The unstable tin isotopes have half-lives of less than a year except for tin-126, which has a half-life of about 230,000 years. Tin-100 and tin-132 are two of the very few nuclides with a "doubly magic" nucleus which despite being unstable, as they have very uneven neutron–proton ratios, are the endpoints beyond which tin isotopes lighter than tin-100 and heavier than tin-132 are much less stable.[29] Another 30 metastable isomers have been identified for tin isotopes between 111 and 131, the most stable being tin-121m, with a half-life of 43.9 years.[30]
The relative differences in the abundances of tin's stable isotopes can be explained by how they are formed during stellar nucleosynthesis. Tin-116 through tin-120, along with tin-122, are formed in the s-process (slow neutron capture) in most stars which leads to them being the most common tin isotopes, while tin-124 is only formed in the r-process (rapid neutron capture) in supernovae and neutron star mergers. Tin isotopes 115, 117 through 120, and 122 are produced via both the s-process and the r-process,[31] The two lightest stable isotopes, tin-112 and tin-114, cannot be made in significant amounts in the s- or r-processes and are among the p-nuclei whose origins are not well understood. Some theories about their formation include proton capture and photodisintegration. Tin-115 might be partially produced in the s-process, both directly and as the daughter of long-lived indium-115, and also from the decay of indium-115 produced via the r-process.[31][32]
Etymology
[edit]The word tin is shared among Germanic languages and can be traced back to reconstructed Proto-Germanic *tin-om; cognates include German Zinn, Swedish tenn and Dutch tin. It is not found in other branches of Indo-European, except by borrowing from Germanic (e.g., Irish tinne from English).[33][34]
The Latin name for tin, stannum, originally meant an alloy of silver and lead, and came to mean 'tin' in the fourth century[35]—the earlier Latin word for it was plumbum candidum, or "white lead". Stannum apparently came from an earlier stāgnum (meaning the same substance),[33] the origin of the Romance and Celtic terms for tin, such as French étain, Spanish estaño, Italian stagno, and Irish stán.[33][36] The origin of stannum/stāgnum is unknown; it may be pre-Indo-European.[37]
The Meyers Konversations-Lexikon suggests instead that stannum came from Cornish stean, and is evidence that Cornwall in the first centuries AD was the main source of tin.[citation needed]
History
[edit]
Добычу и использование олова можно отнести к началу бронзового века около 3000 г. до н.э., когда было замечено, что медные предметы, образованные из полиметаллических руд с разным содержанием металлов, имели разные физические свойства. [38] The earliest bronze objects had a tin or arsenic content of less than 2% and are believed to be the result of unintentional alloying due to trace metal content in the copper ore.[39] The addition of a second metal to copper increases its hardness, lowers the melting temperature, and improves the casting process by producing a more fluid melt that cools to a denser, less spongy metal.[39] This was an important innovation that allowed for the much more complex shapes cast in closed molds of the Bronze Age. Arsenical bronze objects appear first in the Near East where arsenic is commonly found with copper ore, but the health risks were quickly realized and the quest for sources of the much less hazardous tin ores began early in the Bronze Age.[40] Это создало спрос на редкий металлический олово и сформировало торговую сеть, которая связала отдаленные источники олова с рынками культур бронзового века. [ нужна ссылка ]
Касситерит ( SnO
2 ), оксидная форма олова, скорее всего, была первоначальным источником олова. Другие оловянные руды представляют собой менее распространенные сульфиды, такие как станнит , которые требуют более сложного процесса плавки . Касситерит часто накапливается в аллювиальных каналах в виде россыпных отложений, поскольку он тверже, тяжелее и химически устойчивее, чем сопутствующий гранит . [ 39 ] Касситерит обычно имеет черный или темный цвет, и эти отложения легко увидеть на берегах рек . Аллювиальные ( россыпные ) отложения могли случайно собираться и разделяться методами, аналогичными промывке золота . [ 41 ]
Соединения и химия
[ редактировать ]В подавляющем большинстве соединений олово имеет степень окисления II или IV. Соединения, содержащие двухвалентное олово, называются олово, а те, которые содержат четырехвалентное олово, называются оловянный .
Неорганические соединения
[ редактировать ]Галогенидные соединения известны в обеих степенях окисления. Для Sn(IV) хорошо известны все четыре галогенида: SnF 4 , SnCl 4 , SnBr 4 и SnI 4 . Три более тяжелых члена представляют собой летучие молекулярные соединения, тогда как тетрафторид является полимерным. Для Sn(II) известны также все четыре галогенида: SnF 2 , SnCl.
2 , SnBr 2 и SnI 2 . Все они представляют собой твердые полимерные вещества. Из этих восьми соединений только йодиды окрашены. [ 42 ]
Хлорид олова(II) (также известный как хлорид олова) является наиболее важным коммерческим галогенидом олова. Иллюстрируя пути получения таких соединений, хлор реагирует с металлическим оловом с образованием SnCl 4 , тогда как реакция соляной кислоты и олова дает SnCl.
2 и газообразный водород. Альтернативно SnCl 4 и Sn соединяются с хлоридом олова с помощью процесса, называемого сопропорционированием : [ 43 ]
- SnCl 4 + Sn → 2 SnCl
2
Олово может образовывать множество оксидов, сульфидов и других халькогенидов производных . Диоксид SnO
2 (касситерит) образуется при нагревании олова в присутствии воздуха . [ 42 ] SnO
2 амфотерен , что означает, что он растворяется как в кислых , так и в основных растворах. [ 44 ] Станнаты структуры [ Sn(OH)
6 ] 2− , как К
2 [ Sn(OH)
6 ], также известны, хотя свободная оловянная кислота H
2 [ Sn(OH)
6 ] неизвестно.
Сульфиды олова существуют как в степени окисления +2, так и в +4: сульфид олова (II) и сульфид олова (IV) ( мозаичное золото ).

2 ) [ 45 ]
Гидриды
[ редактировать ]Станнан ( SnH
4 ), с оловом в степени окисления +4, нестабилен. Однако хорошо известны оловоорганические гидриды, например гидрид трибутилолова (Sn(C 4 H 9 ) 3 H). [ 11 ] Эти соединения высвобождают временные радикалы трибутила олова , которые являются редкими примерами соединений олова (III). [ 46 ]
Оловоорганические соединения
[ редактировать ]Оловоорганические соединения, иногда называемые станнанами, представляют собой химические соединения со связями олово-углерод. [ 47 ] Из соединений олова органические производные являются коммерчески наиболее полезными. [ 48 ] Некоторые оловоорганические соединения высокотоксичны и используются в качестве биоцидов . Первым оловоорганическим соединением, о котором сообщалось, был дииодид диэтилолова ((C 2 H 5 ) 2 SnI 2 ), о котором сообщил Эдвард Франкленд в 1849 году. [ 49 ]
Большинство оловоорганических соединений представляют собой бесцветные жидкости или твердые вещества, устойчивые на воздухе и воде. Они принимают тетраэдрическую геометрию. Соединения тетраалкил- и тетраарилолова можно получить с использованием реактивов Гриньяра : [ 48 ]
- SnCl
4 + 4 РМгБр → R
4 Sn + 4 MgBrCl
Смешанные галоид-алкилы, которые более распространены и более важны с коммерческой точки зрения, чем тетраорганопроизводные, получаются реакциями перераспределения :
- SnCl
4 + Р
4 Sn → 2 SnCl
2R2R2
Двухвалентные оловоорганические соединения встречаются редко, хотя и более распространены, чем родственные двухвалентные германоорганические и кремнийорганические соединения. Большую стабилизацию Sn(II) объясняют «эффектом инертной пары ». Оловоорганические соединения (II) включают как станнилены (формула: R 2 Sn, как видно для синглетных карбенов ), так и дистаннилены (R 4 Sn 2 ), которые примерно эквивалентны алкенам . Оба класса демонстрируют необычные реакции. [ 50 ]
возникновение
[ редактировать ]
Олово образуется в результате длительного s -процесса в звездах с низкой и средней массой (с массами от 0,6 до 10 раз больше солнечной ) и, наконец, в результате бета-распада тяжелых изотопов индия . [ 51 ]
Олово является 49-м по распространенности элементом в земной коре , его содержание составляет 2 ppm по сравнению с 75 ppm цинка, 50 ppm меди и 14 ppm свинца. [ 52 ]
Олово не встречается в качестве самородного элемента, но его необходимо извлекать из различных руд. Касситерит ( SnO
2 ) является единственным коммерчески важным источником олова, хотя небольшие количества олова извлекаются из сложных сульфидов, таких как станнит , цилиндрит , франккеит , канфилдит и тиллит . Минералы с оловом почти всегда связаны с гранитной породой, обычно на уровне 1% содержания оксида олова. [ 53 ]
Из-за более высокого удельного веса диоксида олова около 80% добываемого олова приходится на вторичные месторождения, расположенные ниже по течению от первичных месторождений. Олово часто добывают из гранул, смытых в прошлом вниз по течению и отложенных в долинах или море. Наиболее экономичные способы добычи олова — дноуглубительные работы , гидромеханизация и открытые карьеры . Большая часть олова в мире производится из россыпных месторождений, которые могут содержать всего 0,015% олова. [ 54 ]
| Страна | Резервы |
|---|---|
| 1,500,000 | |
| 250,000 | |
| 310,000 | |
| 800,000 | |
| 590,000 | |
| 400,000 | |
| 350,000 | |
| 180,000 | |
| 170,000 | |
| Другой | 180,000 |
| Общий | 4,800,000 |
| Год | Миллион тонн |
|---|---|
| 1965 | 4,265 |
| 1970 | 3,930 |
| 1975 | 9,060 |
| 1980 | 9,100 |
| 1985 | 3,060 |
| 1990 | 7,100 |
| 2000 | 7,100 [ 55 ] |
| 2010 | 5,200 [ 55 ] |
В 2011 году было добыто около 253 000 тонн олова, в основном в Китае (110 000 тонн), Индонезии (51 000 тонн), Перу (34 600 тонн), Боливии (20 700 тонн) и Бразилии (12 000 тонн). [ 55 ] Оценки производства олова исторически менялись в зависимости от рынка и технологии добычи. По оценкам, при нынешних темпах потребления и технологиях на Земле закончится олово, пригодное для добычи полезных ископаемых, через 40 лет. [ 56 ] В 2006 году Лестер Браун предположил, что олово может иссякнуть в течение 20 лет, исходя из консервативных оценок ежегодного роста на 2%. [ 57 ]
Оловянный лом является важным источником металла. По состоянию на 2019 год восстановление олова путем переработки быстро растет. [ 58 ] Хотя Соединенные Штаты не добывали (с 1993 года) и не выплавляли (с 1989 года) олово, они были крупнейшим производителем вторичного олова, переработав в 2006 году почти 14 000 тонн олова. [ 55 ]
Сообщается о новых месторождениях в Монголии . [ 59 ] а в 2009 году новые месторождения олова были обнаружены в Колумбии. [ 60 ]
Производство
[ редактировать ]Олово получают карботермическим восстановлением оксидной руды углеродом или коксом. как отражательную печь , так и электрическую печь : Можно использовать [ 61 ] [ 62 ] [ 63 ]
- SnO 2 + C Sn + CO 2 ↑
Горное дело и плавка
[ редактировать ]Промышленность
[ редактировать ]В 2007 году десять крупнейших компаний-производителей олова произвели большую часть мирового олова.
Большая часть мирового олова торгуется на LME из 8 стран под 17 брендами. [ 64 ]
| Компания | Политика | 2006 | 2007 | 2017 [ 66 ] | 2006–2017 % изменять |
|---|---|---|---|---|---|
| Юньнань Тин | Китай | 52,339 | 61,129 | 74,500 | 42.3 |
| ПТ Тимах | Индонезия | 44,689 | 58,325 | 30,200 | −32.4 |
| Малайзийская металлургическая корпорация | Малайзия | 22,850 | 25,471 | 27,200 | 19.0 |
| Юньнань Чэнфэн | Китай | 21,765 | 18,000 | 26,800 | 23.1 |
| Минсур | Перу | 40,977 | 35,940 | 18,000 | −56.1 |
| ЭМ Винто | Боливия | 11,804 | 9,448 | 12,600 | 6.7 |
| Гуанси Китай Олово | Китай | / | / | 11,500 | / |
| Таисарко | Таиланд | 27,828 | 19,826 | 10,600 | −61.9 |
| Металло-Химический | Бельгия | 8,049 | 8,372 | 9,700 | 20.5 |
| Гецзю Цзы Ли | Китай | / | / | 8,700 | / |
Международный совет по олову был создан в 1947 году для контроля цен на олово. В 1985 году она распалась. В 1984 году была создана Ассоциация стран-производителей олова , в которую вошли Австралия, Боливия, Индонезия, Малайзия, Нигерия, Таиланд и Заир. [ 67 ]
Цена и обмен
[ редактировать ]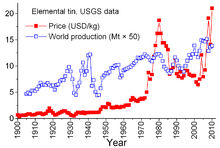
Олово является уникальным среди минерального сырья из-за сложных соглашений между странами-производителями и странами-потребителями, заключенными еще в 1921 году. Более ранние соглашения, как правило, носили несколько неформальный характер и привели к «Первому международному соглашению по олову» в 1956 году, первому из серии, которая фактически рухнула. в 1985 году. Благодаря этим соглашениям Международный совет по олову (ITC) оказал значительное влияние на цены на олово. ИТЦ поддерживал цены на олово в периоды низких цен, покупая олово для своих буферных запасов, и мог сдерживать цены в периоды высоких цен, продавая олово из запасов. Это был подход, направленный против свободного рынка, призванный обеспечить достаточный поток олова в страны-потребители и прибыль для стран-производителей. Однако буферные запасы были недостаточно велики, и в течение большей части этих 29 лет цены на олово росли, иногда резко, особенно с 1973 по 1980 год, когда безудержная инфляция поразила многие мировые экономики. [ 68 ]
В конце 1970-х и начале 1980-х годов США сократили свои стратегические запасы олова, отчасти для того, чтобы воспользоваться исторически высокими ценами на олово. Рецессия 1981–82 годов нанесла ущерб оловянной промышленности. Потребление олова резко сократилось. ИТЦ смог избежать действительно резкого падения за счет ускорения закупок своих резервных запасов; эта деятельность требовала обширных заимствований. ИТЦ продолжал брать займы до конца 1985 года, когда достиг своего кредитного лимита. Сразу же последовал крупный «оловянный кризис»: олово было исключено из торгов на Лондонской бирже металлов примерно на три года. Вскоре после этого ITC распался, а цена олова, находящегося теперь в условиях свободного рынка, упала до 4 долларов за фунт и оставалась на этом уровне до 1990-х годов. [ 68 ] Цена снова выросла к 2010 году с восстановлением потребления после экономического кризиса 2007–2008 годов , сопровождавшегося пополнением запасов и продолжающимся ростом потребления. [ 55 ]

Лондонская биржа металлов (LME) является основной торговой площадкой олова. [ 55 ] Другими контрактными рынками олова являются оловянный рынок Куала-Лумпура (KLTM) и Индонезийская биржа олова (INATIN). [ 69 ]
Из-за факторов, связанных с глобальным кризисом цепочек поставок в 2021 году , цены на олово выросли почти вдвое в течение 2020–2021 годов и показали самый большой годовой рост за более чем 30 лет. Мировое потребление рафинированного олова в 2020 году упало на 1,6 процента, поскольку пандемия COVID-19 разрушила мировую обрабатывающую промышленность. [ 70 ]
Приложения
[ редактировать ]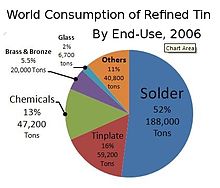
В 2018 году чуть менее половины всего произведенного олова было использовано для припоя. Остальное было разделено между оловом, оловянными химикатами, латунными и бронзовыми сплавами, а также нишевыми видами использования. [ 71 ]
Пигменты
[ редактировать ]Пигмент желтый 38, сульфид олова(IV) , известен как мозаичное золото . [ 72 ]
Пурпур Кассия , красный пигмент 109, водный двойной станнат золота , в живописи в основном использовался только для миниатюр из-за своей высокой стоимости. Его широко использовали для изготовления клюквенного стекла . Его также использовали в искусстве для окрашивания фарфора . [ 73 ]
Свинцово-оловянный желтый (который встречается в двух желтых формах — станнатной и силикатной ) был пигментом , который исторически имел большое значение для масляной живописи имел некоторое применение во фресках . и который в своей силикатной форме [ 74 ] Станнат свинца также известен в оранжевой форме, но не нашел широкого применения в изобразительном искусстве. Его можно приобрести в форме пигмента у специализированных поставщиков художников. Существует еще одна второстепенная форма с точки зрения художественного использования и доступности свинцово-оловянно-сурьмяного желтого .
Лазурный синий, несколько тусклый голубой цвет, химически известный как станнат кобальта , продолжает оставаться важным пигментом художников. Его оттенок похож на оттенок марганцевого этого пигмента синего, Pigment Blue 33, хотя ему не хватает красочности , и он более непрозрачен. [ 75 ] Художникам обычно приходится выбирать между имитациями станната кобальта и синего марганца, выполненными с фталоцианиновым сине-зеленым оттенком (синий пигмент 15: 3), поскольку промышленное производство синего марганцевого пигмента прекратилось в 1970-х годах. [ 76 ] Однако лазурный синий, изготовленный из станната кобальта, был популярен среди художников еще до производства марганцевого синего.
Пигмент красный 233, широко известный как Pinkcolor или Potter's Pink, а точнее известный как Chrome Tin Pink Sphene, является исторически важным пигментом в акварели . [ 77 ] Тем не менее, его популярность вновь возросла благодаря распространению молвы в Интернете . Он полностью светостойкий и химически стабильный как для масляных, так и для акварельных красок. Другие неорганические смешанные металлокомплексные пигменты, получаемые путем прокаливания , часто содержат в качестве компонента олово. Эти пигменты известны своей светостойкостью , атмосферостойкостью, химической стабильностью, отсутствием токсичности и непрозрачностью . Многие из них довольно скучны с точки зрения красочности. Однако некоторые из них обладают достаточной красочностью, чтобы быть конкурентоспособными в случаях использования, требующих более чем умеренного ее количества. Некоторые ценятся за другие качества. Например, многие акварелисты выбирают Pinkcolor из-за его сильной грануляции , хотя его насыщенность низкая. Недавно NTP Yellow ( пирохлор ) был выведен на рынок в качестве нетоксичной замены хромата свинца (II) с большей непрозрачностью, светостойкостью и устойчивостью к атмосферным воздействиям, чем предлагаемые органические пигменты-заменители хромата свинца. [ 78 ] NTP Yellow обладает самым высоким уровнем насыщенности цвета среди современных неорганических смешанных металлокомплексных пигментов. Другие примеры этой группы включают пигмент желтый 158 (оловянно-ванадиевый желтый касситерит ), [ 79 ] Пигмент Желтый 216 (Solaplex Yellow), [ 80 ] Пигмент желтый 219 ( титана , цинка и сурьмы станнат ), [ 81 ] Пигмент Оранжевый 82 (Олово, Титан, Цинк, также известный как Сикопал Оранжевый), [ 82 ] Пигмент красный 121 (также известный как оловянно-фиолетовый и станнат хрома ), [ 83 ] Пигмент Красный 230 (Хромглинозем Розовый Корунд ), [ 84 ] Пигмент Красный 236 (Хромоловянно-орхидный касситерит ), [ 85 ] и пигмент черный 23 (оловянно-сурьмяно-серый касситерит). [ 86 ] Еще один синий пигмент с оловом и кобальтом — Pigment Blue 81, Cobalt Tin Alumina Blue Spinel .
Пигмент Белый 15, оксид олова (IV), используется из-за его переливчатости , чаще всего в качестве керамической глазури . [ 87 ] художники не использовали зеленые пигменты, в состав которых входит олово, а пурпурные пигменты с оловом классифицируются как красные. Согласно Color Index International ,
Припой
[ редактировать ]
Олово уже давно используется в сплавах со свинцом в качестве припоя в количестве от 5 до 70% по весу. Олово со свинцом образует эвтектическую смесь при весовой пропорции 61,9% олова и 38,1% свинца (атомная пропорция: 73,9% олова и 26,1% свинца) с температурой плавления 183 °C (361,4 °F). Такие припои в основном используются для соединения труб или электрических цепей . С тех пор, как 1 июля 2006 года вступили в силу Директива Европейского Союза об отходах электрического и электронного оборудования (Директива WEEE) и Директива об ограничении использования опасных веществ , содержание свинца в таких сплавах снизилось. Хотя воздействие свинца связано с серьезными проблемами со здоровьем , бессвинцовый припой не лишен проблем, включая более высокую температуру плавления и образование оловянных усов , которые вызывают электрические проблемы. Оловянный вредитель может возникнуть в бессвинцовых припоях, приводя к потере паяного соединения. Сплавы для замены находятся, но проблемы целостности соединений остаются. [ 88 ] Обычный бессвинцовый сплав состоит из 99% олова, 0,7% меди и 0,3% серебра с температурой плавления 217 ° C (422,6 ° F). [ 89 ]
Лужение
[ редактировать ]
Олово легко связывается с железом и используется для покрытия свинца , цинка и стали для предотвращения коррозии. Контейнеры из луженой (или луженой) стали широко используются для консервирования пищевых продуктов , и они составляют большую часть рынка металлической банки. Жестяная канистра для консервирования продуктов питания была впервые изготовлена в Лондоне в 1812 году. [ 90 ] Носители британского английского языка называют такие контейнеры «банками», а носители американского английского — « банками » или «консервными банками». Одним из производных такого употребления является жаргонный термин « тинни » или «тинни», что в Австралии означает «банка пива». Оловянный свисток назван так потому, что сначала он производился серийно из луженой стали. [ 91 ] [ 92 ]
Медные сосуды для приготовления пищи, такие как кастрюли и сковороды, часто покрываются тонким оловянным покрытием гальванопокрытием или традиционными химическими методами, поскольку использование медной посуды с кислыми продуктами может быть токсичным.
Специализированные сплавы
[ редактировать ]

Олово в сочетании с другими элементами образует множество полезных сплавов. Олово чаще всего легируют медью. Пьютер на 85–99% состоит из олова, [ 93 ] и подшипниковый металл также имеет высокий процент олова. [ 94 ] [ 95 ] Бронза состоит в основном из меди с 12% олова, а добавление фосфора дает фосфористую бронзу . Металл Белла также представляет собой сплав меди и олова, содержащий 22% олова. Олово иногда использовалось в чеканке монет; когда-то он составлял однозначный процент (обычно пять процентов или меньше) американского населения. [ 96 ] и канадский [ 97 ] копейки. Поскольку основным металлом в таких монетах часто является медь, иногда включая цинк, их можно назвать бронзовыми или латунными сплавами.
Соединение ниобия и олова Nb 3 Sn промышленно используется в катушках сверхпроводящих магнитов из-за его высокой критической температуры (18 К) и критического магнитного поля (25 Тл ). Сверхпроводящий магнит весом всего два килограмма способен создавать магнитное поле обычного электромагнита весом в тонны. [ 98 ]
Небольшой процент олова добавляют в циркониевые сплавы для оболочки ядерного топлива. [ 99 ]
Большинство металлических труб в органе изготовлены из сплава олова и свинца, наиболее распространенный состав которых составляет 50/50. Пропорция олова в трубке определяет тон трубы, поскольку олово имеет желаемый тональный резонанс. При охлаждении сплава олово/свинец сначала затвердевает фаза свинца, затем при достижении эвтектической температуры оставшаяся жидкость образует слоистую эвтектическую структуру олово/свинец, которая является блестящей; контраст со свинцовой фазой дает пестрый или пятнистый эффект. Этот металлический сплав называется пятнистым металлом. Основными преимуществами использования олова для труб являются его внешний вид, технологичность и устойчивость к коррозии. [ 100 ] [ 101 ]
Производство химикатов
[ редактировать ]Соединения олова используются в производстве различных химикатов, в том числе стабилизаторов ПВХ и катализаторов промышленных процессов. Олово в виде слитков является сырьем, необходимым для этих химических реакций, обеспечивая стабильное качество и производительность. [ 102 ]
Оптоэлектроника
[ редактировать ]Оксиды индия и олова электропроводны и прозрачны и используются для изготовления прозрачных электропроводящих пленок, которые применяются в устройствах оптоэлектроники , таких как жидкокристаллические дисплеи . [ 103 ]
Другие приложения
[ редактировать ]
Перфорированная луженая сталь, также называемая перфорированной жестью, представляет собой ремесленную технику, зародившуюся в Центральной Европе, для создания функциональной и декоративной посуды. Декоративные дизайны пирсинга существуют в широком разнообразии, в зависимости от местных традиций и мастеров-ремесленников. Перфорированные оловянные фонарики — наиболее распространенное применение этой ремесленной техники. Свет свечи, проникающий сквозь проколотый узор, создает декоративный световой узор в комнате, где она находится. Фонари и другие изделия из перфорированной жести были созданы в Новом Свете с самого раннего европейского поселения. Хорошо известный пример — фонарь Revere, названный в честь Пола Ревира . [ 104 ]
В Америке сейфы для пирогов и пищевых продуктов использовались еще до появления холодильного оборудования. Это были деревянные шкафы разных стилей и размеров – напольные или подвесные, предназначенные для защиты от вредителей и насекомых и защиты от пыли от скоропортящихся продуктов. В дверях, а иногда и по бокам этих шкафов были вставки из жести, вырезанные домовладельцем, краснодеревщиком или жестянщиком различной конструкции, чтобы обеспечить циркуляцию воздуха и исключить мух. Современные репродукции этих изделий по-прежнему популярны в Северной Америке. [ 105 ]
Оконное стекло чаще всего изготавливается путем плавления расплавленного стекла на расплавленном олове ( флот-стекло ), в результате чего получается плоская и безупречная поверхность. Это еще называют « процессом Пилкингтона ». [ 106 ]
Олово используется в качестве отрицательного электрода в современных литий-ионных батареях . Его применение несколько ограничено тем, что некоторые оловянные поверхности [ который? ] катализировать разложение электролитов на основе карбонатов, используемых в литий-ионных батареях. [ 107 ]
Фторид олова(II) добавляют в некоторые средства по уходу за зубами. [ 108 ] в виде фторида олова (SnF 2 ). Фторид олова(II) можно смешивать с абразивами кальция , в то время как более распространенный фторид натрия постепенно становится биологически неактивным в присутствии соединений кальция. [ 109 ] Также было показано, что он более эффективен, чем фторид натрия, в борьбе с гингивитом . [ 110 ]
Олово используется в качестве мишени для создания лазерно-индуцированной плазмы , которая действует как источник света для литографии в крайнем ультрафиолете . [ 111 ]
Оловоорганические соединения
[ редактировать ]Мировое промышленное производство оловоорганических соединений, вероятно, превышает 50 000 тонн . [ 112 ]
Стабилизаторы ПВХ
[ редактировать ]Основное коммерческое применение оловоорганических соединений - стабилизация ПВХ- пластиков. В отсутствие таких стабилизаторов ПВХ быстро разлагается под воздействием тепла, света и кислорода воздуха, что приводит к обесцвечиванию и хрупкости изделий. Олово удаляет лабильные ионы хлорида (Cl − ), что в противном случае привело бы к удалению HCl из пластика. [ 113 ] Типичными соединениями олова являются производные карбоновой кислоты дихлорида дибутилолова, такие как дилаурат дибутилолова . [ 114 ]
Биоциды
[ редактировать ]Некоторые оловоорганические соединения относительно токсичны, имеют как преимущества, так и проблемы. Они используются из-за биоцидных свойств в качестве фунгицидов , пестицидов , альгицидов , консервантов древесины и средств против обрастания . [ 113 ] Оксид трибутилолова используется в качестве консерванта древесины . [ 115 ] Трибутилолово используется для различных промышленных целей, таких как борьба со шламом на бумажных фабриках и дезинфекция оборотной промышленной охлаждающей воды. [ 116 ] Трибутилолово использовалось в качестве добавки к корабельной краске для предотвращения роста организмов-обрастателей на судах, причем его использование сократилось после того, как оловоорганические соединения были признаны стойкими органическими загрязнителями с высокой токсичностью для некоторых морских организмов ( собачьего трубача ). например, [ 117 ] ЕС запретил использование оловоорганических соединений в 2003 году. [ 118 ] хотя опасения по поводу токсичности этих соединений для морской жизни и ущерба для воспроизводства и роста некоторых морских видов [ 113 ] (в некоторых отчетах описывается биологическое воздействие на морскую жизнь при концентрации 1 нанограмм на литр) привели к всемирному запрету Международной морской организации . [ 119 ] Многие страны в настоящее время ограничивают использование оловоорганических соединений судами длиной более 25 м (82 фута). [ 113 ] Стойкость трибутилолова в водной среде зависит от природы экосистемы. [ 120 ] Из-за такой стойкости и его использования в качестве добавки в корабельную краску высокие концентрации трибутилолова были обнаружены в морских отложениях, расположенных вблизи военно-морских доков. [ 121 ] Трибутилолово использовалось в качестве биомаркера импрессуса у неогастропод , по крайней мере, 82 известных видов. [ 122 ] Из-за высокого уровня ТБТ в местных прибрежных районах из-за судоходства моллюски оказали неблагоприятное воздействие. [ 120 ] Импосекс – это наложение мужских половых признаков на самок, при котором у них вырастают половой член и мантийный семявыносящий проток . [ 122 ] [ 123 ] Высокий уровень ТБТ может повредить эндокринные железы млекопитающих , репродуктивную и центральную нервную системы , структуру костей и желудочно-кишечный тракт . [ 123 ] Трибутилтин влияет не только на млекопитающих, но и на каланов, китов, дельфинов и людей. [ 123 ]
Органическая химия
[ редактировать ]Некоторые оловянные реагенты полезны в органической химии . В большинстве случаев хлорид олова является распространенным восстановителем для превращения нитро- и оксимных групп в амины . Реакция Стилле соединяет оловоорганические соединения с органическими галогенидами или псевдогалогенидами . [ 124 ]
Литий-ионные аккумуляторы
[ редактировать ]Олово образует несколько интерметаллических фаз с металлическим литием, что делает его потенциально привлекательным материалом для аккумуляторов. Большое объемное расширение олова при легировании литием и нестабильность границы раздела олово-органический электролит при низких электрохимических потенциалах являются самыми большими проблемами при использовании в коммерческих элементах. [ 125 ] Интерметаллическое соединение олова с кобальтом и углеродом было использовано Sony в своих элементах Nexelion, выпущенных в конце 2000-х годов. Состав активного материала составляет примерно Sn 0,3 Co 0,4 C 0,3 . Исследования показали, что только некоторые кристаллические грани тетрагонального (бета) Sn ответственны за нежелательную электрохимическую активность. [ 126 ]
Меры предосторожности
[ редактировать ]Случаи отравления металлическим оловом, его оксидами и солями практически неизвестны. С другой стороны, некоторые оловоорганические соединения почти так же токсичны, как цианид . [ 48 ]
Воздействие олова на рабочем месте может произойти при вдыхании, контакте с кожей и глазами. США Управление по охране труда (OSHA) установило допустимый предел воздействия олова на рабочем месте на уровне 2 мг/м. 3 более 8-часового рабочего дня. Национальный институт охраны труда (NIOSH) определил рекомендуемый предел воздействия (REL) 2 мг/м. 3 более 8-часового рабочего дня. На уровне 100 мг/м 3 , олово сразу опасно для жизни и здоровья . [ 127 ]
См. также
[ редактировать ]- Касситериды (мифические Оловянные острова)
- Станнари
- Тупой
- Оловянный вредитель
- Добыча олова в Великобритании
- Слушать
- Усы (металлургия) (усы олова)
Примечания
[ редактировать ]- ^ Тепловое расширение β-Sn анизотропно : параметры (при 20 ° C) для каждой оси кристалла составляют α a = 16,19 × 10. −6 /К, α с = 32,89 × 10 −6 /K, а α среднее = α V /3 = 21,76 × 10. −6 /К. [ 3 ]
- ^ Только водород, фтор, фосфор, таллий и ксенон легче использовать для анализа ЯМР для образцов, содержащих изотопы в их естественном количестве.
Ссылки
[ редактировать ]- ^ «Стандартные атомные массы: олово» . ЦИАВ . 1983.
- ^ Прохаска, Томас; Ирргехер, Йоханна; Бенефилд, Жаклин; Бёлке, Джон К.; Чессон, Лесли А.; Коплен, Тайлер Б.; Дин, Типинг; Данн, Филип Дж. Х.; Грёнинг, Манфред; Холден, Норман Э.; Мейер, Харро Эй Джей (4 мая 2022 г.). «Стандартные атомные веса элементов 2021 (Технический отчет ИЮПАК)» . Чистая и прикладная химия . дои : 10.1515/pac-2019-0603 . ISSN 1365-3075 .
- ^ Jump up to: а б с д и Арбластер, Джон В. (2018). Некоторые значения кристаллографических свойств элементов . Парк материалов, Огайо: ASM International. ISBN 978-1-62708-155-9 .
- ^ «Новый тип соединения нуль-валентного олова» . Химия Европы . 27 августа 2016 г.
- ^ «ХСН» . Интернет-книга NIST по химии . Национальный институт стандартов и технологий . Проверено 23 января 2013 г.
- ^ «СнХ3» . Интернет-книга NIST по химии . Национальный институт стандартов и технологий . Проверено 23 января 2013 г.
- ^ Лиде, Д.Р., изд. (2005). «Магнитная восприимчивость элементов и неорганических соединений». Справочник CRC по химии и физике (PDF) (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 0-8493-0486-5 .
- ^ Уэст, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Издательство компании Chemical Rubber Company. стр. E110. ISBN 0-8493-0464-4 .
- ^ Кондев, ФГ; Ван, М.; Хуанг, WJ; Наими, С.; Ауди, Г. (2021). «Оценка ядерных свойств NUBASE2020» (PDF) . Китайская физика C . 45 (3): 030001. doi : 10.1088/1674-1137/abddae .
- ^ Грей, Теодор (2007). «Жестяные образы» . Элементы . Черный Пес и Левенталь.
- ^ Jump up to: а б с д и Холлеман, Арнольд Ф.; Виберг, Эгон; Виберг, Нильс (1985). «Жесть». Учебник неорганической химии (на немецком языке) (91–100 изд.). Вальтер де Грюйтер. стр. 793–800. ISBN 978-3-11-007511-3 .
- ^ «Чернила с наночастицами олова могут печатать будущие печатные платы» . Физика.орг . 12 апреля 2011 г. Архивировано из оригинала 16 сентября 2011 г.
- ^ Джо, Юн Хван; Юнг, Инью; Чхве, Чон Сок; Ким, Инёнг; Ли, Хёк Мо (2011). «Синтез и определение характеристик низкотемпературных наночастиц олова для производства чернил с высокой проводимостью». Нанотехнологии . 22 (22): 225701. Бибкод : 2011Nanot..22v5701J . дои : 10.1088/0957-4484/22/22/225701 . ПМИД 21454937 . S2CID 25202674 .
- ^ Молодец, А.М.; Набатов, С.С. (2000). «Термодинамические потенциалы, диаграмма состояния и фазовые переходы олова при ударном сжатии». Высокая температура . 38 (5): 715–721. Бибкод : 2000HTemp..38..715M . дои : 10.1007/BF02755923 . S2CID 120417927 .
- ^ «Оловянные вредители | Центр передового проектирования жизненного цикла» . Calce.umd.edu . Проверено 4 ноября 2022 г.
- ^ Ле Курёр, Пенни; Бурресон, Джей (2004). Пуговицы Наполеона: 17 молекул, изменивших историю . Нью-Йорк: Penguin Group, США.
- ^ Орстрем, Ларс (2013). Последний алхимик в Париже . Оксфорд: Издательство Оксфордского университета. ISBN 978-0-19-966109-1 .
- ^ Коттон, Саймон (29 апреля 2014 г.). «Рецензия на книгу: Последний алхимик в Париже» . Химический мир . Королевское химическое общество . Архивировано из оригинала 10 августа 2014 года . Проверено 22 ноября 2019 г.
- ^ Эмсли, Джон (1 октября 2011 г.) [2001]. Строительные блоки природы: Путеводитель по элементам от Аризоны (новое издание). Нью-Йорк, США: Издательство Оксфордского университета . п. 552. ИСБН 978-0-19-960563-7 .
Металлические пуговицы были только у офицеров, и то из латуни.
- ^ Jump up to: а б Шварц, Мел (2002). «Олово и сплавы, свойства». Энциклопедия материалов, деталей и отделки (2-е изд.). ЦРК Пресс. ISBN 978-1-56676-661-6 .
- ^ «Сплавы олова – характеристики и применение» . Ядерная энергетика . Проверено 4 ноября 2022 г.
- ^ Дехаас, В.; Дебоер, Дж.; Ванденберг, Г. (1935). «Электрическое сопротивление кадмия, таллия и олова при низких температурах». Физика . 2 (1–12): 453. Бибкод : 1935Phy.....2..453D . дои : 10.1016/S0031-8914(35)90114-8 .
- ^ Jump up to: а б Мейснер, В.; Р. Оксенфельд (1933). «Новый эффект при возникновении сверхпроводимости». естественные науки . 21 (44): 787–788. Бибкод : 1933NW.....21..787M . дои : 10.1007/BF01504252 . S2CID 37842752 .
- ^ Крейг, Брюс Д.; Андерсон, Дэвид С.; Международный, ASM (январь 1995 г.). Справочник данных по коррозии . АСМ Интернешнл. п. 126. ИСБН 978-0-87170-518-1 . Архивировано из оригинала 11 мая 2016 г.
- ^ Кратчлоу, Шарлотта (25 июня 2021 г.). «Образование олова об элементе олово | Таблица Менделеева» . ХимТок . Проверено 4 ноября 2022 г.
- ^ «Интерактивная карта частот ЯМР» . Архивировано из оригинала 4 июня 2011 г. Проверено 5 мая 2009 г.
- ^ «Длины и сечения рассеяния нейтронов» .
- ^ «Westinghouse Nuclear > Энергетические системы > Быстрый реактор со свинцовым теплоносителем» .
- ^ Уокер, Фил (1994). «Двойное волшебное открытие олова-100». Мир физики . 7 (июнь): 28. дои : 10.1088/2058-7058/7/6/24 .
- ^ Ауди, Жорж; Берсильон, Оливье; Блашо, Жан; Вапстра, Аалдерт Хендрик (2003), « Оценка NUBASE свойств ядра и распада» , Nuclear Physics A , 729 : 3–128, Бибкод : 2003NuPhA.729....3A , doi : 10.1016/j.nuclphysa.2003.11 .001
- ^ Jump up to: а б Браганьи, Алессандро; Вомбахер, Фрэнк; Кирхенбаур, Мария; Браукмюллер, Ниндзя; Мюнкер, Карстен (2023). «Независимое от массы фракционирование изотопов олова и радиогенный 115Sn в хондритах и земных породах». Geochimica et Cosmochimica Acta . 344 : 40–58. дои : 10.1016/j.gca.2023.01.014 .
- ^ Кэмерон, AGW (1973). «Изобилие элементов в Солнечной системе» (PDF) . Обзоры космической науки . 15 (1): 121–146. Бибкод : 1973ССРв...15..121С . дои : 10.1007/BF00172440 . S2CID 120201972 . Архивировано из оригинала (PDF) 21 октября 2011 г.
- ^ Jump up to: а б с «жесть» . Оксфордский словарь английского языка (онлайн-изд.). Издательство Оксфордского университета . (Требуется подписка или членство участвующей организации .)
- ^ Харпер, Дуглас. «жесть» . Интернет-словарь этимологии .
- ^ Британская энциклопедия, 11-е издание , 1911, sv ' tin ', со ссылкой на Х. Коппа.
- ^ «Древняя добыча олова» . oxleigh.freeserve.co.uk . Архивировано из оригинала 3 апреля 2009 г. Проверено 7 июля 2009 г.
- ^ Словарь американского наследия
- ^ Черни, Дж.; Вайсгербер, Г. (2003). «Оловянные рудники бронзового века в Центральной Азии». В Джумлия-Майр, А.; Ло Скьяво, Ф. (ред.). Проблема раннего олова . Оксфорд: Archaeopress. стр. 23–31. ISBN 978-1-84171-564-3 .
- ^ Jump up to: а б с Пенхаллурик, РД (1986). Олово в древности: его добыча и торговля во всем древнем мире, особенно в Корнуолле . Лондон: Институт металлов. ISBN 978-0-904357-81-3 .
- ^ Ламберг-Карловский, CC; Франклин, Алан Д.; Олин, Жаклин С.; Вертайм, Теодор А. , ред. (июль 1980 г.). «Развитие применения олова и оловянной бронзы: некоторые проблемы». Поиски древнего олова . Том. 21. Вашингтон, округ Колумбия: Семинар, организованный Теодором А. Вертаймом и проведенный в Смитсоновском институте и Национальном бюро стандартов, Вашингтон, округ Колумбия, 14–15 марта 1977 г. с. 474. дои : 10.2307/3103162 . JSTOR 3103162 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Дубе, РК (сентябрь 2006 г.). «Взаимосвязь между золотом и оловом: историческая перспектива» . Золотой бюллетень . 39 (3): 103–113. дои : 10.1007/BF03215537 .
- ^ Jump up to: а б Холлеман, Арнольд Фредерик; Виберг, Эгон (2001), Виберг, Нильс (ред.), Неорганическая химия , перевод Иглсона, Мэри; Брюэр, Уильям, Сан-Диего/Берлин: Academic Press/De Gruyter, ISBN 0-12-352651-5
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 . [ нужна страница ]
- ^ Тейлор, Ф. Шервуд (1942). Неорганическая и теоретическая химия (6-е изд.). Хайнеман.
- ^ Леже, Дж. М.; Хейнс, Дж.; Атуф, А. (1996). «Поведение котуннитовой и посткотуннитовой фаз PbCl 2 и SnCl при высоком давлении.
2 ". J. Phys. Chem. Solids . 57 (1): 7–16. Бибкод : 1996JPCS...57....7L . doi : 10.1016/0022-3697(95)00060-7 . - ^ Гаур, Д.П.; Шривастава, Г.; Мехротра, RC (1973). «Органические производные олова. III. Реакции этоксида триалкилолова с алканоламинами». Журнал неорганической и общей химии . 398 :72. дои : 10.1002/zaac.19733980109 .
- ^ Эльшенбройх, Кристоф (2006). Металлоорганические соединения (3-е, полностью переработанное и расширенное изд.). Вайнхайм: Wiley-VCH. ISBN 3-527-29390-6 . OCLC 64305455 .
- ^ Jump up to: а б с Граф, Г.Г. (2000) «Олово, сплавы олова и соединения олова» в Энциклопедии промышленной химии Ульмана . Wiley-VCH, Вайнхайм дои : 10.1002/14356007.a27_049
- ^ Тунен, Сандер Х.Л.; Дилман, Берт-Ян; ван Котен, Жерар (2004). «Синтетические аспекты тетраорганолова и оловоорганических галогенидов» (PDF) . Журнал металлоорганической химии . 689 (13): 2145–2157. doi : 10.1016/j.jorganchem.2004.03.027 . hdl : 1874/6594 . S2CID 100214292 . Архивировано из оригинала (PDF) 7 августа 2011 г. Проверено 31 июля 2009 г.
- ^ Пэн, Ян; Эллис, Бобби Д.; Ван, Синьпин; Феттингер, Джеймс С.; Энергия, ПП (2009). «Обратимые реакции этилена с дистаннинами в условиях окружающей среды». Наука . 325 (5948): 1668–1670. Бибкод : 2009Sci...325.1668P . дои : 10.1126/science.1176443 . ПМИД 19779193 . S2CID 3011002 .
- ^ Шу, Фрэнк Х. (1982). Физическая вселенная: Введение в астрономию . Университетские научные книги. стр. 119–121 . ISBN 978-0-935702-05-7 .
- ^ Эмсли 2001 , стр. 124, 231, 449 и 503.
- ^ Jump up to: а б «Олово: от руды к слитку» . Международный институт исследования олова. 1991. Архивировано из оригинала 22 марта 2009 г. Проверено 21 марта 2009 г.
- ^ Сатфин, Дэвид М.; Сабин, Эндрю Э.; Рид, Брюс Л. (1 июня 1992 г.). Олово – Сводный отчет о международной инвентаризации стратегических полезных ископаемых . ДИАНА. п. 9. ISBN 978-0-941375-62-7 . Архивировано из оригинала 28 апреля 2016 г.
- ^ Jump up to: а б с д и ж г Карлин, Джеймс Ф. младший «Олово: статистика и информация» (PDF) . Геологическая служба США. Архивировано из оригинала 6 декабря 2008 г. Проверено 23 ноября 2008 г.
- ^ Рейли, Майкл (26 мая 2007 г.). «Как долго это продлится?». Новый учёный . 194 (2605): 38–39. Бибкод : 2007NewSc.194...38R . дои : 10.1016/S0262-4079(07)61508-5 .
- ^ Браун, Лестер (2006). План Б 2.0 . Нью-Йорк: WW Нортон. п. 109. ИСБН 978-0-393-32831-8 .
- ^ Алвес, Бруна (15 февраля 2024 г.). «Ежегодная переработка олова в США, 2023 год» . Статистика . Проверено 23 июня 2024 г.
- ^ Коваленко В.И.; Ярмолюк, В.В. (1995). «Эндогенные редкометальные рудные образования и редкометальная металлогения Монголии». Экономическая геология . 90 (3): 520. Бибкод : 1995EcGeo..90..520K . дои : 10.2113/gsecongeo.90.3.520 .
- ^ «Группа семинолов Колумбии обнаруживает высококачественную оловянную руду в джунглях Амазонки» . Пресс-релиз FreePR101. Архивировано из оригинала 26 августа 2014 г.
- ^ Шрейдер, Джордж Ф.; Эльшеннави, Ахмад К.; Дойл, Лоуренс Э. (июль 2000 г.). Производственные процессы и материалы . Общество инженеров-технологов. ISBN 978-0-87263-517-3 . Архивировано из оригинала 11 мая 2016 г.
- ^ Луи, Генри (1911). Металлургия олова . Книжная компания McGraw-Hill.
- ^ Кнорр, Клаус (1945). Олово под контролем . Издательство Стэнфордского университета. ISBN 978-0-8047-2136-3 . Архивировано из оригинала 19 мая 2016 г.
- ^ «LME Tin Brands» . ITRI.co.uk. Международный институт исследования олова. Архивировано из оригинала 7 декабря 2008 г. Проверено 5 мая 2009 г.
- ^ «Десять крупнейших компаний-производителей олова» . itri.co.uk. Международный институт исследования олова. Архивировано из оригинала 7 декабря 2008 г. Проверено 5 мая 2009 г.
- ^ «Крупнейшие производители олова в мире» . Баланс . 13 января 2019 г.
- ^ «Соглашение о создании Ассоциации стран-производителей олова [1984] ATS 10» . Австралазийский институт правовой информации, Австралийская библиотека договоров .
- ^ Jump up to: а б Карлин, Джеймс Ф. младший (1998). «Значительные события, повлиявшие на цены на олово с 1958 года» (PDF) . Геологическая служба США. Архивировано из оригинала (PDF) 28 октября 2011 г.
- ^ «12 января Пемасаран Пердана ИНАТИН» . 15 декабря 2011 г. Архивировано из оригинала 26 апреля 2012 г.
- ^ Дейли, Том (5 декабря 2021 г.). «Всплеск олова усугубляет проблемы с цепочками поставок для компаний, производящих электронику, солнечную энергетику и автомобилестроение» . Рейтер . Проверено 7 декабря 2021 г.
- ^ «Спрос на олово снижается – Международная оловянная ассоциация» . Майнинг.com . 18 октября 2019 г. Проверено 03 июля 2021 г.
- ^ «База данных цветных художественных пигментов — желтый пигмент — PY» . художественное творчество . 2024 . Проверено 17 августа 2024 г.
{{cite web}}: CS1 maint: статус URL ( ссылка ) - ^ «База данных цветных художественных пигментов - Красный пигмент - PR» . художественное творчество . 2024 . Проверено 17 августа 2024 г.
{{cite web}}: CS1 maint: статус URL ( ссылка ) - ^ «База данных цветных художественных пигментов — желтый пигмент — PY» . художественное творчество . 2024 . Проверено 17 августа 2024 г.
{{cite web}}: CS1 maint: статус URL ( ссылка ) - ^ «База данных цветных художественных пигментов — синий пигмент — PB» . художественное творчество . 2024 . Проверено 17 августа 2024 г.
{{cite web}}: CS1 maint: статус URL ( ссылка ) - ^ «База данных цветных художественных пигментов — синий пигмент — PB» . художественное творчество . 2024 . Проверено 17 августа 2024 г.
{{cite web}}: CS1 maint: статус URL ( ссылка ) - ^ «База данных цветных художественных пигментов - Красный пигмент - PR» . художественное творчество . 2024 . Проверено 17 августа 2024 г.
{{cite web}}: CS1 maint: статус URL ( ссылка ) - ^ «База данных цветных художественных пигментов — желтый пигмент — PY» . художественное творчество . 2024 . Проверено 17 августа 2024 г.
{{cite web}}: CS1 maint: статус URL ( ссылка ) - ^ «База данных цветных художественных пигментов — желтый пигмент — PY» . художественное творчество . 2024 . Проверено 17 августа 2024 г.
{{cite web}}: CS1 maint: статус URL ( ссылка ) - ^ «База данных цветных художественных пигментов — желтый пигмент — PY» . художественное творчество . 2024 . Проверено 17 августа 2024 г.
{{cite web}}: CS1 maint: статус URL ( ссылка ) - ^ «База данных цветных художественных пигментов — желтый пигмент — PY» . художественное творчество . 2024 . Проверено 17 августа 2024 г.
{{cite web}}: CS1 maint: статус URL ( ссылка ) - ^ «База данных цветных художественных пигментов - оранжевый пигмент - PO» . художественное творчество . 2024 . Проверено 17 августа 2024 г.
{{cite web}}: CS1 maint: статус URL ( ссылка ) - ^ «База данных цветных художественных пигментов - Красный пигмент - PR» . художественное творчество . 2024 . Проверено 17 августа 2024 г.
{{cite web}}: CS1 maint: статус URL ( ссылка ) - ^ «База данных цветных художественных пигментов - Красный пигмент - PR» . художественное творчество . 2024 . Проверено 17 августа 2024 г.
{{cite web}}: CS1 maint: статус URL ( ссылка ) - ^ «База данных цветных художественных пигментов - Красный пигмент - PR» . художественное творчество . 2024 . Проверено 17 августа 2024 г.
{{cite web}}: CS1 maint: статус URL ( ссылка ) - ^ «База данных цветных художественных пигментов - Черный пигмент - PBk» . художественное творчество . 2024 . Проверено 17 августа 2024 г.
{{cite web}}: CS1 maint: статус URL ( ссылка ) - ^ «База данных цветных художественных пигментов — Белый пигмент — PW» . художественное творчество . 2024 . Проверено 17 августа 2024 г.
{{cite web}}: CS1 maint: статус URL ( ссылка ) - ^ Блэк, Харви (2005). «Выход из электроники» . Перспективы гигиены окружающей среды . 113 (10): А682–5. дои : 10.1289/ehp.113-a682 . ПМЦ 1281311 . ПМИД 16203230 .
- ^ «Технический паспорт - Бессвинцовый сплав» (PDF) . РС Онлайн . Проверено 18 июня 2023 г.
- ^ Чайлдс, Питер (июль 1995 г.). «Сказка жестянщика» . Химическое образование . Том. 32, нет. 4. Королевское химическое общество . п. 92 . Проверено 19 июня 2018 г.
- ^ Контроль, Tin Under (1945). Олово под контролем . стр. 10–15. ISBN 978-0-8047-2136-3 . Архивировано из оригинала 31 мая 2016 г.
- ^ Группа по олову, Национальный исследовательский совет (США). Комитет по техническим аспектам критических и стратегических материалов (1970). Тенденции использования олова . стр. 10–22. Архивировано из оригинала 22 мая 2016 г.
- ^ Халл, Чарльз (1992). Пьютер . Издательство Оспри. стр. 1–5. ISBN 978-0-7478-0152-8 .
- ^ Тормоза, Джеймс (2009). "Введение" . Анализ Бэббита . БиблиоБазар, ООО. стр. 1–2. ISBN 978-1-110-11092-6 .
- ^ Уильямс, Роберт С. (2007). Основы металлографии . Читайте книги. стр. 46–47. ISBN 978-1-4067-4671-6 .
- ^ «Состав цента» . Монетный двор США. Архивировано из оригинала 25 октября 2011 г. Проверено 28 октября 2011 г.
- ^ «Состав канадских монет» (PDF) . Канадский монетный двор. Архивировано (PDF) из оригинала 13 января 2012 г. Проверено 28 октября 2011 г.
- ^ Гебалле, Теодор Х. (октябрь 1993 г.). «Сверхпроводимость: от физики к технологии». Физика сегодня . 46 (10): 52–56. Бибкод : 1993PhT....46j..52G . дои : 10.1063/1.881384 .
- ^ Кэмпбелл, Флейк К. (2008). «Цирконий» . Элементы металлургии и конструкционных сплавов . АСМ Интернешнл. п. 597. ИСБН 978-0-87170-867-0 . Архивировано из оригинала 28 мая 2016 г.
- ^ Роберт Палмьери, изд. (2006). «Трубный металл» . Энциклопедия клавишных инструментов . Нью-Йорк: Гарленд. п. 411 . ISBN 978-0-415-94174-7 .
- ^ Джордж Эшдаун Одсли (1988). «Металлические трубы: и материалы, используемые при их строительстве» . Искусство изготовления органов Одсли, Джордж Эшдаун . Публикации Courier Dover. п. 501 . ISBN 978-0-486-21315-6 .
- ^ Гупта, Яш. «Оловянные слитки» . Рикаяа .
- ^ Ким, Х.; Гилмор, К.; Пике, А.; Хорвиц, Дж.; Маттусси, Х .; Мурата, Х.; Кафафи, З.; Криси, Д. (1999). «Электрические, оптические и структурные свойства тонких пленок оксида индия и олова для органических светоизлучающих устройств». Журнал прикладной физики . 86 (11): 6451. Бибкод : 1999JAP....86.6451K . дои : 10.1063/1.371708 .
- ^ Бридж, Джанет (сентябрь 1996 г.). Изготовление и декорирование рамок для фотографий . Книги Северного сияния. ISBN 978-0-89134-739-2 .
- ^ «Жестяная штамповка» . Архивировано из оригинала 11 августа 2011 г. Проверено 15 августа 2011 г.
- ^ Пилкингтон, лаборатория (1969). «Обзорная лекция. Процесс флоат-стекла». Труды Лондонского королевского общества. Серия А, Математические и физические науки . 314 (1516): 1–25. Бибкод : 1969РСПСА.314....1П . дои : 10.1098/rspa.1969.0212 . JSTOR 2416528 . S2CID 109981215 .
- ^ Лукас, Иван Т.; Сыздек, Ярослав; Костецкий, Роберт (2011). «Межфазные процессы на монокристаллических β-Sn-электродах в органокарбонатных электролитах». Электрохимические коммуникации . 13 (11): 1271–1275. дои : 10.1016/j.elecom.2011.08.026 .
- ^ «Колгейт Гель-Кам» . Архивировано из оригинала 27 апреля 2009 г. Проверено 5 мая 2009 г.
- ^ Хаттаб, Ф. (апрель 1989 г.). «Состояние фторидов в зубных пастах». Журнал стоматологии . 17 (2): 47–54. дои : 10.1016/0300-5712(89)90129-2 . ПМИД 2732364 .
- ^ Перлич, Массачусетс; Бакка, Луизиана; Боллмер, Б.В.; Лансалако, AC; МакКланахан, Сан-Франциско; Севак, ЛК; Бейсвангер, Б.Б.; Эйхольд, Вашингтон; Халл, младший; и др. (1995). «Клиническое влияние стабилизированного средства для ухода за зубами на основе фторида олова на образование зубного налета, гингивит и кровотечение десен: шестимесячное исследование». Журнал клинической стоматологии . 6 (Специальный выпуск): 54–58. ПМИД 8593194 .
- ^ Версолато, Оскар О. (2019). «Физика лазерных оловянно-плазменных источников ЭУФ-излучения для нанолитографии». Плазменные источники Наука и техника . 28 (8). дои : 10.1088/1361-6595/ab3302 .
- ^ Эбдон, Л.; Великобритания), Королевское химическое общество (Великое (2001). «Оловоорганические соединения в промышленных и бытовых продуктах» . Видообразование микроэлементов для окружающей среды, продуктов питания и здоровья . Королевское химическое общество. стр. 144. ISBN 978-0-85404-459-7 . Архивировано из оригинала 21 мая 2016 г.
- ^ Jump up to: а б с д Аткинс, Питер; Шрайвер, Дювард Ф.; Овертон, Тина и Рурк, Джонатан (2006). Неорганическая химия (4-е изд.). У. Х. Фриман. стр. 343, 345. ISBN. 978-0-7167-4878-6 .
- ^ Уилкс, Чарльз Э.; Саммерс, Джеймс В.; Дэниэлс, Чарльз Энтони; Берард, Марк Т. (август 2005 г.). Руководство по ПВХ . Хансер. п. 108. ИСБН 978-1-56990-379-7 . Архивировано из оригинала 9 мая 2016 г.
- ^ Давид Н.-С. Достопочтенный; Нобуо Сираиси, ред. (2001). «Сохранение древесины» . Химия древесины и целлюлозы . Нью-Йорк, штат Нью-Йорк: Деккер. п. 799. ИСБН 978-0-8247-0024-9 .
- ^ Антизар-Ладислао, Бланка (1 февраля 2008 г.). «Уровни окружающей среды, токсичность и воздействие на человека морской среды, загрязненной трибутилоловом (ТБТ). Обзор». Интернационал окружающей среды . 34 (2): 292–308. Бибкод : 2008EnInt..34..292A . дои : 10.1016/j.envint.2007.09.005 . ПМИД 17959247 .
- ^ Эйслер, Рональд. «Опасность олова для рыб, дикой природы и беспозвоночных: обзорный обзор» (PDF) . Центр исследований дикой природы Службы рыболовства и дикой природы США в Патаксенте. Архивировано (PDF) из оригинала 18 января 2012 г.
- ^ «Регламент (ЕС) № 782/2003 Европейского парламента и Совета от 14 апреля 2003 г. о запрете оловоорганических соединений на судах» . europa.eu . Проверено 5 мая 2009 г.
- ^ Дюрр, Симона; Томасон, Джереми, ред. (2008). «Нарушение правил доставки» . Биологическое обрастание . Оксфорд: Блэквелл. п. 227. ИСБН 978-1-4051-6926-4 .
- ^ Jump up to: а б Магуайр, Р. Джеймс (1987). «Экологические аспекты трибутилолова». Прикладная металлоорганическая химия . 1 (6): 475–498. дои : 10.1002/aoc.590010602 .
- ^ де Мора, SJ; Стюарт, К.; Филлипс, Д. (1 января 1995 г.). «Источники и скорость разложения три(н-бутил)олова в морских отложениях возле Окленда, Новая Зеландия». Бюллетень о загрязнении морской среды . 30 (1): 50–57. Бибкод : 1995МарПБ..30...50Д . дои : 10.1016/0025-326X(94)00178-C .
- ^ Jump up to: а б Аксиак, Виктор; Микаллеф, Диана; Маскат, Джоан; Велла, Альфред; Минтофф, Бернардетт (1 марта 2003 г.). «Imposex как инструмент биомониторинга загрязнения морской среды трибутилоловом: некоторые дальнейшие наблюдения». Интернационал окружающей среды . Secotox SI 28 (8): 743–749. Бибкод : 2003EnInt..28..743A . дои : 10.1016/S0160-4120(02)00119-8 . ПМИД 12605923 .
- ^ Jump up to: а б с «Воздействие трибутилолова на морскую среду» . НаукаБазз . 17 ноября 2018 г. Архивировано из оригинала 25 января 2021 г. Проверено 17 ноября 2020 г.
- ^ Фарина, Витторио; Кришнамурти, Венкат; Скотт, Уильям Дж. (1997). «Реакция Стилле». Органические реакции . стр. 1–652. дои : 10.1002/0471264180.или050.01 . ISBN 0-471-26418-0 .
- ^ Моу, Хаойи; Сяо, Вэй; Мяо, Чанг; Ли, Руи; Ю, Известкование (2020). «Олово и материалы на основе олова в качестве анодов в литий-ионных и натрий-ионных батареях: обзор» . Границы в химии . 8 : 141. Бибкод : 2020FrCh....8..141M . дои : 10.3389/fchem.2020.00141 . ПМК 7096543 . ПМИД 32266205 .
- ^ Лукас, Иван; Сыздек, Ярослав (2011). «Межфазные процессы на монокристаллических β-Sn-электродах в органокарбонатных электролитах». Электрохимические коммуникации . 13 (11): 1271. doi : 10.1016/j.elecom.2011.08.026 .
- ^ «Карманный справочник NIOSH по химическим опасностям - олово» . CDC . Архивировано из оригинала 25 ноября 2015 г. Проверено 24 ноября 2015 г.
Библиография
[ редактировать ] В эту статью включен текст из источника, находящегося в свободном доступе : Карлин, Джеймс Ф., младший (1998). «Значительные события, повлиявшие на цены на олово с 1958 года» . Национальная геодезическая служба США
В эту статью включен текст из источника, находящегося в свободном доступе : Карлин, Джеймс Ф., младший (1998). «Значительные события, повлиявшие на цены на олово с 1958 года» . Национальная геодезическая служба США - Лиде, Дэвид Р., изд. (2006). Справочник по химии и физике (87-е изд.). Бока-Ратон, Флорида: CRC Press, Taylor & Francisco Group. ISBN 978-0-8493-0487-3 .
- Эмсли, Джон (2001). «Жесть» . Строительные блоки природы: Путеводитель по элементам от А до Я. Оксфорд, Англия, Великобритания: Издательство Оксфордского университета. стр. 445–450 . ISBN 978-0-19-850340-8 .
- Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- Хейзерман, Дэвид Л. (1992). «Элемент 50: Олово» . Изучение химических элементов и их соединений . Нью-Йорк: TAB Books. ISBN 978-0-8306-3018-9 .
- Макинтош, Роберт М. (1968). «Жесть». В Клиффорде А. Хэмпеле (ред.). Энциклопедия химических элементов . Нью-Йорк: Книжная корпорация Рейнхолда. стр. 722–732. LCCN 68-29938 .
- Ствертка, Альберт (1998). «Жесть» . Путеводитель по элементам (пересмотренная ред.). Издательство Оксфордского университета. ISBN 978-0-19-508083-4 .
Внешние ссылки
[ редактировать ]- Тин из Периодической таблицы видео (Ноттингемский университет)
- Деревянная таблица Менделеева Теодора Грея : Образцы олова и отливки
- Недрагоценные металлы: Олово
- CDC - Карманный справочник NIOSH по химическим опасностям
- Олово (центов США за кг)


