Оловоорганическая химия

Оловоорганическая химия — это научное исследование синтеза и свойств оловоорганических соединений или станнанов , которые представляют собой металлоорганические соединения, содержащие связи олово - углерод . Первым оловоорганическим соединением был дииодид диэтилолова ( (CH 3 CH 2 ) 2 SnI 2 ), открытый Эдвардом Франклендом в 1849 году. [1] Эта территория быстро росла в 1900-х годах, особенно после открытия реагентов Гриньяра , которые полезны для производства связей Sn-C. Этот район по-прежнему богат множеством применений в промышленности и продолжающейся деятельностью исследовательских лабораторий. [2]
Структура
[ редактировать ]Оловоорганические соединения обычно классифицируются в зависимости от степени их окисления. Соединения олова (IV) гораздо более распространены и более полезны.
Органические производные олова(IV)
[ редактировать ]Тетраорганопроизводные всегда имеют тетраэдрическую форму. Соединения типа SnRR'R''R''' разделены на отдельные энантиомеры. [3]
Оловоорганические галогениды
[ редактировать ]Оловоорганические хлориды имеют формулу R 4− n SnCl n для значений n до 3. Также известны бромиды, иодиды и фториды, но они менее важны. Эти соединения известны для многих R-групп. Они всегда четырехгранные. Три- и дигалогениды образуют аддукты с хорошими основаниями Льюиса, такими как пиридин . Фториды имеют тенденцию связываться так, что дифторид диметилолова образует пластинчатые полимеры. Ди- и особенно три-оловоорганические галогениды, например хлорид трибутилолова , по токсичности приближаются к токсичности цианистого водорода . [4]
Оловоорганические гидриды
[ редактировать ]Оловоорганические гидриды имеют формулу R 4− n SnH n для значений n до 3. Родительский член этого ряда — останнан ( SnH 4 ), нестабильный бесцветный газ. Стабильность коррелирует с количеством органических заместителей. Гидрид трибутилолова используется в качестве источника гидридного радикала в некоторых органических реакциях.
Оловоорганические оксиды и гидроксиды
[ редактировать ]Оловоорганические оксиды и гидроксиды являются обычными продуктами гидролиза оловоорганических галогенидов. В отличие от соответствующих производных кремния и германия оксиды и гидроксиды олова часто приобретают структуры с пента- и даже гексакоординированными оловянными центрами, особенно диоргано- и моноорганопроизводные. Группа Сн IV −O-Sn IV называется станноксаном (который является оловянным аналогом эфиров ), а группа Сн IV −O−H также называют станнанолом (который является оловянным аналогом спиртов ). [5] Структурно простейшими из оксидов и гидроксидов являются производные триорганоолова. Коммерчески важным гидроксидом триорганоолова является акарицид цигексатин (также называемый Пликтран, гидроксид трициклогексилолова и трициклогексилстаннанол). С 6 Н 11 ) 3 SnOH . Такие триорганооловогидроксиды существуют в равновесии с дистанноксанами:
- 2 R 3 SnOH ⇌ R 3 SnOSnR 3 + H 2 O
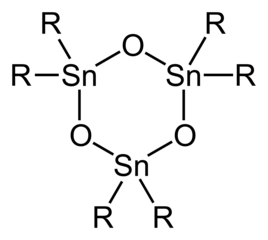
Диорганоловооксиды и гидроксиды имеют только два органических заместителя в каждом центре Sn и имеют более сложную структуру, чем триорганопроизводные. [6] Простые оловянные геминальные диолы ( R 2 Sn(OH) 2 , оловянные аналоги геминальных диолов. R 2 C(OH) 2 ) и мономерные станнаноны ( R 2 Sn=O , оловянные аналоги кетонов R 2 C=O ) неизвестны. Диорганоловооксиды ( R 2 SnO ) представляют собой полимеры, за исключением случаев, когда органические заместители очень объемные, в этом случае циклические тримеры или, в случае, когда R представляет собой CH(Si(CH 3 ) 3 ) 2 димеры , с Sn 3 O 3 и Sn 2 O 2 кольца. Дистанноксаны существуют в виде димеров с формулой [R 2 SnX] 2 O 2 где группы X (например, хлорид –Cl, гидроксид –OH, карбоксилат RCO 2 − ) может быть оконечным или мостовым (см. таблицу). Гидролиз оловоорганических тригалогенидов может привести к образованию станнановых кислот. RSnO 2 H . Что касается оловоорганических оксидов/гидроксидов, то оловоорганические формы образуют структурно сложные формы из-за возникновения дегидратации/гидратации, агрегации. Показательным является гидролиз трихлорида бутилолова с образованием [(CH 3 (CH 2 ) 3 Sn) 12 O 14 (OH) 6 ] 2+ .
-
Идеализированная структура тримерного оловоорганического оксида.
-
Шариковая модель для ( ((СН 3 ) 3 С) 2 SnO) 3 .
-
Структура оловоорганического оксида, подчеркивающая обширные межмолекулярные связи.
Гиперкоординированные станнаны
[ редактировать ]В отличие от аналогов углерода (IV), но в чем-то похожего на соединения кремния, олово (IV) также может быть координировано пятью и даже шестью атомами вместо обычных четырех. Эти гиперкоординированные соединения обычно имеют электроотрицательные заместители. Многочисленными примерами гиперкоординированных соединений являются оловоорганические оксиды и связанные с ними карбоксилаты и родственные производные псевдогалогенидов. [6] Оловоорганические галогениды для аддуктов, например (CH 3 ) 2 SnCl 2 ( бипиридин ).
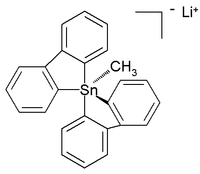
Были даже охарактеризованы цельноорганические пента- и гексаорганостаннаты(IV). [7] а в следующем году было сообщено о шестикоординированном тетраорганотиновом соединении. [8] Сообщалось о кристаллической структуре стабильного при комнатной температуре (в аргоне ) цельноуглеродного пентаорганостанната (IV) в виде соли лития с такой структурой: [9]
В этой искаженной тригонально-бипирамидальной структуре углерода с оловом длины связей (2,26 Å апикальная , 2,17 Å экваториальная) длиннее, чем обычные связи C-Sn (2,14 Å), что отражает ее гиперкоординированную природу.
Катионы триорганолова
[ редактировать ]Некоторые реакции галогенидов триорганоолова подразумевают роль Р 3 Сн + промежуточные звенья. Такие катионы аналогичны карбокатионам . Их кристаллографически охарактеризовали, когда органические заместители большие, например 2,4,6-триизопропилфенил. [10]
Радикалы олова (органические производные олова(III))
[ редактировать ]Радикалы олова с формулой R 3 Sn , называются станнильными радикалами . [2] Их используют в качестве промежуточных продуктов в некоторых реакциях переноса атома. Например, гидрид трибутилолова (трис( н -бутил)станнан) служит полезным источником «атомов водорода» из-за стабильности радикала трибутилолова. [11]
Органические производные олова(II)
[ редактировать ]Оловоорганические соединения (II) встречаются довольно редко. Соединения с эмпирической формулой SnR 2 несколько хрупки и существуют в виде колец или полимеров, когда R не является объемистым. Полимеры, называемые полистаннанами , имеют формулу (SnR 2 ) n .
В принципе, можно было бы ожидать, что соединения олова(II) образуют оловянные аналоги алкенов с формальной двойной связью между двумя атомами олова ( R 2 Sn=SnR 2 ) или между атомом олова и атомом углеродной группы (например, R 2 Sn=CR 2 и R 2 Sn=SiR 2 ). Действительно, соединения формулы R 2 Sn=SnR 2 , называемые дистанненами или дистанниленами , которые являются оловянными аналогами этилена. R 2 C=CR 2 , известны определенные органические заместители. Центры Sn в станненах тригональны. Но, в отличие от центров C в алкенах, которые являются тригонально-планарными , центры Sn в станненах имеют тенденцию иметь сильно пирамидальную форму . Мономерные соединения формулы SnR 2 , оловянные аналоги карбенов CR 2 также известны в некоторых случаях. Одним из примеров является Sn(SiR 3 ) 2 , где R – очень объемный СН(Si(СН 3 ) 3 ) 2 . Такие разновидности обратимо димеризуются до дистаннилена при кристаллизации: [12]
- 2 Р 2 Sn ⇌ Р 2 Sn=SnR 2
Станнены , соединения с двойными связями олово-углерод, представлены производными станнабензола . Станнолы , структурные аналоги циклопентадиена . , имеют небольшой характер двойной связи C-Sn
Органические производные олова(I)
[ редактировать ]Соединения Sn(I) редки и наблюдаются только с очень объемными лигандами. Доступ к одному известному семейству клеток достигается пиролизом 2,6-диэтилфенилзамещенного тристаннилена [Sn(C 6 H 3 -2,6-Et 2 ) 2 ] 3 , который дает кластер кубанового типа и призман . Эти клетки содержат Sn(I) и имеют формулу [Sn(C 6 H 3 -2,6-Et 2 )] n , где n = 8, 10 и Et означает этильную группу . [13] Станнин содержит атома олова с атомом углеродной группы тройную связь (например, R−Sn≡C−R и R−Sn≡Si−R ), а также дистаннинную тройную связь между двумя атомами олова ( R−Sn≡Sn−R ). Дистаннины существуют только для очень объемных заместителей. В отличие от алкинов , Ядро C−Sn≡Sn−C этих дистанинов нелинейно, хотя и плоско. Расстояние Sn-Sn составляет 3,066(1) Å, а углы Sn-Sn-C составляют 99,25(14)°. Такие соединения получают восстановлением объемистых галогенидов арилолова(II). [14]

Серые шарики: C
Пурпурные (самые большие) шарики: Sn
Структура Ar 10 Sn 10 «призман», соединение, содержащее Sn(I) (Ar = 2,6-диэтилфенил).
Подготовка
[ редактировать ]Оловоорганические соединения могут быть синтезированы многочисленными методами. [15] Классической является реакция реактива Гриньяра с галогенидами олова, например с тетрахлоридом олова . Примером может служить синтез тетраэтилолова: [16]
- 4 CH 3 CH 2 MgBr + SnCl 4 → (CH 3 CH 2 ) 4 Sn + 4 MgClBr
Симметричные тетраоловоорганические соединения, особенно тетраалкильные производные, затем можно превратить в различные смешанные хлориды посредством реакций перераспределения (также известных как «сопропорционирование Кочешкова» в случае оловоорганических соединений):
- 3 R 4 Sn + SnCl 4 → 4 R 3 SnCl
- R 4 Sn + SnCl 4 → 2 R 2 SnCl 2
- R 4 Sn + 3 SnCl 4 → 4 RSnCl 3
Близкий метод предполагает перераспределение галогенидов олова с алюминийорганическими соединениями .
Смешанные галоидорганические оловоорганические соединения можно превратить в смешанные органические производные, как показано на примере синтеза дибутилдивинилолова: [17]
- Bu 2 SnCl 2 + 2 CH 2 =CHMgBr → Bu 2 Sn(CH=CH 2 ) 2 + 2 MgBrCl
Оловоорганические гидриды получают восстановлением смешанных алкилхлоридов. Например, обработка дихлорида дибутилолова алюмогидридом лития дает дигидрид дибутилолова , бесцветное перегоняемое масло: [18]
- 2 Bu 2 SnCl 2 + Li[AlH 4 ] → 2 Bu 2 SnH 2 + Li[AlCl 4 ]
Вюрцевоподобное сочетание алкильных соединений натрия с галогенидами олова приводит к образованию оловоорганических соединений.
Гидростаннилирование включает катализируемое металлами присоединение гидридов олова к ненасыщенным субстратам. [19]
Реакции
[ редактировать ]Важные реакции, обсуждавшиеся выше, обычно сосредоточены на оловоорганических галогенидах и псевдогалогенидах с нуклеофилами . Все-алкилоловоорганические соединения обычно не гидролизуются , за исключением концентрированной кислоты ; главным исключением являются ацетилиды олова . [20] Станнанорганическое присоединение это нуклеофильное присоединение аллил- алленил- , — или пропаргилстаннанов к альдегидам и иминам . [ нужна ссылка ] тогда как гидростаннилирование удобно восстанавливает только неполяризованные кратные связи. [21]
В «чистом» органическом синтезе реакция Стилле считается ключевым методом сочетания . В реакции Стилле sp 2 -гибридизированные органические галогениды (например, винилхлорид CH 2 =CHCl ), катализируемый палладием :
- Р 1 −X + R 2 −Sn(R 3 ) 3 Р 1 −R 2 + X−Sn(R 3 ) 3
Оловоорганические соединения также широко используются в радикальной химии (например, радикальная циклизация , дезоксигенация Бартона-МакКомби , декарбоксилирование Бартона и т. д.).
Приложения
[ редактировать ]Оловоорганическое соединение коммерчески применяется в качестве стабилизаторов поливинилхлорида . В этом качестве они подавляют деградацию, удаляя аллилхлоридные группы. [ нужны разъяснения ] и путем поглощения хлористого водорода . Это приложение потребляет около 20 000 тонн олова каждый год. Основной класс оловоорганических соединений составляют оловоорганические дитиолаты с формулой R 2 Sn(SR') 2 . Связь Sn-S является реакционноспособным компонентом. Диорганоловокарбоксилаты, например дилаурат дибутилолова образования полиуретанов , вулканизации силиконов , применяются в качестве катализаторов и переэтерификации . [2]
Трихлорид н- бутилолова используется при производстве слоев диоксида олова на стеклянных бутылках методом химического осаждения из паровой фазы .
Биологические применения
[ редактировать ]« Трибутилоловы » используются в качестве промышленных биоцидов , например, в качестве противогрибковых средств в текстильной и бумажной промышленности, целлюлозно-бумажных фабриках, пивоварнях и промышленных системах охлаждения. Производные трифенилолова используются в качестве активных компонентов противогрибковых красок и сельскохозяйственных фунгицидов. Другие триорганоолова используются как митициды и акарициды . Оксид трибутилолова широко используется в качестве консерванта для древесины . [2]
Соединения трибутилолова когда-то широко использовались в качестве морских средств против биообрастания для повышения эффективности океанских судов. Опасения по поводу токсичности [22] Из этих соединений (в некоторых отчетах описывается биологическое воздействие на морскую жизнь в концентрации 1 нанограмм на литр) это привело к всемирному запрету Международной морской организации . В качестве противообрастающих соединений оловоорганические соединения были заменены дихлороктилизотиазолиноном . [23]
- Оловоорганические соединения
-
Бесцветное масло тетрабутилолова , предшественник других соединений бутилолова.
-
Оксид трибутилолова — жидкость от бесцветного до бледно-желтого цвета, используемая для консервации древесины.
-
Ацетат трифенилолова , не совсем белое кристаллическое твердое вещество, используемое в качестве инсектицида и фунгицида.
-
Хлорид трифенилолова , высокотоксичное белое твердое вещество, используемое в качестве биоцида.
-
Хлорид триметилолова , токсичное белое твердое вещество, когда-то использовавшееся в качестве биоцида.
-
Гидроксид трифенилолова , не совсем белый порошок, используемый в качестве фунгицида.
-
Азоциклотин длительного действия , белое твердое вещество, используемое в качестве акарицида для борьбы с паутинным клещом на растениях.
-
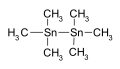
Гексаметилдитин, используемый в качестве промежуточного продукта в химическом синтезе.
-
Тетраэтилолово , температура кипения 63–65°/12 мм. [ нужны разъяснения ] является катализатором. [24] Символ «Et» означает этильную группу .
Токсичность
[ редактировать ]Токсичность производных трибутилолова и трифенилолова сравнима с токсичностью цианистого водорода . Кроме того, три -н -алкилолова фитотоксичны и поэтому не могут быть использованы в сельском хозяйстве. В зависимости от органических групп они могут быть мощными бактерицидами и фунгицидами . Из-за своей высокой биологической активности «трибутилтины» когда-то использовались в морской противообрастающей краске . [2]
В отличие от триоловоорганических соединений монооргано-, диоргано- и тетраоловоорганические соединения гораздо менее опасны. [4] хотя DBT может быть иммунотоксичным. [25]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Казери, Уолтер (2014). «Начальная оловоорганическая химия». Журнал металлоорганической химии . 751 : 20–24. дои : 10.1016/j.jorganchem.2013.08.009 .
- ^ Перейти обратно: а б с д и Дэвис, Элвин Джордж. (2004) Оловоорганическая химия, 2-е издание Вайнхайм: Wiley-VCH. ISBN 978-3-527-31023-4
- ^ Гилен, Марсель (1973). «От кинетики к синтезу хиральных тетраоловоорганических соединений». Акк. хим. Рез . 6 (6): 198–202. дои : 10.1021/ar50066a004 .
- ^ Перейти обратно: а б Г.Г. Граф (2005). «Олово, оловянные сплавы и соединения олова». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a27_049 . ISBN 978-3527306732 .
- ^ «Станнанол | H4OSn | ChemSpider» .
- ^ Перейти обратно: а б Чандрасекхар, Вадапалли; Нагендран, Сельвараджан; Баскар, Вишванатан (2002). «Оловоорганические сборки, содержащие связи Sn/O». Обзоры координационной химии . 235 : 1–52. дои : 10.1016/S0010-8545(02)00178-9 .
- ^ Райх, Ханс Дж.; Филлипс, Нэнси Х. (1986). «Реакции обмена литий-металлоид. Наблюдение комплексов пентаалкил лития / арил олова». Дж. Ам. хим. Соц. 108 (8): 2102–2103. дои : 10.1021/ja00268a067 .
- ^ В.Г. Кумар Дас; Ло Конг Мун; Чэнь Вэй; Томас К.В. Мак (1987). «Синтез, спектроскопическое исследование и рентгеновская кристаллическая структура бис[3-(2-пиридил)-2-тиенил-C,N]дифенилолова (IV): первый пример шестикоординированного тетраорганоолова». Металлоорганические соединения . 6 :10–14. дои : 10.1021/om00144a003 .
- ^ Масаичи Сайто; Санаэ Имаидзуми; Томоюки Тадзима; Казуя Ишимура и Сигэру Нагасе (2007). «Синтез и структура пентаорганостанната, имеющего пять углеродных заместителей». Дж. Ам. хим. Соц. 129 (36): 10974–10975. дои : 10.1021/ja072478+ . ПМИД 17705378 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Т.В. РаджанБабу, страница печатной платы Б.Р. Бакли «Три-н-бутилстаннан» в Энциклопедии реагентов для органического синтеза e-EROS, 2004. дои : 10.1002/047084289X.rt181.pub2
- ^ Холлеман, Арнольд Фредерик; Виберг, Эгон (2001), Виберг, Нильс (ред.), Неорганическая химия , перевод Иглсона, Мэри; Брюэр, Уильям, Сан-Диего/Берлин: Academic Press/De Gruyter, ISBN 0-12-352651-5
- ^ Сита, Лоуренс Р. (1994). «Органическая химия тяжелых металлов: строительство с оловом». Акк. хим. Рез . 27 (7): 191–197. дои : 10.1021/ar00043a002 .
- ^ Пауэр, Филип П. (2007). «Связывание и реакционная способность более тяжелых аналогов алкинов из 14 элементов группы». Металлоорганические соединения . 26 (18): 4362–4372. дои : 10.1021/om700365p .
- ^ Сандер Х.Л. Тунен; Берт-Ян Дилман; Жерар ван Котен (2004). «Синтетические аспекты тетраорганолова и оловоорганических галогенидов» (PDF) . Журнал металлоорганической химии (689): 2145–2157.
- ^ Дер Керк, GJM Ван; Луитен, JGA (1956). «Тетраэтилолово». Орг. Синтез . 36:86 и далее. дои : 10.15227/orgsyn.036.0086 .
- ^ Сейферт, Дитмар (1959). «Ди-н-бутилдивинилтин». Орг. Синтез . 39 : 10. дои : 10.15227/orgsyn.039.0010 .
- ^ «Металлоорганические синтезы: соединения непереходных металлов» Джон Айш, ред. Академическая пресса: Нью-Йорк, 1981. ISBN 0122349504 .
- ^ Смит, Николас Д.; Манкузо, Джон; Лаутенс, Марк (2000). «Гидростанации, катализируемые металлами». Химические обзоры . 100 (8): 3257–3282. дои : 10.1021/cr9902695 . ПМИД 11749320 .
- ^ Эйш 1981 , стр. 156, 169.
- ^ Эльшенбройх, Кристоф (2006) [2005]. Металлоорганические соединения . Перевод Оливейры, Хосе; Эльшенбройх, Кристоф (3-е изд.). Уайли. п. 310. ИСБН 978-3-527-29390-2 .
- ^ Гайда, М.; Янчо, А. (2010). «Оловоорганические соединения, образование, использование, видообразование и токсикология». Ионы металлов в науках о жизни . 7. Металлоорганические соединения в окружающей среде и токсикологии. Кембридж: Издательство RSC: 111–151. дои : 10.1039/9781849730822-00111 . ISBN 9781847551771 .
- ^ СИЛЬВА, Ваня; СИЛЬВА, Катя; СОАРЕС, Педро; ГАРРИДО, Э. Мануэла; БОРХЕС, Фернанда; Гарридо, Хорхе (2020). «Изотиазолиноновые биоциды: химические, биологические профили и профили токсичности» . Молекулы . 25 (4): 991. doi : 10,3390/molecules25040991 . ПМК 7070760 . ПМИД 32102175 .
- ^ Органические синтезы , Сб. Том. 4, с.881 (1963); Том. 36, с.86 (1956). Связь
- ^ С Гумий; и др. (2008). «Дибутилолово нарушает функцию глюкокортикоидных рецепторов и ухудшает вызванное глюкокортикоидами подавление выработки цитокинов» . ПЛОС ОДИН . 3 (10): е3545. Бибкод : 2008PLoSO...3.3545G . дои : 10.1371/journal.pone.0003545 . ПМЦ 2568824 . ПМИД 18958157 .










![Тетраэтилолово, температура кипения 63–65°/12 мм [необходимы пояснения] является катализатором.[24] Символ «Et» означает этильную группу.](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1e/Tetraethyltin.svg/120px-Tetraethyltin.svg.png)