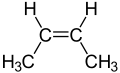
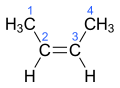Алкен

В органической химии алкен содержащий , или олефин , — это углеводород, двойную углерод - углеродную связь . [1] Двойная связь может быть внутренней или находиться в концевом положении. Терминальные алкены также известны как α-олефины .
Международный союз теоретической и прикладной химии (IUPAC) рекомендует использовать название «алкен» только для ациклических углеводородов всего с одной двойной связью; алкадиен , алкатриен и т. д. или полиен для ациклических углеводородов с двумя или более двойными связями; циклоалкен , циклоалкадиен и др. для циклических ; и «олефин» для общего класса – циклический или ациклический, с одной или несколькими двойными связями. [2] [3] [4]
Ациклические алкены только с одной двойной связью и без других функциональных групп (также известные как ) образуют гомологический ряд углеводородов моноены с общей формулой C n H 2 n , где n представляет собой натуральное число >1 (что на два атома водорода меньше, чем у соответствующего алкана ). Когда n равно четырем и более, возможны изомеры , отличающиеся положением и конформацией двойной связи.
Алкены обычно представляют собой бесцветные неполярные соединения, чем-то похожие на алканы, но более реакционноспособные. Первые несколько членов ряда представляют собой газы или жидкости при комнатной температуре. Простейший алкен этилен ( C 2 H 4 ) (или «этен» по номенклатуре ИЮПАК ) — органическое соединение, производимое в крупнейших промышленных масштабах. [5]
Ароматические соединения часто называют циклическими алкенами, однако их структура и свойства достаточно различны, поэтому их нельзя отнести к алкенам или олефинам. [3] Углеводороды с двумя перекрывающимися двойными связями ( C=C=C ) называются алленами (самое простое такое соединение само называется алленом ) и соединения с тремя или более перекрывающимися связями ( С=С=С=С , C=C=C=C=C и т. д.) называются кумуленами .
Структурная изомерия [ править ]
Алкены, имеющие четыре и более атомов углерода , могут образовывать разнообразные структурные изомеры . Большинство алкенов также являются изомерами циклоалканов . Ниже следуют структурные изомеры ациклических алкенов только с одной двойной связью: [6]
- C 2 H 4 : этилен только
- C 3 H 6 : пропилен только
- C 4 H 8 : 3 изомера: 1-бутен , 2-бутен и изобутилен.
- C 5 H 10 :5 изомеров: 1-пентен , 2-пентен, 2-метил-1-бутен, 3-метил-1-бутен, 2-метил-2-бутен.
- C 6 H 12 :13 изомеров: 1-гексен, 2-гексен, 3-гексен, 2-метил-1-пентен, 3-метил-1-пентен, 4-метил-1-пентен, 2-метил-2- пентен, 3-метил-2-пентен, 4-метил-2-пентен, 2,3-диметил-1-бутен, 3,3-диметил-1-бутен, 2,3-диметил-2-бутен, 2- этил-1-бутен
Многие из этих молекул обладают цис - транс -изомерией . Могут также существовать хиральные атомы углерода, особенно внутри более крупных молекул (от С 5 ). Число потенциальных изомеров быстро увеличивается с появлением дополнительных атомов углерода.
Структура и связь [ править ]
Связывание [ править ]

Двойная связь углерод-углерод состоит из сигма-связи и пи-связи . Эта двойная связь прочнее одинарной ковалентной связи (611 кДж / моль для C=C против 347 кДж/моль для C–C), [1] но не в два раза сильнее. Двойные связи короче одинарных, их средняя длина связи составляет 1,33 Å (133 pm ) против 1,53 Å для типичной одинарной связи CC. [7]
Каждый атом углерода двойной связи использует свои три sp. 2 гибридные орбитали образуют сигма-связи с тремя атомами (другим атомом углерода и двумя атомами водорода). Негибридизованные 2p-атомные орбитали, лежащие перпендикулярно плоскости, образованной осями трех sp. 2 гибридные орбитали объединяются, образуя пи-связь. Эта связь лежит за пределами главной оси C–C, причем половина связи находится на одной стороне молекулы, а половина — на другой. При силе 65 ккал/моль пи-связь значительно слабее сигма-связи.
Вращение вокруг двойной связи углерод-углерод ограничено, поскольку нарушение выравнивания p-орбиталей двух атомов углерода требует энергетических затрат. Следовательно, цис- или транс- изомеры взаимопревращаются настолько медленно, что с ними можно свободно обращаться в условиях окружающей среды без изомеризации. Более сложные алкены можно называть буквами – Z для E молекул с тремя или четырьмя различными заместителями (боковыми группами). Например, из изомеров бутена две метильные группы ( Z )-бут-2 -ена (он же цис -2-бутен) располагаются по одну сторону двойной связи, а в ( Е )-бут-2 -ен (он же транс -2-бутен) метильные группы располагаются на противоположных сторонах. Эти два изомера бутена имеют разные свойства.
Форма [ править ]
Как предсказывает пар VSEPR модель отталкивания электронных , молекулярная геометрия алкенов включает валентные углы вокруг каждого атома углерода в двойной связи около 120 °. Угол может меняться из-за стерической деформации, вызванной несвязанными взаимодействиями между функциональными группами, присоединенными к атомам углерода двойной связи. Например, валентный угол C–C–C в пропилене составляет 123,9°.
Для алкенов с мостиковой связью правило Бредта гласит, что двойная связь не может возникнуть на плацдарме мостиковой кольцевой системы, если кольца не достаточно велики. [8] Следуя Фосетту и определяя S как общее количество атомов, не являющихся мостиками в кольцах, [9] бициклические системы требуют S ≥ 7 для устойчивости [8] а трициклические системы требуют S ≥ 11. [10]
Изомерия [ править ]
В органической химии префиксы , цис- и транс- используются для описания положений функциональных групп, присоединенных к атомам углерода соединенным двойной связью. На латыни цис и транс означают «по эту сторону» и «по ту сторону» соответственно. Следовательно, если обе функциональные группы находятся на одной стороне углеродной цепи, говорят, что связь имеет цис- конфигурацию, в противном случае (т. е. функциональные группы находятся на противоположной стороне углеродной цепи) говорят, что связь имеет цис-конфигурацию. трансконфигурация .
- структура цис-2-бутена
- структура транс-2-бутена
- ( Е )-Бут-2-ен
- ( Z )-Бут-2-ен
Для существования цис- и транс-конфигураций должна существовать углеродная цепь или хотя бы одна функциональная группа, присоединенная к каждому углероду, одинакова для обоих. Вместо этого можно использовать E- и Z-конфигурацию в более общем случае, когда все четыре функциональные группы, присоединенные к атомам углерода в двойной связи, различны. E- и Z- являются аббревиатурами немецких слов zusammen (вместе) и entgegen (противоположно). При E- и Z-изомерии каждой функциональной группе назначается приоритет на основе правил приоритета Кана-Ингольда-Прелога . Если две группы с более высоким приоритетом находятся на одной стороне двойной связи, связи присваивается Z- конфигурация, в противном случае (т.е. две группы с более высоким приоритетом находятся на противоположной стороне двойной связи) связи присваивается E. - конфигурация. Цис- и транс-конфигурации не имеют фиксированной связи с E- и Z -конфигурациями.
Физические свойства [ править ]
Многие физические свойства алкенов и алканов схожи: они бесцветны, неполярны и горючи. Физическое состояние зависит от молекулярной массы : подобно соответствующим предельным углеводородам, простейшие алкены ( этилен , пропилен и бутен ) при комнатной температуре представляют собой газы. Линейные алкены, содержащие примерно от пяти до шестнадцати атомов углерода, представляют собой жидкости, а высшие алкены представляют собой воскообразные твердые вещества. Температура плавления твердых веществ также увеличивается с увеличением молекулярной массы.
Алкены обычно имеют более сильный запах, чем соответствующие им алканы. Этилен имеет сладкий и затхлый запах. Известно , что напряженные алкены, в частности такие, как норборнен и транс -циклооктен, имеют сильный неприятный запах, что согласуется с более сильными π-комплексами, которые они образуют с ионами металлов, включая медь. [11]
Точки кипения и плавления [ править ]
Ниже приведен список температур кипения и плавления различных алкенов с соответствующими аналогами алканов и алкинов. [12] [13]
| Количество углероды | Алкан | Алкен | Алкин | |
|---|---|---|---|---|
| 2 | Имя | этан | этилен | ацетилен |
| Температура плавления | −183 | −169 | −80.7 | |
| Точка кипения | −89 | −104 | −84.7 | |
| 3 | Имя | пропан | пропилен | пропин |
| Температура плавления | −190 | −185 | −102.7 | |
| Точка кипения | −42 | −47 | −23.2 | |
| 4 | Имя | бутан | 1-бутен | 1-бутин |
| Температура плавления | −138 | −185.3 | −125.7 | |
| Точка кипения | −0.5 | −6.2 | 8.0 | |
| 5 | Имя | пентан | 1-пентен | 1-пентин |
| Температура плавления | −130 | −165.2 | −90.0 | |
| Точка кипения | 36 | 29.9 | 40.1 |
Инфракрасная спектроскопия [ править ]
Растяжение связи C=C даст пик ИК- поглощения при 1670–1600 см- 1. −1 , а изгиб связи C=C поглощает от 1000 до 650 см −1 длина волны.
ЯМР-спектроскопия [ править ]
В 1 H ЯМР Спектроскопия показывает, что водород, дает δ H 4,5–6,5 м.д. связанный с углеродом, прилегающим к двойным связям , Двойная связь также снимает экранирование с водорода, присоединенного к атомам углерода, соседним с sp. 2 углерода, что приводит к образованию δ H =1,6–2. пики ppm. [14] Цис/транс-изомеры различаются благодаря различному эффекту J-сочетания . Цисвицинальные , водороды будут иметь константы связи в диапазоне 6–14 Гц тогда как транс будут иметь константы связи 11–18 Гц. [15]
В их 13 В спектрах ЯМР 3С алкенов двойные связи также экранируют атомы углерода, что приводит к малому сдвигу поля. Двойные связи C=C обычно имеют химический сдвиг около 100–170 м.д. [15]
Горение [ править ]
Как и большинство других углеводородов , алкены сгорают с образованием углекислого газа и воды.
При горении алкенов выделяется меньше энергии, чем при горении той же молярности насыщенных алкенов с тем же количеством атомов углерода. Эту тенденцию хорошо видно в списке стандартных энтальпий сгорания углеводородов. [16]
| Количество углероды | Вещество | Тип | Формула | Ч с ø (кДж/моль) |
|---|---|---|---|---|
| 2 | этан | насыщенный | С 2 Ч 6 | −1559.7 |
| этилен | ненасыщенный | С 2 Ч 4 | −1410.8 | |
| ацетилен | ненасыщенный | С 2 Ч 2 | −1300.8 | |
| 3 | пропан | насыщенный | СН3 СН2 2CHСН3 | −2219.2 |
| пропен | ненасыщенный | СН 3 СН=СН 2 | −2058.1 | |
| пропин | ненасыщенный | CH 3 C≡CH | −1938.7 | |
| 4 | бутан | насыщенный | СН3 СН2 2 СН2 2CHСН3 | −2876.5 |
| 1-бутен | ненасыщенный | СН 2 =СН-СН 2 СН 3 | −2716.8 | |
| 1-бутин | ненасыщенный | СН≡С-СН 2 СН 3 | −2596.6 |
Реакция [ править ]
Алкены — относительно стабильные соединения, но более реакционноспособны, чем алканы . Большинство реакций алкенов включают присоединение к этой пи-связи, образуя новые одинарные связи . Алкены служат сырьем для нефтехимической промышленности , поскольку они могут участвовать в самых разных реакциях, в первую очередь в полимеризации и алкилировании. За исключением этилена, алкены имеют два центра реакционной способности: пи-связь углерод-углерод и наличие аллильных центров CH. Первый доминирует, но аллильные сайты также важны.
Добавление к ненасыщенным связям [ править ]
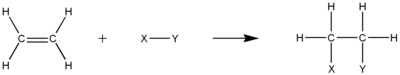
Гидрирование включает добавление H 2 , в результате чего образуется алкан. Уравнение гидрирования этилена с образованием этана :
- H 2 C=CH 2 + H 2 →H 3 C−CH 3
Реакции гидрирования обычно требуют катализаторов для увеличения скорости реакции . Общее количество атомов водорода, которое можно присоединить к ненасыщенному углеводороду, зависит от степени его ненасыщенности .
Подобно водороду, галогены присоединяются к двойным связям.
- H 2 C=CH 2 + Br 2 →H 2 CBr−CH 2 Br
Ионы галония являются промежуточными продуктами. Эти реакции не требуют катализаторов.

Бромный тест используется для проверки насыщенности углеводородов. [17] Бромный тест также можно использовать для определения степени ненасыщенности ненасыщенных углеводородов. Бромное число определяется как грамм брома, способного вступить в реакцию со 100 г продукта. [18] Как и гидрирование, галогенирование брома также зависит от количества π-связей. Более высокое бромное число указывает на более высокую степень ненасыщенности.
π-связи алкеновых углеводородов также подвержены гидратации . В реакции обычно используется сильная кислота в качестве катализатора . [19] Первый этап гидратации часто включает образование карбокатиона . Конечным результатом реакции будет спирт . Уравнение реакции гидратации этилена:
- H 2 C=CH 2 + H 2 O→ H 3 C-CH 2 OH

Гидрогалогенирование включает присоединение H-X к ненасыщенным углеводородам. Эта реакция приводит к образованию новых σ-связей C-H и C-X. Образование промежуточного карбокатиона является избирательным и подчиняется правилу Марковникова . Гидрогалогенирование алкена приводит к образованию галогеналкана . Уравнение реакции присоединения HBr к этилену:
- H 2 C=CH 2 + HBr → H 3 C−CH 2 Br
Циклоприсоединение [ править ]
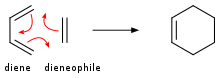
![Генерация синглетного кислорода и его [4+2]-циклоприсоединение с циклопентадиеном.](http://upload.wikimedia.org/wikipedia/commons/thumb/1/12/4%2B2_cycloaddition_cyclopentadiene_O2.svg/350px-4%2B2_cycloaddition_cyclopentadiene_O2.svg.png)
Алкены присоединяются к диенам, образуя циклогексены . Это превращение является примером реакции Дильса-Альдера . Такая реакция протекает с сохранением стереохимии. Скорости чувствительны к электроноакцепторным или электронодонорным заместителям. Под воздействием УФ-излучения алкены димеризуются с образованием циклобутанов . [20] Другим примером является реакция Шенкена , в которой синглетный кислород реагирует с аллильной структурой с образованием транспонированного аллилпероксида :
Окисление [ править ]
Алкены реагируют с перкарбоновыми кислотами и даже перекисью водорода с образованием эпоксидов :
- RCH=CH 2 + RCO 3 H → RCHOCH 2 + RCO 2 H
этилена Эпоксидирование проводится в промышленных масштабах с использованием кислорода в присутствии катализаторов на основе серебра:
- С 2 Н 4 + 1/ 2 О 2 → С 2 Н 4 О
Алкены реагируют с озоном, приводя к разрыву двойной связи. Этот процесс называется озонолизом . Часто в процедуру реакции входит мягкий восстановитель, например диметилсульфид ( СМе 2 ):
- RCH=CHR' + O 3 + SMe 2 → RCHO + R'CHO + O=SMe 2
- R 2 C=CHR' + O 3 → R 2 CHO + R'CHO + O=SME 2
При обработке горячим концентрированным подкисленным раствором KMnO 4 , алкены расщепляются с образованием кетонов и/или карбоновых кислот . Стехиометрия реакции чувствительна к условиям. Эту реакцию и озонолиз можно использовать для определения положения двойной связи в неизвестном алкене.
Окисление можно остановить на вицинальном диоле, а не на полном расщеплении алкена, используя тетраоксид осмия или другие окислители:
Эта реакция называется дигидроксилированием .
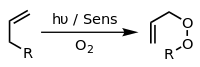
В присутствии соответствующего фотосенсибилизатора , такого как метиленовый синий , и света алкены могут вступать в реакцию с активными формами кислорода, генерируемыми фотосенсибилизатором, такими как гидроксильные радикалы , синглетный кислород или супероксид -ион. Реакции возбужденного сенсибилизатора могут включать перенос электрона или водорода, обычно с восстанавливающим субстратом (реакция типа I) или взаимодействие с кислородом (реакция типа II). [21] Эти различные альтернативные процессы и реакции можно контролировать путем выбора конкретных условий реакции, что приводит к получению широкого спектра продуктов. Типичным примером является [4+2] -циклоприсоединение синглетного кислорода к диену, такому как циклопентадиен, с образованием эндопероксида :
Полимеризация [ править ]
Терминальные алкены являются предшественниками полимеров посредством процессов, называемых полимеризацией . Некоторые полимеризации имеют большое экономическое значение, поскольку в результате них получаются полиэтилен и полипропилен . Полимеры алкенов обычно называют полиолефинами, хотя они не содержат олефинов. Полимеризация может протекать по разным механизмам. Сопряженные диены, такие как бута-1,3-диен и изопрен (2-метилбута-1,3-диен), также производят полимеры, одним из примеров является натуральный каучук.
Аллильная замена [ править ]
Наличие π-связи C=C в ненасыщенных углеводородах ослабляет энергию диссоциации аллильных связей C–H. Таким образом, эти группировки подвержены свободнорадикальному замещению в этих сайтах CH, а также реакциям присоединения в сайте C=C. В присутствии радикальных инициаторов аллильные связи CH могут галогенироваться. [22] Наличие двух связей C=C, фланкирующих один метилен, т.е. дважды аллильных, приводит к особенно слабым связям HC-H. Высокая реакционная способность этих ситуаций лежит в основе некоторых свободнорадикальных реакций, проявляющихся в химии олиф .
Метатезис [ править ]
Алкены подвергаются метатезису олефинов , который расщепляет и заменяет заместители алкена. Родственной реакцией является этинолиз : [23]
Комплексообразование металлов [ править ]


Структура бис(циклооктадиен)никеля(0) , металлоалкенового комплекса.
В алкеновых комплексах переходных металлов алкены служат лигандами металлов. [24] В этом случае плотность π-электронов передается [ нужны разъяснения ] к металлическим d-орбиталям. Чем сильнее донорство, тем сильнее обратная связь между d-орбиталью металла и разрыхляющей π*-орбиталью алкена. Этот эффект снижает порядок связи алкена и увеличивает длину связи CC . Одним из примеров является комплекс PtCl 3 (C 2 H 4 )] − . Эти комплексы связаны с механизмами катализируемых металлами реакций ненасыщенных углеводородов. [23]
Обзор реакции [ править ]
| Название реакции | Продукт | Комментарий |
|---|---|---|
| гидрирование | алканы | добавление водорода |
| Гидроалкенилирование | алкены | гидрометаллирование/введение/бета-элиминирование металлическим катализатором |
| Реакция присоединения галогена | 1,2-дигалогениды | электрофильное присоединение галогенов |
| Гидрогалогенирование ( Марковников ) | галоалканы | добавление галоидоводородных кислот |
| Антимарковниковское гидрогалогенирование | галоалканы | присоединение галоидоводородных кислот, опосредованное свободными радикалами |
| Гидроаминирование | амины | добавление N-H поперек Связь C-C Двойная связь |
| Гидроформилирование | альдегиды | промышленный процесс, добавление CO и Ч 2 |
| Гидрокарбоксилирование и реакция Коха | карбоновая кислота | промышленный процесс, добавление CO и Н 2 О. |
| Карбоалкоксилирование | эфир | промышленный процесс, добавление CO и спирта. |
| алкилирование | эфир | Промышленный процесс: алкилирование карбоновой кислоты алкеном с помощью кремневольфрамовой кислоты в качестве катализатора. |
| Бисгидроксилирование Шарплесса | диолы | окисление, реактив: тетраоксид осмия, хиральный лиганд |
| Вудворда Цис -гидроксилирование | диолы | окисление, реагенты: йод, ацетат серебра |
| Озонолиз | альдегиды или кетоны | реагент: озон |
| Метатезис олефинов | алкены | два алкена перегруппировываются с образованием двух новых алкенов |
| Реакция Дильса-Альдера | циклогексены | циклоприсоединение с диеном |
| Реакция Паусона-Ханда | циклопентеноны | циклоприсоединение с алкином и CO |
| Гидроборирование-окисление | спирты | реагенты: боран, затем перекись |
| Оксимеркурация-восстановление | спирты | электрофильное присоединение ацетата ртути с последующим восстановлением |
| Реакция Принса | 1,3-диолы | электрофильное присоединение с альдегидом или кетоном |
| Реакция Патерно – Бючи | оксетаны | фотохимическая реакция с альдегидом или кетоном |
| Эпоксидирование | эпоксид | электрофильное присоединение перекиси |
| Циклоппропанация | циклопропаны | добавление карбенов или карбеноидов |
| Гидроацилирование | кетоны | окислительное присоединение/восстановительное отщепление с помощью металлического катализатора |
| Гидрофосфинирование | фосфины |
Синтез [ править ]
Промышленные методы [ править ]
Алкены получают путем крекинга углеводородов . Сырьем в основном являются компоненты конденсата природного газа (в основном этан и пропан) в США и на Ближнем Востоке, а также нафта в Европе и Азии. Алканы расщепляются при высоких температурах, часто в присутствии цеолитного катализатора, с образованием смеси преимущественно алифатических алкенов и алканов с более низкой молекулярной массой. Смесь зависит от сырья и температуры и разделяется фракционной перегонкой. В основном это используется для производства небольших алкенов (до шести атомов углерода). [25]

С этим связано каталитическое дегидрирование , при котором алкан теряет водород при высоких температурах с образованием соответствующего алкена. [1] Это процесс, обратный каталитическому гидрированию алкенов.

Этот процесс также известен как реформирование . Оба процесса являются эндотермическими и при высоких температурах движутся к алкену за счет энтропии .
Каталитический синтез высших α-алкенов (типа RCH=CH 2 ) может быть осуществлен также реакцией этилена с металлоорганическим соединением триэтилалюминием в присутствии никеля , кобальта или платины .
Реакции элиминации [ править ]
Одним из основных методов синтеза алкенов в лаборатории является реакция отщепления алкилгалогенидов, спиртов и подобных соединений. Наиболее распространенным является β-элиминирование по механизму E2 или E1. [26] Коммерчески значимым примером является производство винилхлорида .
Механизм E2 обеспечивает более надежный метод β-элиминирования, чем E1, для большинства синтезов алкенов. Большинство элиминаций E2 начинаются с сложного эфира алкилгалогенида или алкилсульфоната (например, тозилата или трифлата ). Когда используется алкилгалогенид, реакция называется дегидрогалогенированием . Для несимметричных продуктов более замещенные алкены (с меньшим количеством атомов водорода, присоединенных к C=C) имеют тенденцию преобладать (см. правило Зайцева ). Двумя распространенными методами реакций элиминирования являются дегидрогалогенирование алкилгалогенидов и дегидратация спиртов. Типичный пример показан ниже; обратите внимание, что, если возможно, H направлен против уходящей группы, даже если это приводит к менее стабильному Z -изомеру. [27]
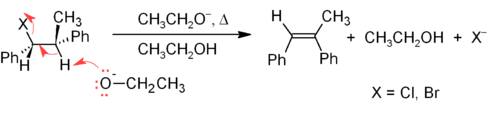
Алкены могут быть синтезированы из спиртов путем дегидратации , в этом случае вода теряется по механизму E1. Например, при дегидратации этанола образуется этилен:
- СН 3 СН 2 ОН → Н 2 С=СН 2 + Н 2 О
Спирт также может быть преобразован в более уходящую группу (например, ксантогенат ), чтобы обеспечить более мягкое синэлиминирование , такое как элиминирование Чугаева и элиминирование Гриеко . Связанные реакции включают элиминирование с помощью β-галогенэфиров ( синтез олефинов по Борду ) и сложных эфиров ( пиролиз сложных эфиров ). Тетраиодид дифосфора дезоксигенирует гликоли до алкенов.
Алкены можно получить косвенным путем из алкиламинов . Амин или аммиак не являются подходящей уходящей группой, поэтому амин сначала либо алкилируют (как при отщеплении Хофмана ), либо окисляют до оксида амина ( реакция Коупа ), чтобы сделать возможным плавное отщепление. Реакция Коупа представляет собой синэлиминирование , которое происходит при температуре 150 °C или ниже, например: [28]

Элиминирование Хофмана необычно тем, что менее замещенный ( незайцевский основным продуктом обычно является ) алкен.
Алкены образуются из α-галогенсульфонов в реакции Рамберга-Беклунда через трехчленное кольцевое сульфоновое промежуточное соединение.
Синтез из карбонильных соединений [ править ]
Другой важный класс методов синтеза алкенов включает создание новой двойной связи углерод-углерод путем сочетания или конденсации карбонильного соединения (такого как альдегид или кетон ) с карбанионом или его эквивалентом. Преобладающую роль играет альдольная конденсация . Конденсации Кневенагеля представляют собой родственный класс реакций, которые превращают карбонилы в алкены. Хорошо известные методы называются олефинациями . Реакция Виттига является показательной, но известны и другие родственные методы, включая реакцию Хорнера-Уодсворта-Эммонса .
Реакция Виттига включает реакцию альдегида или кетона с реагентом Виттига (или фосфораном) типа Ph 3 P=CHR с образованием алкена и Ph 3 P=O . Реагент Виттига сам по себе легко получить из трифенилфосфина и алкилгалогенида. [29]

С реакцией Виттига связано олефинирование Петерсона , в котором вместо фосфорана используются реагенты на основе кремния. Эта реакция позволяет выделить E- или Z -продукты. Если E желателен -продукт, другой альтернативой является олефинирование по Юлию , в котором используется карбанион, образующийся фенилсульфона из . на Олефинирование Takai основе хроморганического промежуточного продукта также дает электронные продукты. Соединение титана, реактив Теббе , полезно для синтеза метиленовых соединений; в этом случае реагируют даже сложные эфиры и амиды.
Пара кетонов или альдегидов может быть дезоксигенирована с образованием алкена. Симметричные алкены можно получить из соединения одного альдегида или кетона с самим собой, используя титана восстановление металлического ( реакция Мак-Мерри ). Если необходимо соединить разные кетоны, требуется более сложный метод, например реакция Бартона-Келлога .
Одиночный кетон также можно превратить в соответствующий алкен через его тозилгидразон с использованием метоксида натрия ( реакция Бэмфорда-Стивенса ) или алкиллития ( реакция Шапиро ).
Синтез из алкенов [ править ]
Образование более длинных алкенов путем поэтапной полимеризации более мелких является привлекательным, поскольку этилен (самый маленький алкен) недорог и легко доступен, ежегодно производятся сотни миллионов тонн. Процесс Циглера-Натта позволяет образовывать очень длинные цепи, например, те, которые используются для полиэтилена . Там, где требуются более короткие цепи, например, для производства поверхностно-активных веществ процессы, включающие стадию метатезиса олефинов , такие как процесс получения высших олефинов Shell , важны .
Метатезис олефинов также используется в коммерческих целях для взаимного превращения этилена и 2-бутена в пропилен. рений- и молибденсодержащий гетерогенный катализ : В этом процессе используется [30]
- СН 2 =СН 2 + СН 3 СН=СНСН 3 → 2 СН 2 =СНСН 3
, катализируемое переходными металлами, Гидровинилирование является еще одним важным процессом синтеза алкенов, начиная с самого алкена. [31] Он включает присоединение водорода и винильной группы (или алкенильной группы) по двойной связи.
Из алкинов [ править ]
Восстановление алкинов - полезный метод стереоселективного синтеза дизамещенных алкенов. Если цис -алкен желателен, обычно используется гидрирование в присутствии катализатора Линдлара (гетерогенный катализатор, состоящий из палладия, нанесенного на карбонат кальция и обработанного различными формами свинца), хотя гидроборирование с последующим гидролизом обеспечивает альтернативный подход. Восстановление алкина металлическим натрием в жидком аммиаке дает транс -алкен. [32]
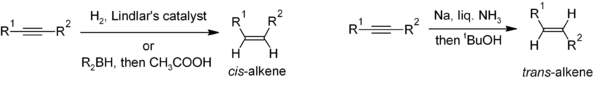
Для получения мультизамещенных алкенов карбометаллирование алкинов может привести к образованию большого количества производных алкенов.
[ править ]
Алкены могут быть синтезированы из других алкенов посредством реакций перегруппировки . Помимо метатезиса олефинов (описанного выше многие перициклические реакции ), можно использовать , такие как еновая реакция и перегруппировка Коупа .
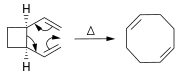
В реакции Дильса-Альдера получается производное циклогексена из диена и реакционноспособного или электронодефицитного алкена.
Приложение [ править ]
Ненасыщенные углеводороды широко используются для производства пластмасс, лекарств и других полезных материалов.
| Имя | Структура | Использовать |
|---|---|---|
| Этилен |  |
|
| 1,3-бутадиен |  |
|
| винилхлорид |
| |
| стирол |  |
|
Естественное явление [ править ]
Алкены широко распространены в природе.Растения являются основным природным источником алкенов в форме терпенов . [33] Многие из наиболее ярких природных пигментов являются терпенами; например, ликопин (красный в помидорах), каротин (оранжевый в моркови) и ксантофиллы (желтый в яичном желтке). Самый простой из всех алкенов, этилен является сигнальной молекулой , влияющей на созревание растений.
- Избранные ненасыщенные соединения в природе
- Лимонен , монотерпен .
- Гумулен , сесквитерпен .
Номенклатура ИЮПАК [ править ]
Хотя номенклатура не получила широкого распространения, согласно ИЮПАК, алкен представляет собой ациклический углеводород только с одной двойной связью между атомами углерода. [2] Олефины включают в себя большую коллекцию циклических и ациклических алкенов, а также диенов и полиенов. [3]
Чтобы сформировать корень названий IUPAC для алкенов с прямой цепью, измените инфикс -an- родительского элемента на -en- . Например, CH 3 -CH 3 представляет собой алкан этан . имя CH 2 =CH 2 Поэтому — ethENe .
Для алкенов с прямой цепью с 4 или более атомами углерода это название не полностью идентифицирует соединение. В этих случаях и для разветвленных ациклических алкенов применяются следующие правила:
- Найдите самую длинную углеродную цепь в молекуле. Если эта цепь не содержит двойной связи, назовите соединение в соответствии с правилами наименования алканов. В противном случае:
- Пронумеруйте атомы углерода в этой цепи, начиная с конца, ближайшего к двойной связи.
- Определим местоположение k двойной связи как номер ее первого атома углерода.
- Назовите боковые группы (кроме водорода) по соответствующим правилам.
- Определите положение каждой боковой группы как количество атомов углерода в цепи, к которым она присоединена.
- Напишите положение и название каждой боковой группы.
- Напишите названия алканов с той же цепочкой, заменив суффикс «-ан» на « к -ен».
Положение двойной связи часто указывается перед названием цепи (например, «2-пентен»), а не перед суффиксом («пент-2-ен»).
Позиции не обязательно указывать, если они уникальны. Обратите внимание, что двойная связь может подразумевать другую нумерацию цепей, чем та, которая используется для соответствующего алкана: (H
3С )
3 С– СН
2 – СН
3 представляет собой «2,2-диметилпентан», тогда как (H
3С )
3 С– СН = СН
2 представляет собой «3,3-диметил-1-пентен».
Более сложные правила применяются к полиенам и циклоалкенам . [4]

Цис - транс- изомерия [ править ]
Если двойная связь ациклического моноена не является первой связью цепи, построенное выше название все равно не полностью идентифицирует соединение из-за цис - транс -изомерии . Затем необходимо указать, находятся ли две одинарные связи C–C, прилегающие к двойной связи, по одну сторону ее плоскости или по разные стороны. Для моноалкенов конфигурация часто обозначается приставками цис – (от латинского «по эту сторону») или транс – («поперек», «по ту сторону») перед названием соответственно; как в цис -2-пентене или транс -2-бутене.

В более общем смысле, цис - транс -изомерия будет существовать, если к каждому из двух атомов углерода двойной связи присоединены два разных атома или группы. Учитывая эти случаи, ИЮПАК рекомендует более общее обозначение E – Z вместо префиксов цис и транс . Это обозначение учитывает группу с наивысшим приоритетом CIP в каждом из двух атомов углерода. Если эти две группы находятся на противоположных сторонах плоскости двойной связи, конфигурация обозначается буквой E (от немецкого entgegen, означающего «противоположный»); если они находятся на одной стороне, это обозначается буквой Z (от немецкого zusammen «вместе»). Эту маркировку можно преподавать с помощью мнемоники « Z означает 'он зе заме зиде'». [34]

Группы, содержащие двойные связи C=C [ править ]
ИЮПАК признает два названия углеводородных групп, содержащих двойные связи углерод-углерод: винильная группа и аллильная группа. [4]

См. также [ править ]
Номенклатурные ссылки [ править ]
- Правило А-3. Ненасыщенные соединения и одновалентные радикалы Синяя книга ИЮПАК .
- Правило А-4. Бивалентные и мультивалентные радикалы Синяя книга ИЮПАК.
- Правила А-11.3, А-11.4, А-11.5 Ненасыщенные моноциклические углеводороды и их заместители Синяя книга ИЮПАК.
- Правило А-23. Гидрогенизированные соединения конденсированных полициклических углеводородов Синяя книга ИЮПАК.
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б с Уэйд, LG (2006). Органическая химия (6-е изд.). Пирсон Прентис Холл . стр. 279 . ISBN 978-1-4058-5345-3 .
- ↑ Перейти обратно: Перейти обратно: а б ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « Алкены ». два : 10.1351/goldbook.A00224
- ↑ Перейти обратно: Перейти обратно: а б с ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « олефины ». дои : 10.1351/goldbook.O04281
- ↑ Перейти обратно: Перейти обратно: а б с Мосс, врач общей практики; Смит, PAS; Тавернье, Д. (1995). «Глоссарий названий классов органических соединений и реакционноспособных промежуточных соединений в зависимости от структуры (Рекомендации ИЮПАК, 1995 г.)» . Чистая и прикладная химия . 67 (8–9): 1307–75. дои : 10.1351/pac199567081307 . S2CID 95004254 .
- ^ «Производство: рост — это норма». Новости химии и техники . 84 (28): 59–236. 10 июля 2006 г. doi : 10.1021/cen-v084n034.p059 .
- ^ Слоан, Нью-Джерси (ред.). «Последовательность A000631 (Количество производных этилена с n атомами углерода)» . Электронная энциклопедия целочисленных последовательностей . Фонд ОЭИС.
- ^ Смит, Майкл Б.; Марч, Джерри (2007), Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, стр. 23, ISBN 978-0-471-72091-1
- ↑ Перейти обратно: Перейти обратно: а б Бансал, Радж К. (1998). «Правило Бредта» . Механизмы органических реакций (3-е изд.). Макгроу-Хилл Образование . стр. 14–16. ISBN 978-0-07-462083-0 .
- ^ Фосетт, Фрэнк С. (1950). «Правило Бредта о двойных связях в структурах с атомными мостиками». хим. Откр. 47 (2): 219–274. дои : 10.1021/cr60147a003 . ПМИД 24538877 .
- ^ «Правило Бредта». Комплексные органические реакции и реагенты . Том. 116. 2010. С. 525–8. дои : 10.1002/9780470638859.conrr116 . ISBN 978-0-470-63885-9 .
- ^ Дуань, Сюйфан; Блок, Эрик; Ли, Чжэнь; Коннелли, Тимоти; Чжан, Цзянь; Хуан, Чжиминь; Су, Сюбо; Пан, Йи; Ву, Лифан (28 февраля 2012 г.). «Решающая роль меди в обнаружении одорантов, координирующих металлы» . Труды Национальной академии наук Соединенных Штатов Америки . 109 (9): 3492–7. Бибкод : 2012PNAS..109.3492D . дои : 10.1073/pnas.1111297109 . ПМК 3295281 . ПМИД 22328155 .
- ^ Нгуен, Трунг; Кларк, Джим (23 апреля 2019 г.). «Физические свойства алкенов» . Химия LibreTexts . Проверено 27 мая 2019 г.
- ^ Офардт, Чарльз (2003). «Температуры кипения и строение углеводородов» . Виртуальная химическая книга . Проверено 27 мая 2019 г.
- ^ Хэнсон, Джон. «Обзор химических сдвигов в H-ЯМР» . ups.edu . Проверено 5 мая 2019 г.
- ↑ Перейти обратно: Перейти обратно: а б «Ядерный магнитный резонанс (ЯМР) алкенов» . Химия LibreTexts . 23 апреля 2019 года . Проверено 5 мая 2019 г.
- ^ «Органические соединения: физические и термохимические данные» . ucdsb.on.ca . Проверено 5 мая 2019 г.
- ^ Шрайнер, РЛ; Герман, CKF; Моррилл, TC; Кертин, Д.Ю.; Фьюсон, Р.К. (1997). Систематическая идентификация органических соединений . Уайли. ISBN 0-471-59748-1 .
- ^ «Бромное число» . Компания Хач . Проверено 5 мая 2019 г.
- ^ Кларк, Джим (ноябрь 2007 г.). «Механизм кислотно-катализируемой гидратации этилена» . Химгид . Проверено 6 мая 2019 г.
- ^ Смит, Майкл Б.; Марч, Джерри (2007), Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Баптиста, Маурисио С.; Кадет, Жан; Маскио, Паоло Ди; Гогаре, Ашвини А.; Грир, Александр; Хэмблин, Майкл Р.; Лоренте, Каролина; Нуньес, Сильвия Кристина; Рибейру, Марта Симойнс; Томас, Андрес Х.; Виньони, Мариана; Ёсимура, Таня Матеус (2017). «Реакции фотосенсибилизированного окисления типа I и типа II: рекомендации и механизмы» . Фотохимия и фотобиология . 93 (4): 912–9. дои : 10.1111/php.12716 . ПМК 5500392 . ПМИД 28084040 .
- ^ Ода, Масаджи; Кавасе, Такеши; Курата, Хироюки (1996). «1,3,5-Циклооктатриен». Органические синтезы . 73 : 240. дои : 10.15227/orgsyn.073.0240 .
- ↑ Перейти обратно: Перейти обратно: а б Хартвиг, Джон (2010). Химия органопереходных металлов: от связывания к катализу . Нью-Йорк: Университетские научные книги. п. 1160. ИСБН 978-1-938787-15-7 .
- ^ Тореки, Роб (31 марта 2015 г.). «Алкеновые комплексы» . Металлоорганический гиперучебник . Проверено 29 мая 2019 г.
- ^ Уэйд, LG (2006). Органическая химия (6-е изд.). Пирсон Прентис Холл . стр. 309 . ISBN 978-1-4058-5345-3 .
- ^ Сондерс, WH (1964). «Реакции элиминирования в растворе». В Патае, Саул (ред.). Химия алкенов . Химия функциональных групп ПАТАИ. Уайли Интерсайенс. стр. 149–201. дои : 10.1002/9780470771044 . ISBN 978-0-470-77104-4 .
- ^ Крам, диджей; Грин, Фредерик Д.; Депюи, CH (1956). «Исследования по стереохимии. XXV. Затменные эффекты в реакции E21». Журнал Американского химического общества . 78 (4): 790–6. дои : 10.1021/ja01585a024 .
- ^ Бах, Р.Д.; Анджеевский, Денис; Дюсолд, Лоуренс Р. (1973). «Механизм устранения Коупа». Дж. Орг. Хим . 38 (9): 1742–3. дои : 10.1021/jo00949a029 .
- ^ Кроуэлл, Томас И. (1964). «Реакции конденсации алкенов». В Патае, Саул (ред.). Химия алкенов . Химия функциональных групп ПАТАИ. Уайли Интерсайенс. стр. 241–270. дои : 10.1002/9780470771044.ch4 . ISBN 978-0-470-77104-4 .
- ^ Делод, Лайонел; Ноэлс, Альфред Ф. (2005). «Метатезис». Энциклопедия химической технологии Кирка-Отмера . Вайнхайм: Wiley-VCH. стр. метаноэль.а01. дои : 10.1002/0471238961.metanoel.a01 . ISBN 978-0-471-23896-6 .
- ^ Фогт, Д. (2010). «Асимметричное гидровинилирование, катализируемое кобальтом». Энджью. хим. Межд. Эд . 49 (40): 7166–8. дои : 10.1002/anie.201003133 . ПМИД 20672269 .
- ^ Цвайфель, Джордж С.; Нанц, Майкл Х. (2007). Современный органический синтез: Введение . У. Х. Фриман. стр. 366 . ISBN 978-0-7167-7266-8 .
- ^ Нинкуу, Винсент; Чжан, Линь; Ян, Цзяньпей; и др. (июнь 2021 г.). «Биохимия терпенов и последние достижения в области защиты растений» . Международный журнал молекулярных наук . 22 (11): 5710. doi : 10.3390/ijms22115710 . ПМК 8199371 . ПМИД 34071919 .
- ^ Макмерри, Джон Э. (2014). Органическая химия с биологическими приложениями (3-е изд.). Cengage Обучение. п. 189 . ISBN 978-1-285-84291-2 .