Гидроборирование

В органической химии гидроборированием называют присоединение связи водород - бор к определенным двойным и тройным связям с участием углерода ( С=С , С=Н , С=О и С≡С ). Эта химическая реакция полезна в органическом синтезе органических соединений .
Гидроборирование дает органоборановые соединения , которые реагируют с различными реагентами с образованием полезных соединений, таких как спирты , амины или алкилгалогениды . Наиболее широко известной реакцией органоборанов является окисление с образованием спиртов, обычно с помощью перекиси водорода . Этот тип реакции способствовал исследованию гидроборирования из-за его мягкой реакции и широкого спектра переносимых алкенов . Еще одна подтема исследований — гидроборирование, катализируемое металлами .
Развитие этой технологии и лежащих в ее основе концепций было отмечено Нобелевской премией по химии Герберту К. Брауну . [1] Он разделил премию с Георгом Виттигом в 1979 году. [2] за новаторские исследования органоборанов как важных синтетических промежуточных продуктов. Дополнением к гидроборированию является карбоборирование , в котором вместо водорода включен углеродный фрагмент.
Добавление связи HB к двойным связям CC
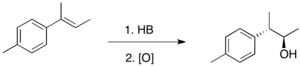
[ редактировать ]Гидроборирование обычно является антимарковниковским , т.е. водород присоединяется к наиболее замещенному углероду двойной связи. Тот факт, что региохимия обратна типичному присоединению HX, отражает полярность B. д+ -ЧАС д- облигации. Гидроборирование протекает через четырехчленное переходное состояние: атомы водорода и бора присоединяются на одной стороне двойной связи. Учитывая согласованность механизма, образование связи CB происходит несколько быстрее, чем образование связи CH. В результате в переходном состоянии бор приобретает частично отрицательный заряд, тогда как более замещенный углерод несет частично положительный заряд. Этот частичный положительный заряд лучше поддерживается более замещенным углеродом. Формально реакция является примером реакции переноса группы . Однако анализ задействованных орбиталей показывает, что реакция является «псевдоперициклической» и не подчиняется правилам Вудворда – Хоффмана для перициклической реакционной способности.

Если BH 3 используется в качестве гидроборирующего реагента, реакции обычно идут за пределами моноалкилборановых соединений, особенно для менее стерически затрудненных малых олефинов. Тризамещенные олефины могут быстро давать диалкилбораны, но дальнейшее алкилирование органоборанов замедляется из-за стерических затруднений. Эта значительная разница в скорости получения ди- и триалкилборанов полезна при синтезе объемистых боранов, которые могут повысить региоселективность.

Реакции с участием замещенных алкенов
[ редактировать ]В трехзамещенных алкенах, таких как 1 , бор преимущественно располагается на менее замещенном углероде. [3] Минорный продукт, в котором атом бора расположен на более замещенном углероде, обычно образуется в количестве менее 10%. Ярким примером более низкой региоселективности является стирол, причем на селективность сильно влияет заместитель в пара-положении.

Гидроборирование 1,2-дизамещенных алкенов, таких как цис- или транс -олефины, обычно дает смесь двух органоборанов в сопоставимых количествах, даже если заместители сильно различаются по стерической массе. Для таких 1,2-дизамещенных олефинов региоселективность может наблюдаться только тогда, когда один из двух заместителей представляет собой фенильное кольцо. В таких случаях, как, например, в транс -1-фенилпропене, атом бора располагается на углероде, соседнем с фенильным кольцом. Приведенные выше наблюдения показывают, что присоединение связи HB к олефинам происходит под электронным, а не стерическим контролем.


Реакции органоборанов
[ редактировать ]Связи CB, образующиеся в результате гидроборирования, вступают в реакцию с различными реагентами, наиболее распространенным из которых является перекись водорода . Поскольку присоединение HB к олефинам стереоспецифично, эта реакция окисления будет диастереоселективной , когда алкен тризамещен. [4] Таким образом, гидроборирование-окисление является отличным способом получения спиртов стереоспецифичным и антимарковниковским способом.
Гидроборирование также может привести к образованию аминов при обработке промежуточных органоборанов монохлорамином или O-гидроксиламинсульфоновой кислотой (HSA). [5]
Концевые олефины превращаются в соответствующие алкилбромиды и алкилйодиды путем обработки органоборановых промежуточных продуктов бромом. [6] или йод. [7] Однако такие реакции не оказались очень популярными, поскольку реагенты на основе сукцинимида , такие как NIS и NBS, более универсальны и не требуют строгих условий, как органобораны.и т. д.
Борановые аддукты
[ редактировать ]
Диборан можно получить in situ восстановлением BF 3 с помощью NaBH 4 (см. Флавопиридол ). Однако обычно используют боран-диметилсульфидный комплекс BH 3 S(CH 3 ) 2 в качестве источника BH 3 (BMS) . [9] Его можно получить в высококонцентрированных формах. [10]
Аддукт (ТГФ) также коммерчески BH 3 доступен в виде растворов ТГФ, где он существует в виде аддукта 1:1. Он деградирует со временем. [11]
Аддукты борана с фосфинами и аминами также доступны, но широко не используются. [12] Боран образует сильный аддукт с триэтиламином ; использование этого аддукта требует более жестких условий гидроборирования. Это может быть выгодно в таких случаях, как гидроборирование триенов, чтобы избежать полимеризации. Более стерически затрудненные третичные и силиламины могут доставлять боран к алкенам при комнатной температуре.

Монозамещенные бораны
[ редактировать ]
Моноалкилбораны относительно редки. Когда алкильная группа небольшая, например метильная, моноалкилбораны имеют тенденцию перераспределяться с образованием смесей диборана, ди- и триалкилборанов. Моноалкилбораны обычно существуют в виде димеров формы [RBH 2 ] 2 . Одним из примеров является тексилборан (ThxBH 2 ), полученный гидроборированием тетраметилэтилена : [13]
- B 2 H 6 + 2 Me 2 C=CMe 2 → [Me 2 CHCMe 2 BH 2 ] 2
Хиральным примером является моноизопинокамфейборан. Хотя его часто называют IpcBH 2 , он представляет собой димер [IpcBH 2 ] 2 . Его получают гидроборированием (-)-α-пинена диметилсульфидом борана . [14]
Разновидности формы RBH 2 доступны для R = алкила и галогенида . Монобром- и монохлорборан можно получить из БМС и соответствующих тригалогенидов бора. Стабильный комплекс монохлорборана и 1,4-диоксана осуществляет гидроборирование концевых алкенов. [15]
Двузамещенные бораны
[ редактировать ]Димезитилборан
[ редактировать ]димезитилборан представляет собой димер (C 6 H 2 Me 3 ) 2 B 2 H 2 ). Он медленно реагирует с простыми концевыми алкенами. С другой стороны, алкины легко подвергаются моногидроборированию с Mes 2 BH с образованием алкенилборанов. [16]
Дисиамилборан
[ редактировать ]К числу затрудненных диалкилборанов относится дисиамилборан , сокращенно Sia 2 BH. Это также димер. Благодаря своей стерической массе он селективно гидроборирует менее затрудненные, обычно концевые алкены, в присутствии более замещенных алкенов. [17] Дисиамилборан должен быть свежеприготовленным, поскольку его растворы можно хранить при температуре 0 °C только в течение нескольких часов. Дициклогексилборан Chx 2 BH демонстрирует улучшенную термическую стабильность, чем Sia 2 BH.
9-ББН
[ редактировать ]Универсальный диалкилборан — 9-BBN . Также называемый «банановым бораном», он существует в виде димера. Его можно перегонять без разложения при температуре 195 °C (12 мм рт. ст.). Реакции с 9-BBN обычно происходят при температуре 60–80 ° C, при этом большинство алкенов реагируют в течение одного часа. Тетразамещенные алкены присоединяют 9-BBN при повышенной температуре. Гидроборирование алкенов 9-BBN протекает с превосходной региоселективностью. Он более чувствителен к стерическим различиям, чем Sia 2 BH, возможно, из-за его жесткого остова C 8 . 9-BBN более активен по отношению к алкенам, чем к алкинам. [18]
Другие вторичные бораны
[ редактировать ]Простые, беспрепятственные диалкилбораны реакционноспособны при комнатной температуре по отношению к большинству алкенов и концевых алкинов, но их трудно получить с высокой чистотой, поскольку они существуют в равновесии с моно- и триалкилборанами. Одним из распространенных способов их получения является восстановление диалкилгалогенборанов гидридами металлов. [19] Важным синтетическим применением таких диалкилборанов, как диэтилборан, является переметаллирование борорганических соединений с образованием цинкорганических соединений. [20] [21]
Пинаколборан и катехолборан
[ редактировать ]Для каталитического гидроборирования пинаколборан и катехолборан широко используют . Они также проявляют более высокую реакционную способность по отношению к алкинам. [22] Пинаколборан также широко используется в безкатализаторных гидроборациях.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Браун, ХК (1961). «Гидроборирование — мощный синтетический инструмент». Тетраэдр . 12 (3): 117. дои : 10.1016/0040-4020(61)80107-5 .
- ^ «Нобелевская премия по химии 1979 года» . www.nobelprize.org . Проверено 21 марта 2017 г.
- ^ Браун, ХК; Цвефей, Г. (1960). «Изомеризация органоборанов, производная механизма присоединения изомеризации из олефинов с разветвленной цепью и кольца - дополнительные доказательства механизма элиминирования-присоединения изомеризации». Журнал Американского химического общества . 82 : 1504. дои : 10.1021/ja01491a058 .
- ^ Оллред, Эль; Зонненберг, Дж.; Винщин С. (1960). «Получение гомобензилового и гомоаллилового спиртов методом гидроборации». Журнал органической химии . 25:25 . дои : 10.1021/jo01071a007 .
- ^ Гидроксиламин
- ^ Браун, ХК; Лейн, CF (1970). «Индуцированная основанием реакция органоборанов с бромом. Удобная методика антимарковниковского гидробромирования концевых олефинов методом гидроборирования-бромирования». Журнал Американского химического общества . 92 (22): 6660. doi : 10.1021/ja00725a057 .
- ^ Браун, ХК; Ратке, М.; Рогич, ММ (1968). «Быстрая реакция органоборанов с йодом под влиянием основания. Удобный метод превращения терминальных олефинов в первичные йодиды путем гидроборирования-йодирования». Журнал Американского химического общества . 90 (18): 5038. doi : 10.1021/ja01020a056 .
- ^ Хатчинс, Роберт О.; Цистон, Фрэнк (1981). «Полезность и применение диметилсульфида борана в органическом синтезе. Обзор». Органические препараты и процедуры International . 13 (3–4): 225. дои : 10.1080/00304948109356130 .
- ^ См . Комплекс боран-диметилсульфид.
- ^ Зайдлевич, Марек; Баум, Офир; Сребник, Моррис (2006). «Боран Диметилсульфид». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.rb239.pub2 . ISBN 0471936235 .
- ^ Коллонитич, Дж (1961). «Восстановительное расщепление кольца тетрагидрофуранов дибораном». Дж. Ам. хим. Соц . 83 6):1515.doi : ( 10.1021/ja01467a056 .
- ^ Карбони, Б.; Мунье, Л. (1999). «Последние достижения в химии амино- и фосфинборанов». Тетраэдр . 55 (5): 1197. doi : 10.1016/S0040-4020(98)01103-X .
- ^ Негиси, Эй-Ичи; Браун, Герберт К. (1974). «Тексилборан — универсальный реагент для органического синтеза методом гидроборирования». Синтез . 1974 (2): 77–89. дои : 10.1055/s-1974-23248 .
- ^ Дхар, Радж К.; Джосюла, Кант В.Б.; Тодд, Роберт; Гагаре, Правин Д.; Рамачандран, Вирарагаван (2001). «Диизопинокамфейборан». Энциклопедия реагентов для органического синтеза . стр. 1–10. дои : 10.1002/047084289X.rd248.pub3 . ISBN 9780470842898 .
- ^ Кант, JVB; Браун, ХК (2001). «Гидроборирование. 97. Синтез новых исключительных аддуктов хлороборан-основание Льюиса для гидроборирования. Диоксан-монохлорборан как превосходный реагент для селективного гидроборирования терминальных алкенов». Журнал органической химии . 66 (16): 5359–65. дои : 10.1021/jo015527o . ПМИД 11485456 .
- ^ Пельтер, А.; Сингарам, С.; Браун, ХК (1983). «Группа димезитилбора в органической химии. 6 гидробораций с димезитилбораном». Буквы тетраэдра . 24 (13): 1433. doi : 10.1016/S0040-4039(00)81675-5 .
- ^ Додд, Д.С.; Охльшлагер, AC (1992). «Синтез ингибиторов 2,3-оксидосквален-ланостеролциклазы: сопряженное присоединение органокупратов к N-(карбобензилокси)-3-карбометокси-5,6-дигидро-4-пиридону». Журнал органической химии . 57 (10): 2794. doi : 10.1021/jo00036a008 .
- ^ Диллон, RS (2007). Гидроборирование и органический синтез: 9-Борабицикло [3.3.1] Нонан (9-BBN) . Спрингер.
- ^ Браун, ХК; Кулкарни, SU (1981). «Органобораны: XXV. Гидридирование диалкилгалоборанов. Новые практические синтезы диалкилборанов в мягких условиях». Журнал металлоорганической химии . 218 : 299. дои : 10.1016/S0022-328X(00)81001-3 .
- ^ Будье, А.; Хьюп, Э.; Кнохель, П. (2000). «Высокодиастереоселективный синтез моноциклических и бициклических вторичных диорганоцинковых реагентов определенной конфигурации». Angewandte Chemie, международное издание . 39 (13): 2294–2297. doi : 10.1002/1521-3773(20000703)39:13<2294::AID-ANIE2294>3.0.CO;2-J . ПМИД 10941068 .
- ^ Хьюп, Э.; Кнохель, П. (2001). «Стереоселективный синтез вторичных цинкорганических реагентов и их реакция с гетероатомными электрофилами». Органические письма . 3 (1): 127–30. дои : 10.1021/ol0068400 . ПМИД 11429854 .
- ^ Браун, ХК; Зайдлевич, М. (2001). Органический синтез с помощью боранов, Vol. 2 . Милуоки, Висконсин: ISBN Aldrich Chemical Co. 978-0-9708441-0-1 .