Связь углерод-кислород
Связь углерод-кислород это полярная ковалентная связь между атомами углерода — и кислорода . [ 1 ] [ 2 ] [ 3 ] : 16–22 Связи углерод-кислород встречаются во многих неорганических соединениях, таких как оксиды углерода и оксогалогениды , карбонаты и карбонилы металлов . [ 4 ] и в органических соединениях, таких как спирты , простые эфиры , карбонильные соединения и оксалаты . [ 5 ] : 32–36 Кислород имеет 6 валентных электронов собственных и имеет тенденцию заполнять свою внешнюю оболочку 8 электронами , делясь электронами с другими атомами, образуя ковалентные связи , принимая электроны с образованием аниона или их комбинации. В нейтральных соединениях атом кислорода может образовывать до двух одинарных или одну двойную связь с углеродом, а атом углерода — до четырех одинарных или двух двойных связей с кислородом.
Склеивание мотивов
[ редактировать ]Связывание с кислородом
[ редактировать ]В эфирах кислород образует две одинарные ковалентные связи с двумя атомами углерода C–O–C, тогда как в спиртах кислород образует одну одинарную связь с углеродом и одну с водородом C–O–H. [ 5 ] : 32 В карбонильных соединениях кислород образует ковалентную двойную связь с углеродом C=O, известную как карбонильная группа . [ 5 ] : 136 В простых эфирах, спиртах и карбонильных соединениях четыре несвязывающих электрона во внешней оболочке кислорода образуют две неподеленные пары . [ 5 ] : 108 В алкоксидах кислород образует одинарную связь с углеродом и принимает электрон от металла с образованием алкоксид-аниона R–O. − , с тремя неподеленными парами. В ионах оксония одна из двух неподеленных пар кислорода используется для образования третьей ковалентной связи, которая генерирует катион > O. + – или =О + - или ≡О + , при этом осталась одна неподеленная пара. [ 5 ] : 343, 410
Связывание на углероде
[ редактировать ]Атом углерода образует одну одинарную связь с кислородом в спиртах, эфирах и пероксидах, две в ацеталях , [ 3 ] : 524 [ 5 ] : 35, 340–348 три в ортоэфирах , [ 5 ] : 345 и четыре в ортокарбонатах . [ 6 ] Углерод образует двойную связь с кислородом в альдегидах , кетонах и ацилгалогенидах . В карбоновых кислотах , эфирах и ангидридах каждый карбонильный атом углерода образует одну двойную связь и одну одинарную связь с кислородом. В эфирах карбонатов и угольной кислоте карбонильный углерод образует одну двойную и две одинарные связи с кислородом. В углекислом газе углерод образует две двойные связи с кислородом.
Электроотрицательность и длины связей
[ редактировать ]Связь C–O сильно поляризована по отношению к кислороду ( электроотрицательность C по сравнению с O, 2,55 против 3,44). Длина связи [ 4 ] для парафиновых связей C–O находятся в пределах 143 пм – меньше, чем у связей C–N или C–C. Укороченные одинарные связи обнаруживаются в карбоновых кислотах (136 пм) из-за частичного характера двойной связи, а удлиненные связи обнаруживаются в эпоксидах (147 пм). [ 7 ] C–O Прочность связи также больше, чем C–N или C–C. Например, прочность связи составляет 91 килокалория (380 кДж)/моль (при 298 К) в метаноле , 87 килокалорий (360 кДж)/моль в метиламине и 88 килокалорий (370 кДж)/моль в этане . [ 7 ]
Углерод и кислород образуют концевые двойные связи в функциональных группах, известных под общим названием карбонильные соединения, к которым принадлежат такие соединения, как кетоны , сложные эфиры , карбоновые кислоты и многие другие. Внутренние связи C=O встречаются в положительно заряженных ионах оксония . В фуранах атом кислорода способствует делокализации пи-электрона через заполненную р-орбиталь, и, следовательно, фураны являются ароматическими . Длина связей C=O в карбонильных соединениях составляет около 123 пм. Длина связи C=O в углекислом газе составляет 116 пм. Связи C=O в ацилгалогенидах имеют характер частичной тройной связи и, следовательно, очень короткие: 117 пм. Соединений с формальными тройными связями C ≡ O не существует, за исключением оксида углерода , который имеет очень короткую и прочную связь (112,8 мкм), и ионов ацилия , R–C≡O. + (обычно 23:10-112). [ 8 ] [ 9 ] [ 10 ] Такие тройные связи имеют очень высокую энергию связи, даже выше, чем тройные связи N≡N. [ 11 ] Кислород также может быть трехвалентным, например в тетрафторборате триэтилоксония . [ 5 ] : 343
Химия
[ редактировать ]Реакции образования углерод-кислородной связи представляют собой синтез эфира Вильямсона , нуклеофильное ацильное замещение и электрофильное присоединение к алкенам. В реакции Патерно-Бючи участвуют карбонильные соединения.
Функциональные группы кислорода
[ редактировать ] этого раздела Фактическая точность оспаривается . ( февраль 2019 г. ) |
Углеродно-кислородные связи присутствуют в следующих функциональных группах :
| Химический класс | Ордер на облигации | Формула | Структурная формула | Пример |
|---|---|---|---|---|
| Спирты | 1 | ДУХ | Этанол | |
| Эфиры | 1 | РОР' | Диэтиловый эфир | |
| Пероксиды | 1 | РЕВ' | 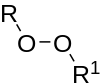
|
Ди-трет-бутилпероксид |
| Цианатные эфиры | 1 | РОКН | 
|
бисфенола А Цианатный эфир |
| Альдегиды | 2 | РЧО | 
|
 Акролеин |
| Кетоны | 2 | РЦОР' | 
|
Ацетон |
| Карбоновые кислоты | 1 и 2 | RCOOH (или RCO 2 H) |

|
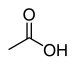 Уксусная кислота |
| Эфиры | 1 и 2 | РКООР (или РКО 2 Р) |

|
Этилакрилат |
| Карбонатные эфиры | 1 и 2 | РОКООР (или РОКО 2 Р) |

|
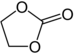 Этиленкарбонат |
| изоцианаты | 2 | РНКО | 
|
 Фенилизоцианат |
| Нитритовые эфиры | 1 | РОНО | Амилнитрит | |
| Нитратные эфиры | 1 | КОНФЕРЕНЦИЯ 2 | 
|
Изопропилнитрат |
| Карбаматные эфиры | 1 и 2 | РОКОНР 2 | 
|
 Карбарил |
| Фураны | 1.5 | Р 4 С 4 О | 
|
 Фурфурал |
| Соли пирилия | 1.5 | Р 5 С 5 О + Х − | 
|
 Антоцианы |
См. также
[ редактировать ]- Углеродные соединения # Углеродно-кислородные соединения
- Углеродно-водородная связь
- Углерод-углеродная связь
- Связь углерод-азот
- Связь углерод-фтор
- Связь кремний-кислород
Ссылки
[ редактировать ]- ^ Органическая химия Джон Макмерри, 2-е изд. [ нужна страница ]
- ^ Продвинутая органическая химия Кэри, Фрэнсис А., Сундберг, Ричард Дж. 5-е изд. 2007 год
- ^ Jump up to: а б Смит, Майкл Б.; Марч, Джерри (2007). Продвинутая органическая химия марта (6-е изд.). Джон Уайли и сыновья. ISBN 978-0-471-72091-1 .
- ^ Jump up to: а б Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . стр. 292, 304–314. ISBN 978-0-08-037941-8 .
- ^ Jump up to: а б с д и ж г час Клейден, Джонатан ; Гривз, Ник; Уоррен, Стюарт ; Уотерс, Питер (2001). Органическая химия (1-е изд.). Издательство Оксфордского университета. ISBN 978-0-19-850346-0 .
- ^ Ланиэль, Доминик; Бинк, Яннес; Винклер, Бьорн; Фогель, Себастьян; Федотенко Тимофей; Харитон, Стелла; Прокопенко, Виталий; Мильман, Виктор; Шник, Вольфганг; Дубровинский, Леонид; Дубровинская, Наталья (2021). «Синтез, кристаллическая структура и взаимосвязь структура-свойство ортокарбоната стронция Sr 2 CO 4 » . Акта Кристаллогр. Б. 77 (1): 131–137. дои : 10.1107/S2052520620016650 . ISSN 2052-5206 . ПМЦ 7941283 .
- ^ Jump up to: а б Справочник CRC по химии и физике, 65-е изд.
- ^ Шеврие, Б.; Карпентье, Дж. М. Ле; Вайс, Р. (1972). «Синтез двух кристаллических разновидностей промежуточного пентахлорида сурьмы Фриделя-Крафтса - п -толуоилхлорида. Кристаллические структуры донорно-акцепторного комплекса и ионной соли». Дж. Ам. хим. Соц . 94 (16): 5718–5723. дои : 10.1021/ja00771a031 .
- ^ Давлиева Миля Г.; Линдеман, Сергей В.; Неретин Иван С.; Кочи, Джей К. (2004). «Структурные эффекты координации монооксида углерода с углеродными центрами. π- и σ-связывания в алифатических ацилах по сравнению с ароматическими ароилкатионами». Нью Дж. Хим. 28 : 1568–1574. дои : 10.1039/B407654K .
- ^ Хермансдорфер, Андре; Дрисс, Матиас (2021). «Кремниевый тетракис (трифторметансульфонат): простой нейтральный силан, действующий как мягкая и твердая суперкислота Льюиса» . Энджью. хим. Межд. Эд. 60 (24): 13656–13660. дои : 10.1002/anie.202103414 . ПМЦ 8252640 . ПМИД 33826216 .
- ^ «Стандартные энергии облигаций» . Химический факультет Мичиганского государственного университета. Архивировано из оригинала 29 августа 2016 года.