Перекись кальция
 | |
| Имена | |
|---|---|
Другие имена
| |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.013.764 |
| Номер ЕС |
|
| номер Е | E930 (глянцеватели, ...) |
| 674257 | |
| КЕГГ | |
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 1457 |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| Са О 2 | |
| Молярная масса | 72.076 g·mol −1 |
| Появление | белый или желтоватый порошок |
| Запах | без запаха |
| Плотность | 2,91 г/см 3 |
| Температура плавления | ~ 355 ° C (671 ° F; 628 К) (разлагается) |
| разлагается | |
| Кислотность ( pKa ) | 12.5 |
| -23.8·10 −6 см 3 /моль | |
Показатель преломления ( n D ) | 1.895 |
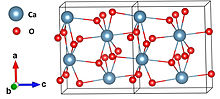
| Структура | |
| орторомбический [2] | |
| Пна2 1 | |
| 8 [2] | |
| Опасности | |
| СГС Маркировка : | |
  | |
| Предупреждение | |
| Х272 , Х315 , Х319 , Х335 | |
| P210 , P220 , P221 , P261 , P264 , P271 , P280 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P321 , P332+P313 , P337+P313 , P362 , 0+P378 , P403+P233 , П405 , П501 | |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | >5000 мг/кг (перорально, крыса) >10000 мг/кг (кожный, крыса) |
| Родственные соединения | |
Другие анионы | Оксид кальция |
Другие катионы | Перекись стронция Перекись бария Перекись натрия |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Пероксид кальция или диоксид кальция – неорганическое соединение формулы CaO 2 . Это перекись (O 2 2− ) соль Са 2+ . Коммерческие образцы могут иметь желтоватый цвет, но чистое соединение имеет белый цвет. Он практически нерастворим в воде . [3]
Структура и стабильность
[ редактировать ]В твердом состоянии он относительно устойчив к разложению. Однако при контакте с водой он гидролизуется с выделением кислорода. При обработке кислотой образуется перекись водорода .
Подготовка
[ редактировать ]Пероксид кальция получают путем соединения солей кальция и перекиси водорода :
- Са(ОН) 2 + Н 2 О 2 → СаО 2 + 2 Н 2 О
Октагидрат выпадает в осадок при реакции гидроксида кальция с разбавленной перекисью водорода . При нагревании обезвоживается.
Приложения
[ редактировать ]В основном он используется в качестве окислителя для усиления извлечения драгоценных металлов из руд. Во втором основном применении он используется в качестве пищевой добавки под номером E930. Он используется в качестве отбеливателя и улучшителя муки . [3]
В сельском хозяйстве его применяют при предпосевной обработке семян риса . Кроме того, перекись кальция нашла применение в аквакультуре для насыщения кислородом и дезинфекции воды. В индустрии экологического восстановления его используют при обработке почв. Перекись кальция используется так же, как и перекись магния, в программах восстановления окружающей среды. Он используется для восстановления почвы и грунтовых вод, загрязненных нефтью, в процессе усиленной биоремедиации на месте . Это второстепенный компонент некоторых средств для ухода за зубами.
Он также используется для отверждения политиоэфирных полимеров путем окисления концевых тиоловых групп до дисульфидных мостиков. [ нужна ссылка ]
Ссылки
[ редактировать ]- ^ «Служба регистрации веществ | Агентство по охране окружающей среды США» .
- ^ Jump up to: а б Чжао, X.; Нгуен, MC; Ван, Чехия; Хо, К.М. (2013). «Структура и стабильность пероксидов щелочноземельных металлов XO2 (X = Ca, Be, Mg), изученных с помощью генетического алгоритма» . РСК Прогресс . 3 (44): 22135. Бибкод : 2013RSCAd...322135Z . дои : 10.1039/C3RA43617A .
- ^ Jump up to: а б Якоб Х., Лейнингер С., Леманн Т. и др. «Пероксосоединения неорганические». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a19_177.pub2 . ISBN 978-3527306732 .