Сульфит кальция

| |
| Имена | |
|---|---|
| Название ИЮПАК
Сульфит кальция
| |
Другие имена
| |
| Идентификаторы | |
| |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.030.529 |
| Номер ЕС |
|
| номер Е | Е226 (консерванты) |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| СаSO 3 | |
| Молярная масса | 120,17 г/моль |
| Появление | Белый твердый |
| Температура плавления | 600 ° C (1112 ° F; 873 К) |
| 4,3 мг/100 мл (18 °С) | |
Произведение растворимости ( K sp )
|
3.1 × 10 −7 [ 1 ] |
| Опасности | |
| точка возгорания | Невоспламеняющийся |
| Родственные соединения | |
Другие анионы
|
Сульфат кальция |
Другие катионы
|
Сульфит натрия |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Сульфит кальция , или сульфит кальция , — химическое соединение, кальциевая соль сульфита с формулой CaSO 3 ·x(H 2 O). Известны две кристаллические формы: полугидрат и тетрагидрат, соответственно CaSO 3 ·½(H 2 O) и CaSO 3 ·4(H 2 O). [ 2 ] Все формы представляют собой белые твердые вещества. Наиболее известен как продукт десульфурации дымовых газов .
Производство
[ редактировать ]Его производят в больших масштабах путем десульфурации дымовых газов (ДДГ). При сжигании угля или другого ископаемого топлива образуется побочный продукт, известный как дымовой газ . Дымовые газы часто содержат SO 2 , выбросы которых часто регулируются во избежание кислотных дождей . Диоксид серы очищается до того, как оставшиеся газы выбрасываются через дымоход . Экономичным способом очистки дымовых газов от SO 2 является обработка сточных вод Ca(OH) 2 гашеной известью CaCO 3 или известняком . [ 3 ]
Очистка известняком приводит к следующей идеализированной реакции:
- SO2 + СаСО 3 → СаSO 3 + СО 2
Очистка гашеной известью следует следующей идеализированной реакции: [ 4 ] [ 5 ]
- SO2 + Са(ОН) 2 → СаSO 3 + Н 2 О
Образующийся сульфит кальция окисляется на воздухе с образованием гипса:
- СаSO 3 + 1 ⁄ 2 О 2 → СаSO 4
Гипс, если он достаточно чистый, можно использовать в качестве строительного материала.
Использование
[ редактировать ]Гипсокартон
[ редактировать ]Сульфит кальция образуется как промежуточный продукт при производстве гипса, который является основным компонентом гипсокартона . Типичный дом в США содержит 7 тонн такого гипсокартона. [ 6 ]
Пищевая добавка
[ редактировать ]В качестве пищевой добавки он используется в качестве консерванта под номером Е E226. Наряду с другими антиоксидантными сульфитами он обычно используется для консервирования вина, сидра, фруктовых соков, консервированных фруктов и овощей. Сульфиты являются сильными восстановителями в растворе, они действуют как поглощающие кислород антиоксиданты, , сохраняя пищу, но маркировка необходима, поскольку некоторые люди могут быть гиперчувствительны .
Производство древесной массы
[ редактировать ]Химическая целлюлоза – это удаление целлюлозы из древесины путем растворения лигнина, который связывает целлюлозу. Сульфит кальция можно использовать при производстве древесной массы посредством сульфитного процесса в качестве альтернативы крафт-процессу используются гидроксиды и сульфиды , в котором вместо сульфитов . Использовался сульфит кальция, но его в значительной степени заменили сульфиты и бисульфиты магния и натрия для воздействия на лигнин. [ нужна ссылка ]
Гипс
[ редактировать ]Существует возможность использования сульфита кальция для получения гипса путем окисления (добавления O 2 ) его в водной смеси с марганцем ( Mn 2+ ) катионные или сернокислотные катализаторы . [ 7 ] [ 8 ]
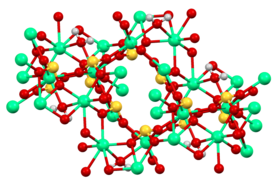
Структура
[ редактировать ]-
Структура [Ca 3 (SO 3 ) 2 (H 2 O) 12 ] 2+ клетка в тетрагидрате сульфита кальция.
-
Структура безводного CaSO 3 .
Рентгеновская кристаллография показывает, что безводный сульфит кальция имеет сложную полимерную структуру. [ 9 ] Тетрагидрат кристаллизуется в виде твердого раствора Ca 3 (SO 3 )2(SO 4 ). . 12H 2 O и Ca 3 (SO 3 )2(SO 3 ) . 12H 2 O. Смешанный сульфит-сульфат представляет собой промежуточный продукт окисления сульфита в сульфат, что практикуется при производстве гипса . Этот твердый раствор состоит из [Ca 3 (SO 3 ) 2 (H 2 O) 12 ] 2+ катионы и сульфит или сульфат в качестве аниона. [ 2 ] [ 10 ] Эти кристаллографические исследования подтверждают, что сульфит-анион принимает пирамидальную геометрию.
Естественное явление
[ редактировать ]Полугидрат сульфита кальция(III) встречается в природе как редкий минерал ханнебахит. [ 11 ] [ 12 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Джон Рамбл (18 июня 2018 г.). Справочник CRC по химии и физике (99 изд.). ЦРК Пресс. стр. 5–188. ISBN 978-1138561632 .
- ^ Jump up to: а б Авраам Коэн; Мендель Занген (1984). «Исследования щелочноземельных сульфитов. Строение и устойчивость нового соединения Ca 3 (SO 3 ) 2 SO 4 . 12H 2 O и его твердый раствор в тетрагидрате сульфита кальция» . Chemistry Letters . 13 (7): 1051–1054. doi : 10.1246/cl.1984.1051 .
- ^ Виршинг, Франц (2000). «Сульфат кальция». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a04_555 . ISBN 3527306730 .
- ^ Хадсон, Дж.Л. (1980). Окисление серы в скрубберных системах . Университет Вирджинии.
- ^ Миллер, Брюс (2004). Угольные энергетические системы . Эльзевир Научные технологии. стр. 294–299.
- ^ «Статистика и информация по гипсу Геологической службы США» . Геологическая служба США . Проверено 26 июня 2016 г.
- ^ Ли, Юран; Чжоу, Цзиньтин; Чжу, Тингюй; Цзин, Пэнфэй (01 февраля 2014 г.). «Окисление сульфита кальция и рост кристаллов в процессе остатка карбида кальция для производства гипса». Валоризация отходов и биомассы . 5 (1): 125–131. дои : 10.1007/s12649-013-9206-2 . ISSN 1877-2641 . S2CID 98774317 .
- ^ «Как мы можем преобразовать сульфит кальция в сульфат кальция после…» ResearchGate . Проверено 18 мая 2018 г.
- ^ Джошуа, Тамоцу; Облако, Иисус (1986). «Кристаллическая структура сульфита кальция». Гипс и Известь (яп. язык) . 203 : 235–44.
- ^ Мацуно, Такаши; Такаянаги, Хироаки; Фурухата, химия; Койши, Масуми; Огура, Харуо (1984). «Кристаллическая структура полугидрата сульфита кальция» . Бюллетень Химического общества Японии . 57 (4): 1155–6. дои : 10.1246/bcsj.57.1155 .
- ^ «Ханнебахит» .
- ^ «Список минералов» . 21 марта 2011 г.
![Строение каркаса [Ca3(SO3)2(H2O)12]2+ в тетрагидрате сульфита кальция.](http://upload.wikimedia.org/wikipedia/commons/thumb/3/35/Ca3%28SO3%292aq12.png/180px-Ca3%28SO3%292aq12.png)