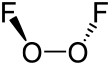Дифторид дикислорода
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Дифторид дикислорода | |||
| Систематическое название ИЮПАК Фторкислородный гипофторит | |||
Другие имена
| |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| Сокращения | фуф | ||
| ЧЭБИ | |||
| ХимическийПаук | |||
| 1570 | |||
ПабХим CID | |||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| ТО 22F 2 | |||
| Молярная масса | 69.996 g·mol −1 | ||
| Появление | оранжевый как твердое вещество красный как жидкость | ||
| Плотность | 1,45 г/см 3 (в точке б.п.) | ||
| Температура плавления | -154 ° C (-245 ° F; 119 К) | ||
| Точка кипения | -57 ° C (-71 ° F; 216 К) экстраполировано | ||
| Растворимость в других растворителях | разлагается | ||
| Термохимия | |||
Теплоемкость ( С ) | 62,1 Дж/(моль·К) | ||
Стандартный моляр энтропия ( S ⦵ 298 ) | 277,2 Дж/(моль·К) | ||
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | 19,2 кДж/моль | ||
Свободная энергия Гиббса (Δ f G ⦵ ) | 58,2 кДж/моль | ||
| Родственные соединения | |||
Родственные соединения | |||
| Опасности | |||
| СГС Маркировка : | |||
    | |||
| Опасность | |||
| NFPA 704 (огненный алмаз) | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Дифторид дикислорода представляет собой фтора и с кислорода соединение молекулярной формулой O 2 F 2 . Он может существовать в виде твердого вещества оранжевого цвета, которое плавится в красную жидкость при температуре -163 ° C (110 К). Это чрезвычайно сильный окислитель , который разлагается на кислород и фтор даже при -160 ° C (113 К) со скоростью 4% в день - поэтому его время жизни при комнатной температуре чрезвычайно короткое. [1] Дифторид дикислорода энергично реагирует почти со всеми химическими веществами, с которыми он сталкивается (включая обычный лед ), что привело к его звукоподражательному прозвищу FOOF (игра на его химической структуре и его взрывоопасных свойствах). [2]
Подготовка
[ редактировать ]Дифторид дикислорода можно получить, подвергая смесь газообразных фтора и кислорода в соотношении 1:1 при низком давлении (оптимально 7–17 мм рт. ст . (0,9–2,3 кПа ) электрическому разряду силой 25–30 мА при 2,1–2,4 кВ . [3] Подобный метод был использован для первого синтеза Отто Раффом в 1933 году. [4] Другой синтез включает смешивание O
2 и Ф
2 в сосуде из нержавеющей стали , охлажденном до -196 °C (77,1 К), с последующим воздействием на элементы с энергией 3 МэВ тормозного излучения в течение нескольких часов. Третий метод требует нагрева смеси фтора и кислорода до 700 °C (1292 °F), а затем быстрого охлаждения ее с помощью жидкого кислорода . [5] Все эти методы предполагают синтез по уравнению
- ТО
2 + Ф
2 → О
22F
2
Он также возникает в результате термического разложения озона дифторида : [6]
- 2 О
33F
2 → 2О
22F
2 + О
2
Структура и свойства
[ редактировать ]В О
22F
2 , кислороду присвоена необычная степень окисления +1. В большинстве других соединений кислород имеет степень окисления -2.
Структура дифторида кислорода напоминает структуру перекиси водорода H.
22О
2 , в большом двугранном угле , приближающемся к 90°, и C 2 симметрии . Эта геометрия соответствует предсказаниям теории VSEPR .
Связь внутри дифторида дикислорода была предметом серьезных спекуляций, особенно из-за очень короткого расстояния O-O и большого расстояния O-F. Длина связи O-O находится в пределах 2 пм от расстояния 120,7 пм для двойной связи O = O в молекуле дикислорода , O
2 . Для объяснения этого было предложено несколько систем связи, в том числе тройная связь O-O с одинарными связями O-F, дестабилизированными и удлиненными за счет отталкивания между неподеленными парами атомов фтора и π-орбиталями связи O-O. [7] Отталкивание неподеленных пар фтора также ответственно за длинные и слабые ковалентные связи в молекуле фтора . Вычислительная химия показывает, что дифторид дикислорода имеет чрезвычайно высокий барьер вращения - 81,17 кДж / моль вокруг связи O-O (в перекиси водорода барьер составляет 29,45 кДж / моль); это близко к энергии диссоциации связи O-F, равной 81,59 кДж/моль. [8]
The 19 F ЯМР Химический сдвиг дифторида дикислорода составляет 865 м.д., что на сегодняшний день является самым высоким химическим сдвигом, зарегистрированным для ядра фтора, что подчеркивает необычайные электронные свойства этого соединения. Несмотря на его нестабильность, термохимические данные для O
22F
2 были составлены. [9]
Реактивность
[ редактировать ]Соединение легко разлагается на кислород и фтор. Даже при температуре -160 °C (113 К) каждый день разлагается 4%. [1] этим процессом:
- ТО
22F
2 → О
2 + Ф
2
Другим основным свойством этого нестабильного соединения является его окислительная способность, хотя большинство экспериментальных реакций проводилось при температуре -100 ° C (173 К). [10] Несколько экспериментов с этим соединением привели к серии пожаров и взрывов. Некоторые из соединений, которые вызывали бурные реакции с O
22F
2 включают этиловый спирт , метан , аммиак и даже водяной лед . [10]
С парнем
3 и ПФ
5 , он дает соответствующие диоксигенильные соли: [1] [11]
- 2 О
22F
2 + 2 ПФ
5 → 2 [О
2 ] +
[ПФ
6 ] −
+ Ф
2
Использование
[ редактировать ]В настоящее время это соединение не имеет практического применения, но представляет теоретический интерес. Одна лаборатория использовала его для синтеза гексафторида плутония при беспрецедентно низких температурах, что было важно, поскольку предыдущие методы получения требовали настолько высоких температур, что созданный гексафторид плутония быстро разлагался. [12]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с Холлеман, А.Ф.; Виберг, Э. (2001). Неорганическая химия . Академическая пресса . ISBN 978-0-12-352651-9 .
- ^ Лоу, Дерек (23 февраля 2010 г.). «Вещи, с которыми я не буду работать: дифторид дикислорода» . www.science.org . Проверено 26 мая 2022 г.
- ^ Квасник, В. (1963). «Дикислород дифторид». В Брауэр, Г. (ред.). Справочник по препаративной неорганической химии . Том. 1 (2-е изд.). Нью-Йорк: Академическая пресса. п. 162.
- ^ Рафф, О.; Мензель, В. (1933). «Новые фториды кислорода: O
22F
2 и ОФ». Журнал неорганической и общей химии . 211 (1–2): 204–208. doi : 10.1002/zaac.19332110122 . - ^ Миллс, Томас (1991). «Прямой синтез жидкофазного дифторида кислорода» . Журнал химии фтора . 52 (3): 267–276. дои : 10.1016/S0022-1139(00)80341-3 .
- ^ Киршенбаум, А.Д.; Гросс, А. В. (1959). «Фторид озона или дифторид трикислорода, O
33F
2 ». Журнал Американского химического общества . 81 (6): 1277. doi : 10.1021/ja01515a003 . - ^ Бриджман, Эй Джей; Ротери, Дж. (1999). «Связывание в смешанных галогенах и пероксидах водорода». Журнал Химического общества, Dalton Transactions . 1999 (22): 4077–4082. дои : 10.1039/a904968a .
- ^ Крака, Эльфи; Он, Юань; Кремер, Дитер (2001). «Квантово-химические описания FOOF: нерешенная проблема предсказания его равновесной геометрии». Журнал физической химии А. 105 (13): 3269–3276. Бибкод : 2001JPCA..105.3269K . дои : 10.1021/jp002852r .
- ^ Лайман, Джон Л. (1989). «Термодинамические свойства дифторида дикислорода (O 2 F 2 ) и фторида дикислорода (O 2 F)» (PDF) . Журнал физических и химических справочных данных . 18 (2). Американское химическое общество и Американский институт физики Национального института стандартов и технологий: 799. Бибкод : 1989JPCRD..18..799L . дои : 10.1063/1.555830 . Архивировано из оригинала (PDF) 4 марта 2016 года . Проверено 5 августа 2013 г.
- ^ Перейти обратно: а б Стренг, А.Г. (1963). «Химические свойства дифторида дикислорода». Журнал Американского химического общества . 85 (10): 1380–1385. дои : 10.1021/ja00893a004 .
- ^ Соломон, Ирвин Дж.; Брабец, Роберт И.; Уэниши, Рой К.; Кейт, Джеймс Н.; Макдонаф, Джон М. (1964). «Новые диоксигенильные соединения». Неорганическая химия . 3 (3): 457. doi : 10.1021/ic50013a036 .
- ^ Мальм, Дж.Г.; Эллер, П.Г.; Эспри, Л.Б. (1984). «Низкотемпературный синтез гексафторида плутония с использованием дифторида кислорода». Журнал Американского химического общества . 106 (9): 2726–2727. дои : 10.1021/ja00321a056 .
Внешние ссылки
[ редактировать ]- Перфторпероксид в Линстреме, Питере Дж.; Маллард, Уильям Г. (ред.); Интернет-книга NIST по химии , справочная база данных NIST № 69 , Национальный институт стандартов и технологий, Гейтерсбург (Мэриленд)