фторид олова(IV)
 Элементарная ячейка фторида олова(IV) | |
| Имена | |
|---|---|
| Название ИЮПАК фторид олова(IV) | |
| Другие имена фторид олова, тетрафторид олова | |
| Идентификаторы | |
3D model ( JSmol ) | |
| Информационная карта ECHA | 100.029.105 |
| Номер ЕС |
|
ПабХим CID | |
| НЕКОТОРЫЙ | |
| Характеристики | |
| СнФ 4 | |
| Молярная масса | 194.704 g/mol |
| Появление | белое твердое вещество |
| Температура плавления | выше 700 °C (возгонка) |
| Структура | |
| Четырехугольный , tI10 | |
| И4/ммм, №139 | |
| Родственные соединения | |
Другие анионы | Хлорид олова(IV) Бромид олова(IV) Йодид олова(IV) |
Другие катионы | Тетрафторид углерода Тетрафторид кремния Тетрафторид германия Тетрафторид олова Тетрафторид свинца |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Фторид олова(IV) представляет собой химическое соединение олова и представляет и фтора с химической формулой SnF 4 собой белое твердое вещество с температурой плавления выше 700 °C. [1]
SnF 4 можно получить реакцией металлического олова с газообразным фтором: [2]
- Sn + 2F 2 → SnF 4
Однако будет создан пассивирующий слой фторида металла, и поверхность со временем станет нереактивной. Альтернативным синтезом является реакция SnCl 4 с безводным фтороводородом : [1]
- SnCl 4 + 4HF → SnF 4 + 4HCl
С фторидами щелочных металлов (например, KF) образуются гексафторстаннаты (например, K 2 SnF 6 ), которые содержат октаэдрический SnF 6 2− анион. SnF 4 ведет себя как кислота Льюиса аддукты L 2 ·SnF 4 и L · SnF 4 . , и были получены [2]
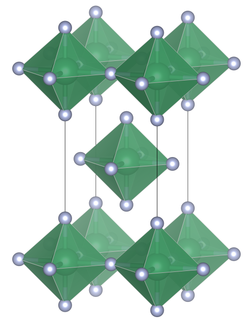
Структура
[ редактировать ]В отличие от других тетрагалогенидов олова , хлорида олова (IV) , бромида олова (IV) и йодида олова (IV) , которые содержат тетраэдрически координированное олово, фторид олова (IV) содержит плоские слои октаэдрически координированного олова, где октаэдры имеют общие четыре угла. и есть два концевых, неподеленных атома фтора, переходящих друг к другу. [3] Температура плавления SnF 4 намного выше (700 °C), чем у других галогенидов олова (IV), которые относительно легко плавятся ( SnCl 4 , -33,3 ° C; SnBr 4 , 31 ° C; SnI 4 , 144 ° C). ). [1] Структуру можно также противопоставить тетрафторидам более легких членов группы 14 ( CF 4 , SiF 4 и GeF 4 ), которые в твердом состоянии образуют молекулярные кристаллы. [2]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с Гринвуд, штат Нью-Йорк; Эрншоу, А. (1997). Химия элементов (2-е изд.). Оксфорд: Баттерворт-Хайнеманн. стр. 381 . ISBN 0-7506-3365-4 .
- ^ Jump up to: а б с Холлеман, А.Ф.; Виберг, Э.; Виберг, Н. (2001). Неорганическая химия, 1-е издание . Академическая пресса. п. 908. ИСБН 0-12-352651-5 .
- ^ Неорганическая химия [Мягкая обложка], 2-е издание, Housecroft, Sharpe, 2004, Pearson Education. ISBN 0130399132 , ISBN 978-0130399137