монофторид хлора
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК монофторид хлора | |
| Другие имена Хлор фторид | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.029.300 |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| КФ | |
| Молярная масса | 54.45 g/mol |
| Плотность | 1,62 г мл (жидкость, −100 °С) |
| Температура плавления | -155,6 ° C (-248,1 ° F; 117,5 К) |
| Точка кипения | -100,1 ° C (-148,2 ° F; 173,1 К) |
| Структура | |
| 0,881 Д (2.94 × 10 −30 См ) | |
| Термохимия | |
Теплоемкость ( С ) | 33.01 Дж.К. −1 моль −1 |
Стандартный моляр энтропия ( S ⦵ 298 ) | 217,91 Дж.К. −1 моль −1 |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −56,5 кДж моль −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Монофторид хлора представляет собой летучее межгалогенное соединение с химической формулой ClF. Это бесцветный газ при комнатной температуре и стабилен даже при высоких температурах. При охлаждении до −100 °C ClF конденсируется в виде бледно-желтой жидкости. Многие из его свойств являются промежуточными между его родительскими галогенами , Cl 2 и F 2 . [1]
Геометрия
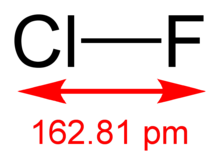
[ редактировать ]Молекулярная структура в газовой фазе определена методом микроволновой спектроскопии; длина связи r e = 1,628341(4) Å. [2]
Длина связи в кристаллическом ClF составляет 1,628(1) Å; удлинение относительно свободной молекулы происходит за счет взаимодействия типа F-Br···ClMe на расстоянии 2,640(1) Å. В своей молекулярной упаковке он демонстрирует очень короткие межмолекулярные контакты Cl···Cl размером 3,070(1) Å между соседними молекулами. [3]
Реактивность
[ редактировать ]Монофторид хлора является универсальным фторирующим агентом , превращающим металлы и неметаллы в их фториды и высвобождающим Cl 2 в процессе . Например, он превращает вольфрам в гексафторид вольфрама , а селен в тетрафторид селена :
- В + 6 КлФ → ВФ 6 + 3 Кл 2
- Se + 4 ClF → SeF 4 + 2 Cl 2
FCl также может хлорфторировать соединения либо путем присоединения по кратной связи , либо путем окисления . Например, к углероду монооксида углерода присоединяется фтор и хлор , в результате чего образуется фторид карбонилхлорида:
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Отто Рафф , Э. Ашер (1928). «О новом хлорфториде СИФ 3 ». Журнал неорганической и общей химии . 176 (1): 258–270. дои : 10.1002/zaac.19281760121 .
- ^ Уиллис, Роберт Э.; Кларк, Уильям В. (май 1980 г.). «Измерения вращательных спектров ClF, BrF, BrCl, ICl и IBr в миллиметровом диапазоне волн» . Журнал химической физики . 72 (9): 4946–4950. Бибкод : 1980JChPh..72.4946W . дои : 10.1063/1.439780 . ISSN 0021-9606 .
- ^ Бозе, Роланд; Бозе, А. Дэниел; Блазер, Дитер; Антипин Михаил Ю.; Эллерн, Аркадий; Зеппельт, Конрад (4 августа 1997 г.). «Удивительная кристаллическая упаковка фторида хлора» . Angewandte Chemie International Edition на английском языке . 36 (1314): 1489–1492. дои : 10.1002/anie.199714891 . ISSN 0570-0833 .