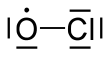Окись хлора
Эта статья в значительной степени или полностью опирается на один источник . ( февраль 2024 г. ) |
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Окись хлора | |||
| Систематическое название ИЮПАК хлороксиданил | |||
| Другие имена Оксид хлора(II) | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| Сокращения | ClO • | ||
| ЧЭБИ | |||
| ХимическийПаук | |||
| МеШ | хлорозил | ||
ПабХим CID | |||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| Cl O | |||
| Молярная масса | 51.45 g·mol −1 | ||
| Термохимия | |||
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | 101,8 кДж/моль [1] | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Оксид хлора представляет собой химический радикал с химической формулой ClO. • . Он играет важную роль в процессе разрушения озона . В стратосфере атомы хлора реагируют с молекулами озона с образованием монооксида хлора и кислорода .
- кл. • + О 3 → ClO • + Около 2
Эта реакция вызывает разрушение озонового слоя . [1] Полученный ClO • радикалы могут дополнительно реагировать:
- ClO • +О • → Кл • + Около 2
регенерация радикала хлора. Таким образом, общая реакция разложения озона катализируется хлором, поскольку в конечном итоге хлор остается неизменным. Общая реакция такая:
- ТО • + О3 2О2 →
оказало значительное влияние Использование ХФУ на верхние слои стратосферы, хотя многие страны согласились запретить использование ХФУ. Инертная природа ХФУ позволяет им проникать в стратосферу, где они подвергаются фотодиссоциации с образованием радикалов Cl. Затем они легко образуют монооксид хлора, и этот цикл может продолжаться до тех пор, пока два радикала не вступят в реакцию с образованием монооксида дихлора , прекращая радикальную реакцию. Поскольку концентрация ХФУ в атмосфере очень мала, вероятность завершения реакции чрезвычайно мала, а это означает, что каждый радикал может разложить многие тысячи молекул озона.
Хотя использование ХФУ запрещено во многих странах, ХФУ могут оставаться в атмосфере от 50 до 500 лет. Это приводит к образованию множества радикалов хлора и, следовательно, значительное количество молекул озона разлагается до того, как радикалы хлора смогут вступить в реакцию с монооксидом хлора с образованием монооксида дихлора .
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б Эгон Виберг; Нильс Виберг; Арнольд Фредерик Холлеман (2001). Неорганическая химия . Академическая пресса. стр. 462. ISBN 0-12-352651-5 .