Супероксид калия
 катионы калия, К + Супероксидные анионы, О - 2 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Супероксид калия | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.031.574 |
| Номер ЕС |
|
ПабХим CID | |
| номер РТЭКС |
|
| Число | 2466 |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| К О 2 | |
| Молярная масса | 71.096 g·mol −1 |
| Появление | желтое твердое вещество |
| Плотность | 2,14 г/см 3 , твердый |
| Температура плавления | 560 ° C (1040 ° F, 833 К) (разлагается) |
| Гидролиз | |
| +3230·10 −6 см 3 /моль [1] | |
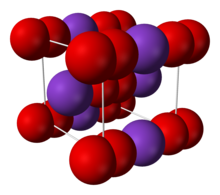
| Структура | |
| Телоцентрированный тетрагональный [2] [3] | |
| Термохимия | |
Стандартный моляр энтропия ( S ⦵ 298 ) | 117 Дж/(моль·К) [4] |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −283 кДж/моль [4] |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | Коррозионное вещество, окислитель, бурно реагирует с водой. |
| СГС Маркировка : [5] | |
  | |
| Опасность | |
| Х271 , Х314 | |
| P210 , P220 , P221 , P260 , P264 , P280 , P283 , P301+P330+P331 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P306+P360 , P310 , P321 , П363 , П370+П378 , П371+П380+П375 , П405 , П501 | |
| NFPA 704 (огненный алмаз) | |
| Родственные соединения | |
Другие катионы | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Супероксид калия — неорганическое соединение формулы К О 2 . [6] Это желтое парамагнитное твердое вещество, разлагающееся во влажном воздухе. Это редкий пример стабильной соли супероксид- аниона. Он используется как CO2 , скруббер осушитель H 2 O и O 2 Генератор в ребризерах , космических кораблях , подводных лодках и скафандрах .
Производство и реакции
[ редактировать ]Супероксид калия получают сжиганием расплавленного калия в атмосфере избытка кислорода . [7]
- К + О 2 → КО 2
Соль состоит из К + и Ионы O - 2 , связанные ионной связью. Расстояние О–О составляет 1,28 Å. [2]
Реактивность
[ редактировать ]Супероксид калия является источником супероксида, который в зависимости от партнера по реакции является окислителем и нуклеофилом. [8]
При контакте с водой он подвергается диспропорционированию на гидроксид калия , кислород и перекись водорода:
- 4 КО 2 + 2 Н 2 О → 4 КОН + 3 О 2
- 2 КО 2 + 2 Н 2 О → 2 КОН + Н 2 О 2 + О 2 [9]
Реагирует с углекислым газом, выделяя кислород:
- 4 КО 2 + 2 СО 2 → 2 К 2 СО 3 + 3 О 2
- 4 КО 2 + 4 CO 2 + 2 H 2 O → 4 KHCO 3 + 3 O 2
Супероксид калия находит лишь нишевое применение в качестве лабораторного реагента. Поскольку он реагирует с водой, КО 2 часто изучают в органических растворителях. Поскольку соль плохо растворяется в неполярных растворителях, краун-эфиры обычно используют тетраэтиламмония . . Также известна соль Типичные реакции этих солей включают использование супероксида в качестве нуклеофила , например, при превращении алкилбромидов в спирты и ацилхлоридов в диацилпероксиды . [10]
Ионный обмен с гидроксидом тетраметиламмония дает супероксид тетраметиламмония, желтое твердое вещество. [11]
Приложения
[ редактировать ]Российское космическое агентство успешно использовало перекись калия в химических генераторах кислорода для своих скафандров и космических кораблей «Союз» . КО 2 также использовался в баллонах ребризеров для пожаротушения и горноспасательных было ограничено работ, но его применение в ребризерах для подводного плавания из-за его сильно экзотермической реакции с водой. Супероксид калия использовался в элементарной системе жизнеобеспечения пяти мышей в рамках эксперимента по биологическим космическим лучам на Аполлоне-17. [12]
Теоретически 1 кг. KO 2 поглощает 0,310 кг CO 2 и выделяет 0,338 кг CO 2 . О 2 . Один моль КО 2 поглощает 0,5 моля СО 2 и выделяет 0,75 моля кислорода.
Ссылки
[ редактировать ]- ^ «Справочник по химии и физике, 102-е издание» . ЦРК Пресс .
- ^ Jump up to: а б Абрахамс, Южная Каролина; Калнайс, Дж. (1955). «Кристаллическая структура α-супероксида калия» . Акта Кристаллографика . 8 (8): 503–6. дои : 10.1107/S0365110X55001540 .
- ^ «Информационная карта для въезда 2310803» . Открытая база данных кристаллографии . Проверено 28 июля 2022 г.
- ^ Jump up to: а б Зумдал, Стивен С. (2009). Химические принципы (6-е изд.). Хоутон Миффлин. п. А22. ISBN 978-0-618-94690-7 .
- ^ «Супероксид калия» . pubchem.ncbi.nlm.nih.gov . Проверено 14 декабря 2021 г.
- ^ Хайян М.; Хашим М.А.; АльНашеф ИМ (2016). «Супероксид-ион: образование и химические последствия» . хим. Преподобный . 116 (5): 3029–3085. doi : 10.1021/acs.chemrev.5b00407 . ПМИД 26875845 .
- ^ Якоб, Харальд; Лейнингер, Стефан; Леманн, Томас; Якоби, Сильвия; Гютеворт, Свен (2007). «Пероксосоединения неорганические». Энциклопедия промышленной химии Ульмана . Вайли-ВЧ. дои : 10.1002/14356007.a19_177.pub2 . ISBN 978-3527306732 .
- ^ Джонсон, Рой А.; Адрио, Хавьер; Рибагорда, Мария (2007). «Супероксид калия». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.rp250.pub2 . ISBN 978-0471936237 .
- ^ Кумар Де, Анил (2007). Учебник неорганической химии . Нью Эйдж Интернэшнл. п. 247. ИСБН 978-8122413847 .
- ^ Джонсон, Рой А.; Адрио, Хавьер; Рибагорда, Мария (2001). «Супероксид калия». Электронная энциклопедия реагентов для органического синтеза EROS . Уайли. дои : 10.1002/047084289X.rp250.pub2 . ISBN 0471936235 .
- ^ Боле, Д. Скотт; Саган, Элизабет С. (2004). Тетраметиламмониевые соли супероксида и пероксинитрита . Неорганические синтезы. п. 36. дои : 10.1002/0471653683.ch1 .
- ^ Хеймейкер, Уэбб; Смотри, Бонн К.; Бентон, Юджин В.; Ричард К. Симмондс (1 января 1975 г.). «Эксперимент с карманной мышью Apollo 17 (Biocore)» . Биомедицинские результаты Аполлона . НАСА-СП-368.
