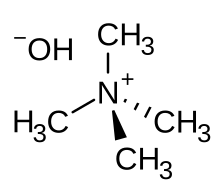
Гидроксид тетраметиламмония
| |

| |
| Имена | |
|---|---|
| Название ИЮПАК
N , N , N -Триметилметанаминия гидроксид
| |
| Другие имена
гидроксид тетраметиламмония
| |
| Идентификаторы | |
| |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.000.803 |
ПабХим CID
|
|
| НЕКОТОРЫЙ |
|
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 4 Н 13 Н О | |
| Молярная масса | 91.154 g·mol −1 |
| Плотность | ~ 1,015 г/см 3 (20-25% водный раствор) |
| Температура плавления | 67 ° C (153 ° F, 340 К) (пентагидрат) |
| Точка кипения | разлагается |
| высокий | |
| Опасности | |
| СГС Маркировка : | |
 
| |
| Опасность [1] | |
| Х300 , Х311 , Х314 [1] | |
| P260 , P264 , P270 , P280 , P301+P310 , P301+P330+P331 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P322 , P361 , P363 , P405 , P501 [1] | |
| NFPA 704 (огненный алмаз) | |
| Паспорт безопасности (SDS) | Паспорт безопасности Sigma-Aldrich для TMAH·5H 2 O |
| Родственные соединения | |
Другие анионы
|
хлорид тетраметиламмония |
Другие катионы
|
гидроксид тетраэтиламмония |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Гидроксид тетраметиламмония ( ТМАХ или ТМАОН ) представляет собой четвертичную аммониевую соль с молекулярной формулой N(CH 3 ) 4 . + ОЙ − . Обычно он встречается в виде концентрированных растворов в воде или метаноле . ТМАГ в твердом состоянии и его водные растворы бесцветны, но в случае примеси могут быть желтоватыми. Хотя чистый ТМАГ практически не имеет запаха, образцы часто имеют сильный рыбный запах из-за присутствия триметиламина , который является распространенной примесью. TMAH имеет несколько разнообразных промышленных и исследовательских применений.
Химические свойства
[ редактировать ]Структура
[ редактировать ]
ТМАГ чаще всего встречается в виде водного раствора в концентрациях ~ 2–25% и реже в виде растворов в метаноле . Эти решения имеют номер CAS 75-59-2 . несколько гидратов, таких как N(CH 3 ) 4 OH·xH 2 O. Было кристаллизовано [3] Эти соли содержат хорошо отделенный Me 4 N + катионы и гидроксид-анионы ( Me — сокращение от метильной группы ). Гидроксидные группы связаны водородными связями с кристаллизационной водой . Безводный ТМАГ не выделен.
Подготовка
[ редактировать ]Одна из самых ранних приготовлений принадлежит Уокеру и Джонстону. [4] который получил его путем реакции солевого обмена хлорида тетраметиламмония и гидроксида калия в сухом метаноле , в котором ТМАГ растворим, а хлорид калия - нет:
- НМе 4 + кл − + КОН → NMe 4 + ОЙ − + КСl
Где Me означает метильную группу, –CH 3 .
В этом отчете также приводятся подробности выделения ТМАГ в виде его пентагидрата, отмечается существование тригидрата и подчеркивается жадность, которую даже первый проявляет к атмосферной влаге и углекислому газу . Эти авторы сообщили о температуре плавления пентагидрата 62–63 ° C, а растворимость в воде измерялась в среднем около 220 г/100 мл при 15 ° C.
Реакции
[ редактировать ]ТМАГ представляет собой стабильное соединение с периодом полураспада более 61 часа в 6 М NaOH при 160 °C. [5]
ТМАГ подвергается простым кислотно-основным реакциям с образованием солей тетраметиламмония (ТМА), анион которых образуется из используемой кислоты. Показательным является получение фторида тетраметиламмония : [6]
- НМе 4 + ОЙ − + ВЧ → NMe 4 + Ф − + Н 2 О
- Растворы ТМАГ можно использовать для получения других солей тетраметиламмония в реакциях метатезиса с аммонием (NH 4 + ) соли. Например, тиоцианат тетраметиламмония можно получить из тиоцианата аммония следующим образом: [7]
- НМе 4 + ОЙ − + НХ 4 + СКН − → НМе 4 + СКН − + NH 3 + Н 2 О
ТМАГ и многие другие соли ТМА, содержащие простые анионы, термически разлагаются на триметиламин . [8] Диметиловый эфир является основным продуктом разложения, а не метанол . [9] Идеализированное уравнение:
- 2 НМе 4 + ОЙ − → 2 NMe 3 + MeOMe + H 2 O
Характеристики
[ редактировать ]ТМАХ – это очень сильная база . [10]
Использование
[ редактировать ]промышленных применений ТМАГ является анизотропное травление кремния Одним из . [11] Он используется в качестве основного растворителя при разработке кислотных фоторезистов в процессе фотолитографии и очень эффективен при удалении фоторезистов. ТМАГ обладает некоторыми свойствами катализатора фазового переноса . Он также используется в качестве поверхностно-активного вещества при синтезе феррожидкостей и для ингибирования агрегации наночастиц .
ТМАГ — один из наиболее распространенных реагентов, используемых в — аналитическом методе, включающем как пиролиз , так и химическую дериватизацию аналитов термохемолизе . [12]
Мокрое анизотропное травление
[ редактировать ]ТМАГ принадлежит к семейству растворов четвертичного гидроксида аммония (QAH) и обычно используется для анизотропного травления кремния . ТМАГ предпочтительнее гидроксида натрия или калия в приложениях, чувствительных к загрязнению ионами металлов. [13] Типичные температуры травления составляют от 70 до 90 °C, а типичные концентрации ТМАГ в воде составляют 5–25 мас.%. В случае (100) скорость травления кремния обычно увеличивается с температурой и снижается с увеличением концентрации ТМАГ. Шероховатость поверхности травленого кремния (100) уменьшается с увеличением концентрации ТМАГ, а гладкие поверхности можно получить с помощью 20% растворов ТМАГ. Скорость травления обычно находится в диапазоне 0,1–1 микрометра в минуту.
Обычные маскирующие материалы для длительного травления в ТМАГ включают диоксид кремния ( LPCVD и термический) и нитрид кремния . Нитрид кремния имеет незначительную скорость травления в ТМАГ. Скорость травления диоксида кремния в ТМАГ зависит от качества пленки, но обычно составляет порядка 0,1 нм/мин. [11]
Токсикология
[ редактировать ]Ион тетраметиламмония [14] поражает нервы и мышцы, вызывая затруднение дыхания, мышечный паралич и, возможно, смерть. [15] Он структурно связан с ацетилхолином , важным нейромедиатором как в нервно-мышечных соединениях, так и в вегетативных ганглиях . Когда он действует как агонист , это структурное сходство отражается в механизме его токсичности – он связывается и активирует никотиновые рецепторы ацетилхолина , хотя они могут стать десенсибилизированными в постоянном присутствии агониста. Действие тетраметиламмония наиболее выражено в вегетативных ганглиях , поэтому тетраметиламмоний традиционно относят к препаратам, стимулирующим ганглии. [16]
Ганглиозные эффекты могли способствовать гибели людей в результате случайного промышленного воздействия. « Химические ожоги », вызванные этим сильным основанием, также очень серьезны. Имеются данные о том, что отравление может произойти при попадании на кожу концентрированных растворов ТМАГ. [17]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д Sigma-Aldrich Co. , Пентагидрат гидроксида тетраметиламмония . Проверено 06 апреля 2015 г.
- ^ Моотц, Дитрих; Зайдель, Рейнхард (1990). «Полиэдрические клатратные гидраты сильного основания: Фазовые отношения и кристаллические структуры в системе гидроксид тетраметиламмония-вода». Журнал явлений включения и молекулярного распознавания в химии . 8 (1–2): 139–157. дои : 10.1007/BF01131293 . S2CID 95063058 .
- ^ Гессен, В.; Янсен, М. (1991). «Полиморфизм пентагидрата гидроксида тетраметиламмония, NMe4OH.5H2O и кристаллические структуры комнатной и низкотемпературной форм». Журнал неорганической и общей химии . 595 : 115-130. дои : 10.1002/zaac.19915950112 .
- ^ Уокер, Дж.; Джонстон, Дж. (1905). «Гидрид тетраметиламмония» . Дж. Хим. соц., пер . 87 : 955–961. дои : 10.1039/ct9058700955 .
- ^ Марино, Миннесота; Крейер, К.Д. (2015). «Щелочная стабильность катионов четвертичного аммония для мембран щелочных топливных элементов и ионных жидкостей». ChemSusChem . 8 (3): 513–523. Бибкод : 2015ЧСЧ...8..513М . дои : 10.1002/cssc.201403022 . ПМИД 25431246 .
- ^ Кристе, КО; Уилсон, WW; Уилсон, РД; Бау, Р.; Фэн, Дж. А. (1990). «Синтез, свойства и структуры безводного фторида тетраметиламмония и его аддукта 1: 1 с транс-3-амино-2-бутеннитрилом». Журнал Американского химического общества . 112 (21): 7619–7625. дои : 10.1021/ja00177a025 .
- ^ Марковиц, ММ (1957). «Удобный метод получения солей четвертичного аммония». Дж. Орг. Хим . 22 : 983–984. дои : 10.1021/jo01359a605 .
- ^ Лоусон, AT; Колли, Н. (1888). «Действие тепла на соли тетраметиламмония» . Дж. Хим. соц., пер . 53 : 1888. doi : 10.1039/CT8885300624 .
- ^ Маскер, В. Кеннет. (1964). «Повторное исследование пиролиза гидроксида тетраметиламмония». Журнал Американского химического общества . 86 (5): 960–961. дои : 10.1021/ja01059a070 .
- ^ Стюарт, Р.; О'Доннелл, JP (1964). «Сильно основные системы: III. Функция H_ для различных систем растворителей» . Может. Дж. Чем . 42 (7): 1681–1693. дои : 10.1139/v64-251 .
- ^ Jump up to: а б Стринги, JTL; Чой, ВК; Чонг, CW (1997). «ТМАГ-травление кремния и взаимодействие параметров травления». Датчики и исполнительные механизмы A: Физические . 63 (3): 243–249. дои : 10.1016/S0924-4247(97)80511-0 .
- ^ Шадками, Ф.; Хеллер, Р. (2010). «Последние применения в аналитическом термохемолизе». Дж. Анал. Прил. Пирол . 89 : 2–16. дои : 10.1016/j.jaap.2010.05.007 .
- ^ Лян, Вэньшэн; Хо, Тенг; Тонг, Цзиннань; Нарангари, Парватала; Арманд, Стефан; Эрнст, Марко; Уолтер, Дэниел; Сюрв, Сачин; Стокс, Мэтью; Блейкерс, Эндрю; Фонг, Кин Черн (01 апреля 2021 г.). «Высоко воспроизводимое текстурирование c-Si с помощью безметаллового травителя TMAH и агента monoTEX» . Материалы для солнечной энергии и солнечные элементы . 222 : 110909. doi : 10.1016/j.solmat.2020.110909 . ISSN 0927-0248 . S2CID 230573829 .
- ^ Обратите внимание, что исследования фармакологии и токсикологии ТМА обычно проводились с использованием галогенидных солей ТМА - ион гидроксида в ТМАГ слишком разрушителен для биологических тканей.
- ^ Антони, Ю.; Болин, Л.; Ларсен, К.; Нильсен, П.; Нильсен, Нью-Хэмпшир; Кристоферсен, К. (1989). «Тетрамин: появление в морских организмах и фармакологии». Токсикон . 27 (7): 707–716. дои : 10.1016/0041-0101(89)90037-8 . ПМИД 2675390 .
- ^ Боуман, У.К. и Рэнд, М.Дж. (1980), «Периферические вегетативные холинергические механизмы», в Учебнике фармакологии, 2-е изд., Blackwell Scientific, Oxford 10.21.
- ^ Лин, CC; и др. (2010). «Отравление гидроксидом тетраметиламмония». Клин. Токсикол . 48 (3): 213–217. дои : 10.3109/15563651003627777 . ПМИД 20230335 . S2CID 3393943 .
