оксалат
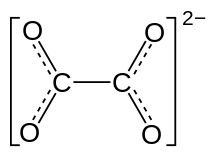 Строение оксалат-аниона | |
| Имена | |
|---|---|
| Название ИЮПАК оксалат | |
| Систематическое название ИЮПАК этандиоат [1] | |
| Идентификаторы | |
3D model ( JSmol ) | |
| 1905970 | |
| КЭБ | |
| ХимическийПаук | |
| 2207 | |
| КЕГГ | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
| Характеристики | |
| C2O2−C2O2−4 | |
| Молярная масса | 88.018 g·mol −1 |
| Конъюгатная кислота | Гидрооксалат [2] |
| Структура | |
| Д 2 часа | |
| Родственные соединения | |
Родственные изоэлектронные | Четырехокись азота |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Оксалат (систематическое название IUPAC: этандиоат ) представляет собой анион с химической формулой С 2 О 2- 4 . Этот дианион бесцветен. Это происходит естественным путем, в том числе в некоторых продуктах питания. Образует различные соли , например оксалат натрия ( Na 2 C 2 O 4 ) и несколько эфиров , таких как диметилоксалат ( (СН 3 ) 2 С 2 О 4 ). Это сопряженное основание кислоты щавелевой . При нейтральном pH в водном растворе щавелевая кислота полностью превращается в оксалат.
Связь с щавелевой кислотой
[ редактировать ]Диссоциация протонов щавелевой кислоты протекает ступенчато; как и в случае других полипротонных кислот , потеря одного протона приводит к образованию одновалентного гидрооксалат- аниона. ХК 2 О - 4 . Соль , одноосновным оксалатом с этим анионом иногда называют кислым оксалатом или оксалатом водорода . Константа равновесия ( Ka × ) потери первого протона 5,37 равна 10 −2 ( р К а = 1,27). Потеря второго протона, в результате которого образуется оксалат-ион, имеет константу равновесия 5,25 × 10 −5 (р К а = 4,28). Эти значения подразумевают, что в растворах с нейтральным pH отсутствует щавелевая кислота и существуют лишь следовые количества оксалата водорода. [3] В литературе часто неясно различие между Н 2 С 2 О 4 , HC 2 O - 4 и C 2 O 2− 4 , а совокупность видов называется щавелевой кислотой. [ нужна ссылка ]
Структура
[ редактировать ]Оксалат-анион существует в неплоской конформации, где диэдры O-C-C-O приближаются к 90 ° с приблизительной D 2d симметрией . [4] При хелатировании катионов оксалат принимает плоскую конформацию D 2h . [5] [6] Однако в структуре оксалата цезия Cs 2 C 2 O 4 двугранный угол O–C–C–O равен 81(1)°. [7] [8] Поэтому, Cs 2 C 2 O 4 более точно соответствует структуре симметрии D 2d, поскольку две Плоскости CO 2 расположены в шахматном порядке. Две структурные формы оксалата рубидия Rb 2 C 2 O 4 идентифицированы методом рентгеновской дифракции монокристаллов: один содержит плоский, а другой - шахматный оксалат.
По расчетам, барьер вращения вокруг этой связи составляет примерно 2–6 ккал / моль для свободного дианиона. С 2 О 2- 4 . [11] [12] [13] Такие результаты согласуются с интерпретацией, согласно которой центральная связь C-C рассматривается как одинарная связь с минимальными π-взаимодействиями между двумя СО − 2 ед. [4] Этот барьер для вращения вокруг связи C-C (который формально соответствует разнице в энергии между плоской и шахматной формами) можно объяснить электростатическими взаимодействиями , поскольку неблагоприятное отталкивание O-O максимизируется в плоской форме.
Встречаемость в природе
[ редактировать ]растениях, где он синтезируется путем неполного окисления сахаридов Оксалат встречается во многих .
Некоторые растительные продукты, такие как корень и/или листья шпината , ревень и гречка, содержат большое количество щавелевой кислоты и могут способствовать образованию камней в почках у некоторых людей. Другие богатые оксалатами растения включают жирную курицу («бараньи четвертины»), щавель и несколько видов Oxalis (также иногда называемых щавелем). Корень и/или листья ревеня и гречихи богаты щавелевой кислотой. [14] Другие съедобные растения со значительными концентрациями оксалатов включают в порядке убывания карамболу ( карамболу ), черный перец , петрушку , мак , амарант , мангольд , свеклу , какао , шоколад , большинство орехов , большинство ягод , рыбий хвост , новозеландский шпинат. ( Tetragonia Tetragonioides ) и фасоль . [ нужна ссылка ] Листья чайного растения ( Camellia sinensis ) содержат одну из самых высоких концентраций щавелевой кислоты по сравнению с другими растениями. Однако напиток, полученный путем настаивания в горячей воде, обычно содержит лишь небольшое или умеренное количество щавелевой кислоты из-за небольшой массы листьев, используемых для заваривания. [ нужна ссылка ]
Физиологические эффекты
[ редактировать ]
Чрезмерное потребление продуктов, богатых оксалатами, связано с образованием камней в почках из-за ионов металлов, таких как оксалат кальция , что является фактором риска образования камней в почках. [16]
Некоторые грибы рода Aspergillus . продуцируют щавелевую кислоту [17]
В качестве лиганда для ионов металлов
[ редактировать ]Оксалат также образует координационные соединения , которые иногда сокращают до ox . Обычно он встречается как бидентатный лиганд . Когда оксалат хелатируется с одним металлическим центром, он всегда принимает плоскую конформацию. Будучи бидентатным лигандом, он образует 5-членный MC 2 O 2 Кольцо . Показательным комплексом является ферриоксалат калия , К 3 [Fe(C 2 O 4 ) 3 ] . Препарат оксалиплатин демонстрирует улучшенную растворимость в воде по сравнению с более старыми препаратами на основе платины , что позволяет избежать дозолимитирующего побочного эффекта нефротоксичности . Щавелевая кислота и оксалаты могут окисляться перманганатом в автокаталитической реакции. Одним из основных применений щавелевой кислоты является удаление ржавчины, которое возникает из-за того, что оксалат образует водорастворимые производные с ионом трехвалентного железа.
Избыток
[ редактировать ]Избыточный уровень оксалатов в крови называется гипероксалемией , а высокий уровень оксалатов в моче — гипероксалурией .
Приобретенный
[ редактировать ]Хотя это и необычно, потребление оксалатов (например, выпас животных на оксалатсодержащих растениях, таких как Bassia hyssopifolia , или потребление человеком щавеля или, особенно в чрезмерных количествах, черного чая ) может привести к заболеванию почек или даже смерти из-за отравление оксалатами. Медицинский журнал Новой Англии сообщил об острой оксалатной нефропатии, «почти наверняка вызванной чрезмерным употреблением чая со льдом» у 56-летнего мужчины, который выпивал «шестнадцать стаканов чая со льдом по 8 унций в день» (примерно 3,8 литра). Авторы статьи предположили, что острая оксалатная нефропатия является недостаточно диагностируемой причиной почечной недостаточности, и предложили тщательно изучить диетический анамнез пациентов в случаях необъяснимой почечной недостаточности без протеинурии (избыток белка в моче) и с большим количеством оксалата кальция в моче. осадок мочи. [18] Oxalobacter formigenes в кишечной флоре может помочь облегчить эту ситуацию. [19]
Врожденный
[ редактировать ]Первичная гипероксалурия — редкое наследственное заболевание, приводящее к повышенному выделению оксалатов, при этом часто встречаются оксалатные камни.
Ссылки
[ редактировать ]- ^ «Оксалат» .
- ^ «оксалат(2-) (CHEBI:30623)» . www.ebi.ac.uk. Проверено 2 января 2019 г.
оксалат(2-) (CHEBI:30623) представляет собой сопряженное основание оксалата(1-) (CHEBI:46904) … оксалат(1-) (CHEBI:46904) представляет собой сопряженную кислоту оксалата(2-) (CHEBI:30623)
- ^ Рименшнейдер, Вильгельм; Танифудзи, Минору (2000). «Щавелевая кислота». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a18_247 . ISBN 3-527-30673-0 .
- ^ Перейти обратно: а б Дин, Филип А.В. (2012). «Оксалатный дианион C2O42-: плоский или непланарный?». Журнал химического образования . 89 (3): 417–418. Бибкод : 2012JChEd..89..417D . дои : 10.1021/ed200202r .
- ^ Рид, округ Колумбия; Олмстед, ММ (1981). «Уточнение структуры оксалата натрия» (PDF) . Acta Crystallographica Раздел B. 37 (4): 938–939. Бибкод : 1981AcCrB..37..938R . дои : 10.1107/S0567740881004676 .
- ^ Бигли, Б.; Смолл, RWH (1964). «Строение оксалата лития» . Акта Кристаллографика . 17 (6): 783–788. Бибкод : 1964AcCry..17..783B . дои : 10.1107/S0365110X64002079 .
- ^ На рисунке 81(1)° (1) указывает, что 1° — это стандартная погрешность измеренного угла 81°.
- ^ Перейти обратно: а б с Диннебье, Роберт Э.; Венский, Саша; Пантофер, Мартин; Янсен, Мартин (2003). «Кристаллическая и молекулярная структура щелочных оксалатов: первое доказательство шахматного расположения оксалат-аниона в твердом состоянии». Неорганическая химия . 42 (5): 1499–1507. дои : 10.1021/ic0205536 . ПМИД 12611516 .
- ^ Диннебье, RE; Венский, С.; Пантофер, М.; Янсен, М. (2003). «Запись CSD WUWTIR: оксалат дицезия». Кембриджская структурная база данных: структуры доступа . Кембриджский центр кристаллографических данных . дои : 10.5517/cc6fzf0 .
- ^ Диннебье, RE; Венский, С.; Пантофер, М.; Янсен, М. (2003). «Запись CSD QQQAZJ03: дикалий оксалат». Кембриджская структурная база данных: структуры доступа . Кембриджский центр кристаллографических данных . дои : 10.5517/cc6fzcy .
- ^ Кларк, Тимоти; Шлейер, Пауль фон Раге (1981). с 34 валентными электронами «Конформационные предпочтения 34 молекул A 2 X 4 : исследование ab initio B 2 F 4 , B 2 Cl 4 , N 2 O 4 и C
22О 2−
4 ". Журнал вычислительной химии . 2 : 20–29. doi : 10.1002/jcc.540020106 . S2CID 98744097 . - ^ Дьюар, Майкл Дж.С.; Чжэн, Я-Цзюнь (1990). «Строение оксалат-иона». Журнал молекулярной структуры: THEOCHEM . 209 (1–2): 157–162. дои : 10.1016/0166-1280(90)85053-П .
- ^ Герберт, Джон М.; Ортис, СП (2000). «Ab initio исследование отрыва электронов в дикарбоксилатных дианионах». Журнал физической химии А. 104 (50): 11786–11795. Бибкод : 2000JPCA..10411786H . дои : 10.1021/jp002657c .
- ^ Стрейтвейзер, Эндрю младший ; Хиткок, Клейтон Х. (1976). Введение в органическую химию . Макмиллан. п. 737 . ISBN 9780024180100 .
- ^ Резник, Мартин И.; Пак, Чарльз Ю.К. (1990). Мочекаменная болезнь. Медицинский и хирургический справочник . Компания WB Saunders. п. 158. ИСБН 0-7216-2439-1 .
- ^ Митчелл Т., Кумар П., Редди Т., Вуд К.Д., Найт Дж., Ассимос Д.Г., Холмс Р.П. (март 2019 г.). «Пищевые оксалаты и образование камней в почках» . Американский журнал физиологии. Почечная физиология . 316 (3): Ф409–Ф413. дои : 10.1152/ajprenal.00373.2018 . ПМК 6459305 . ПМИД 30566003 .
- ^ Пабукчуоглу, Угур (2005). «Аспекты оксалоза, связанные с аспергиллезом, в патологоанатомических образцах». Патология – исследования и практика . 201 (5): 363–368. дои : 10.1016/j.prp.2005.03.005 . ПМИД 16047945 .
- ^ Сайед, Фахд; Мена Гутьеррес, Алехандра; Гаффар, Умбар (2 апреля 2015 г.). «Случай чайной нефропатии» . Медицинский журнал Новой Англии . 372 (14): 1377–1378. дои : 10.1056/NEJMc1414481 . ПМИД 25830441 .
- ^ Зинер, Р.; Банген, У.; Сидху, Х.; Хёнов, Р.; фон Унру, Г.; Гессен, А. (2013). «Роль колонизации Oxalobacter formigenes при оксалатно-кальциевой каменной болезни» . Почки Интернешнл . 83 (июнь): 1144–1149. дои : 10.1038/ki.2013.104 . ПМИД 23536130 .
Дальнейшее чтение
[ редактировать ]- Эйлер. « Таблица K sp : Константы произведения растворимости при температуре около 25 °C» . chm.uri.edu . Проверено 10 июня 2021 г.
- Ибис, Фатма; Дханд, Прия; Сулейманлы, Санан; ван дер Хейден, Антуан EDM; Крамер, Герман Дж. М.; Эрал, Гусейн Бурак (2020). «Комбинированное экспериментальное и модельное исследование растворимости моногидрата оксалата кальция при физиологически соответствующих pH и температурах» . Кристаллы . 10 (10): 924. дои : 10.3390/cryst10100924 . ISSN 2073-4352 .
- Ульмгрен, Пер; Родестрем, Руна (1999). «Растворимость оксалата кальция в присутствии ионов магния и растворимость оксалата магния в среде хлорида натрия». Северный журнал исследований целлюлозно-бумажной промышленности . 14 (4): 330–335. doi : 10.3183/npprj-1999-14-04-p330-335 . ISSN 2000-0669 . S2CID 96834193 .
Внешние ссылки
[ редактировать ]- Oxalate.org - Содержание оксалатов в более чем 750 продуктах питания из университетских и государственных источников.

