Оксалат натрия
| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
динатрий оксалат | |
| Другие имена
Щавелевая кислота, динатриевая соль
Этандиоат натрия | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| КЭБ | |
| ХЭМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.000.501 |
| Номер ЕС |
|
ПабХим CID
|
|
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| № 2 С 2 О 4 | |
| Молярная масса | 133.998 g·mol −1 |
| Появление | Белое кристаллическое твердое вещество |
| Запах | Без запаха |
| Плотность | 2,34 г/см 3 |
| Температура плавления | 260 ° C (500 ° F; 533 К) разлагается при температуре выше 290 ° C. [ 2 ] |
| |
| Растворимость | Растворим в муравьиной кислоте , нерастворим в этаноле , диэтиловом эфире. |
| Структура | |
| моноклинический | |
| Термохимия | |
Стандартная энтальпия
образование (Δ f H ⦵ 298 ) |
−1318 кДж/моль |
| Опасности | |
| СГС Маркировка : [ 3 ] | |

| |
| Предупреждение | |
| Х302 , Х312 | |
| П280 , П301+П312 , П302+П352 | |
| NFPA 704 (огненный алмаз) | |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза )
|
11160 мг/кг (перорально, крыса) [ 1 ] |
| Паспорт безопасности (SDS) | Оксфордский паспорт безопасности материалов [ ненадежный источник ] |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
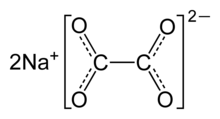
Оксалат натрия , или оксалат динатрия , представляет собой химическое соединение с химической формулой Na 2 C 2 O 4 . Это натриевая соль кислоты щавелевой . Содержит катионы натрия. Уже + и оксалат- анионы С 2 О 2- 4 . Это белое кристаллическое твердое вещество без запаха, разлагающееся при температуре выше 290 °C . [ 2 ]
Оксалат натрия может действовать как восстановитель и может использоваться в качестве основного стандарта для стандартизации перманганата калия ( KMnO 4 ) растворы.
Минеральной является формой оксалата натрия натроксалат . Встречается он очень редко и приурочен к крайне условиям ультращелочных натриевым пегматитов . [ 4 ]
Подготовка
[ редактировать ]Оксалат натрия можно получить путем нейтрализации щавелевой кислоты гидроксидом натрия (NaOH) в соотношении кислоты к основанию молярном 1:2 . Выпаривание дает безводный оксалат. [ 5 ] Его можно тщательно высушить, нагревая до температуры 200–250 °C. [ 2 ]
Полунейтрализация может быть достигнута с помощью NaOH в соотношении 1:1, что дает NaHC 2 O 4 , одноосновный оксалат натрия или гидрооксалат натрия .
Альтернативно его можно получить путем разложения формиата натрия путем нагревания его до температуры, превышающей 360 °C. [ нужна ссылка ]
Реакции
[ редактировать ]Оксалат натрия при температуре выше 290 °C начинает разлагаться на карбонат натрия и окись углерода : [ 2 ]
- Na 2 C 2 O 4 → Na 2 CO 3 + CO
При нагревании при температуре от 200 до 525°C с пентоксидом ванадия в молярном соотношении 1:2 указанная выше реакция подавляется, вместо этого образуется оксибронза натрия-ванадия с выделением углекислого газа. [ 6 ]
- x Na 2 C 2 O 4 + 2 V 2 O 5 → 2 Na x V 2 O 5 + 2 x CO 2
при этом x увеличивается до 1 по мере повышения температуры.
Оксалат натрия используется для стандартизации перманганата калия растворов . Желательно, чтобы температура титрационной смеси была выше 60°С, чтобы весь добавленный перманганат прореагировал быстро. Кинетика реакции сложная, и марганца (II) ионы ( Мин. 2+ ) образовавшиеся катализируют дальнейшую реакцию между перманганатом и щавелевой кислотой (образуется in situ при добавлении избытка серной кислоты ). Окончательное уравнение выглядит следующим образом: [ 7 ]
Биологическая активность
[ редактировать ]Как и некоторые другие оксалаты , оксалат натрия токсичен для человека. Это может вызвать жгучую боль во рту, горле и желудке, кровавую рвоту, головную боль, мышечные судороги, судороги и судороги, падение артериального давления, сердечную недостаточность, шок, кому и возможную смерть. Средняя смертельная доза при проглатывании оксалатов составляет 10-15 граммов на килограмм массы тела (согласно паспорту безопасности ).
Оксалат натрия, как и цитраты , также можно использовать для удаления кальция ионов ( Что 2+ ) из плазмы крови . Он также предотвращает свертывание крови . Обратите внимание, что, удаляя ионы кальция из крови , оксалат натрия может нарушать функцию мозга и откладывать оксалат кальция в почках .
Ссылки
[ редактировать ]- ^ Jump up to: а б «ChemIDplus - 62-76-0 - ZNCPFRVNHGOPAG-UHFFFAOYSA-L - Оксалат динатрия - Поиск подобных структур, синонимы, формулы, ссылки на ресурсы и другая химическая информация» . chem.nlm.nih.gov . НАЦИОНАЛЬНЫЕ ИНСТИТУТЫ ЗДРАВООХРАНЕНИЯ США . Проверено 7 января 2019 г.
- ^ Jump up to: а б с д Ёсимори Т1, Асано Ю., Ториуми Ю., Сиота Т. (1978) «Исследование сушки и разложения оксалата натрия». Таланта , том 25, выпуск 10, страницы 603-605. дои : 10.1016/0039-9140(78)80158-1
- ^ СГС: ГЕСТИС 570199.
- ^ «Натроксолат» (PDF) . РРУФФ . Публикация минеральных данных . Проверено 7 января 2019 г.
- ^ HW Foote и Джон Э. Вэнс (1933), «Система; йодат натрия, оксалат натрия, вода». Американский журнал науки , серия 5, том 26, выпуск 151, страницы 16–18. дои : 10.2475/ajs.s5-26.151.16
- ^ Д. Балливет-Ткаченко, Ж. Гали, -М. Саварио (1994): «Термическое разложение оксалата натрия в присутствии V2O5: Механистический подход к образованию оксибронзов натрия». Thermochimica Acta , том 232, выпуск 2, страницы 215-223. дои : 10.1016/0040-6031(94)80061-8
- ^ Макбрайд, RS (1912). «Стандартизация раствора перманганата калия оксалатом натрия» . Дж. Ам. хим. Соц. 34 (4): 393–416. дои : 10.1021/ja02205a009 .
