Теллурид натрия
| |
| Имена | |
|---|---|
| Другие имена
теллурид динатрия; Теллуровая кислота, натриевая соль
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| Информационная карта ECHA | 100.031.629 |
| Номер ЕС |
|
ПабХим CID
|
|
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| На 2 Те | |
| Молярная масса | 173.58 g/mol |
| Появление | белый порошок, гигроскопичен |
| Плотность | 2,90 г/см 3 , твердый |
| Температура плавления | 953 ° C (1747 ° F; 1226 К) |
| очень растворим | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности
|
При контакте с водой выделяется горючий газ. |
| СГС Маркировка : [ 1 ] | |
 
| |
| Предупреждение | |
| Х261 , Х302+Х312+Х332 , Х315 , Х319 | |
| P261 , P264 , P270 , P271 , P280 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P330 , P335+P334 , P362 , P370+P378 , P402+P404 , P501 | |
| NFPA 704 (огненный алмаз) | |
| Родственные соединения | |
Другие анионы
|
Оксид натрия Сульфид натрия Селенид натрия Полонид натрия |
Другие катионы
|
Теллурид водорода Теллурид лития Теллурид калия Теллурид рубидия Теллурид цезия |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
натрия – химическое соединение формулы 2 Na Теллурид Te. Эта соль представляет собой сопряженное основание термически нестабильного кислого теллурида водорода но ее обычно получают восстановлением теллура натрием . , Na 2 Te — сложный в обращении материал, поскольку он очень чувствителен к воздуху . Воздух окисляет его сначала до полителлуридов, имеющих формулу Na 2 Te x (x > 1), и в конечном итоге до металлического Te. Образцы Na 2 Te, которые в абсолютно чистом виде бесцветны, обычно кажутся фиолетовыми или темно-серыми из-за окисления воздухом.
Синтез, структура и свойства раствора.
[ редактировать ]Синтез обычно проводится с использованием аммиака в качестве растворителя. [ 2 ]
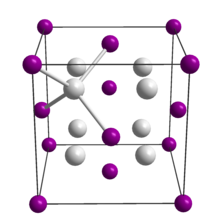
Na 2 Te, как и многие родственные соединения формулы M 2 X, имеет антифлюоритную структуру . Таким образом, в твердом Na 2 Te каждый Te 2− ион окружен восемью Na + ионы и каждый Na + ион окружен четырьмя Te 2− ионы. [ 3 ]
Простые соли типа M 2 X, где X представляет собой одноатомный анион, обычно не растворяются ни в одном растворителе, поскольку имеют высокую энергию решетки . При добавлении воды (даже влажного воздуха) или обработке спиртами Te 2− протонирует:
- Na 2 Te + H 2 O → NaHTe + NaOH
Из-за этой реакции во многих процессах, приписываемых Na 2 Te, может участвовать NaHTe ( CAS № 65312-92-7), который более растворим и легко образуется.
Приложения в органической химии
[ редактировать ]Na 2 Te находит применение в органическом синтезе , как в качестве реагента для восстановления, так и в качестве источника Те при синтезе теллурорганических соединений. [ 4 ] Арилгалогениды заменяются диарилтеллуридами, как показано на примере синтеза динафтилтеллурида:
- Na 2 Te + 2 C 10 H 7 I → (C 10 H 7 ) 2 Te + 2 NaI
Na 2 Te реагирует с 1,3- диинами с образованием соответствующих теллурофенов, структурно аналогичных тиофенам :
- Na 2 Te + RC≡CC≡CR + 2 H 2 O → TeC 4 R 2 H 2 + 2 NaOH
В качестве восстановителя Na 2 Te превращает нитрогруппы в амины и расщепляет определенные связи CX. [ 4 ]
Ссылки
[ редактировать ]- ^ "12034-41-2 - Теллурид натрия, 99,9% (металлическая основа) - 41777 - Альфа Аезар" . www.alfa.com .
- ^ Ф. Фехер (1963). «Теллурид натрия, Теллурид калия Na 2 Te, K 2 Te». В Г. Брауэре (ред.). Справочник по препаративной неорганической химии, 2-е изд . Том. 1. Нью-Йорк, Нью-Йорк: Академик Пресс. п. 441.
- ^ Уэллс, А.Ф. (1984) Структурная неорганическая химия, Оксфорд: Clarendon Press. ISBN 0-19-855370-6 .
- ^ Перейти обратно: а б «Теллурид натрия» Диттмер, округ Колумбия, в Энциклопедии реагентов для органического синтеза, 2001 г. дои : 10.1002/047084289X.rs103 .
