Фосфид натрия
| |
| Имена | |
|---|---|
| Другие имена
фосфид натрия,
тризодиофосфин | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.031.834 |
| Номер ЕС |
|
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
| Характеристики | |
| NaНа3П P | |
| Молярная масса | 99.943 g/mol |
| Появление | красные кристаллы |
| Плотность | 1,74 г/см 3 |
| Температура плавления | 650 ° C (1202 ° F; 923 К) |
| гидролиз | |
| Растворимость | нерастворим в жидком CO 2 |
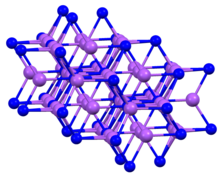
| Структура | |
| шестиугольный а = 4,9512 Å с = 8,7874 Å | |
| вокруг P 5 рядом с соседями, тригональная бипирамида [ 1 ] | |
| Родственные соединения | |
Другие анионы
|
арсенид натрия нитрид натрия |
Другие катионы
|
фосфид алюминия фосфид лития фосфид калия |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Фосфид натрия представляет собой неорганическое соединение формулы Na 3 P. Это твердое вещество черного цвета. Его часто называют Na + соль П. 3− анион . [ 2 ] Na 3 P является источником высокореактивного фосфид-аниона. Не следует путать его с фосфатом натрия Na 3 PO 4 .
Помимо Na 3 P известны еще пять бинарных соединений натрия и фосфора: NaP, Na 3 P 7 , Na 3 P 11 , NaP 7 и NaP 15 . [ 3 ]
Структура и свойства
[ редактировать ]Соединение кристаллизуется в виде гексагональной структуры, часто называемой структурой арсенида натрия . [ 4 ] Как и K 3 P, твердый Na 3 P имеет пятикоординированные P-центры. [ 1 ]
Подготовка
[ редактировать ]О получении Na 3 P впервые сообщалось в середине XIX века. Французский исследователь Александр Бодримон получил фосфид натрия, обрабатывая расплавленный натрий пентахлоридом фосфора . [ 5 ]
множество различных путей получения Na 3 Описано P. Из-за своей воспламеняемости и токсичности Na 3 P (и родственные соли) часто готовят и используют на месте . Белый фосфор восстанавливается натриево-калиевым сплавом: [ 6 ]
- П 4 + 12 Na → 4 Na 3 P
Фосфор реагирует с натрием в автоклаве при температуре 150°С в течение 5 часов с образованием Na 3 P. [ 7 ]
В качестве альтернативы реакцию можно проводить при нормальном давлении, но с использованием градиента температур для образования нелетучих фаз NaxP (x <3), которые затем далее реагируют с натрием. [ 8 ] агент переноса электронов, например нафталин В некоторых случаях используется . В таких случаях нафталин образует растворимый нафталинид натрия , который восстанавливает фосфор. [ 9 ]
Использование
[ редактировать ]Фосфид натрия является источником высокореактивного фосфид-аниона. Материал нерастворим во всех растворителях, но реагирует в виде суспензии с кислотами и родственными электрофилами с образованием производных типа PM 3 : [ 6 ]
- На3П + 3Е + → Е 3 Р (Е = Н, Ме 3 Si)
летуче Производное триметилсилила (т. кип. 30-35°С при 0,001 мм рт. ст.) и растворимо. Он служит растворимым эквивалентом «P». 3− ".
Фосфид индия , полупроводник, получается путем обработки генерируемого in-situ «фосфида натрия» хлоридом индия (III) в горячем N,N' -диметилформамиде в качестве растворителя. В этом процессе фосфидный реагент образуется из металлического натрия и белого фосфора, после чего он сразу же вступает в реакцию с солью индия: [ 10 ]
- Na 3 P + InCl 3 → InP + 3NaCl
Фосфид натрия также используется в коммерческих целях в качестве катализатора вместе с фосфидом цинка и фосфидом алюминия для производства полимеров . При Na 3 удалении P из тройного катализатора полимеризация пропилена и 4-метил- 1 -пентена не эффективна. [ 11 ] [ нужна ссылка ]

Меры предосторожности
[ редактировать ]Фосфид натрия очень опасен, выделяя токсичный фосфин при гидролизе - процессе, который настолько экзотермичен, что приводит к пожарам. Министерство транспорта США запретило перевозку Na 3 P на самолетах и поездах из-за потенциальной опасности возгорания и токсичности. [ 12 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б Донг, Ю; Дисалво, Ф.Дж. (2005). «Повторное исследование Na 3 P на основе монокристаллических данных». Acta Crystallographica Раздел E. 61 (11): i223–i224. Бибкод : 2005AcCrE..61I.223D . дои : 10.1107/S1600536805031168 .
- ^ Юнле, Г; Фан, Г; Йяте, Вопрос; Хуагуй, З; Зипинг, Ю (2002). «Сольвотермический синтез сверхтонкого фосфида железа». Бюллетень исследования материалов . 37 (6): 1101–1106. дои : 10.1016/S0025-5408(02)00749-3 .
- ^ Неорганическая химия , Эгон Виберг, Арнольд Фредерик Холлеман, Elsevier, 2001. ISBN 0-12-352651-5
- ^ Бейстер, HJ; Сяссен, К.; Кляйн Дж. «Фазовый переход Na 3 As под давлением» Zeitschrift für Naturforschung B: Chemical Sciences 1990, том 45, стр. 1388-стр. 1392. дои : 10.1515/znb-1990-1007
- ^ Бодримон (1864 г.). Анналы химии и физики . 2:13 .
{{cite journal}}: Отсутствует или пусто|title=( помощь ) - ^ Перейти обратно: а б Беккер, Герд; Шмидт, Гельмут; Уль, Гудрун (1990). «Трис (триметилсилил) фосфин и литий-бис (триметилсилил) фосфид. Бис-(тетрагидрофуран)». Неорганические синтезы . Том. 27. С. 243–249. дои : 10.1002/9780470132586.ch48 . ISBN 9780470132586 .
- ^ Се, Ю; Су, Ч; Ли, Б; Цянь, Ю (2000). «Сольвотермическое получение наностержней фосфида олова». Бюллетень исследования материалов . 35 (5): 675–680. дои : 10.1016/S0025-5408(00)00263-4 .
- ^ Джарвис, РФ; Якубинас, РМ; Канер, РБ (2000). «Пути самораспространяющегося метатезиса к метастабильным фосфидам 4-й группы». Неорганическая химия . 39 (15): 3243–3246. дои : 10.1021/ic000057m . ПМИД 11196860 .
- ^ Петерсон, ди-джей 1967 . Патент США № 3397039.
- ^ Ханна, ПК; Эум, М.-С; Джун, К.-В; Бэг, Ж.-О; Сок, С.И. (2003). «Новый синтез наночастиц фосфида индия». Материалы писем . 57 (30): 4617–4621. дои : 10.1016/S0167-577X(03)00371-9 .
- ^ Атараси, Ю.; Фукумото, О. Патент Японии № JP 42,006,269.
- ^ Кеннет Л. Барбалаче. «Фосфид натрия» . Химическая база данных.