Фосфид

В химии фосфид – это соединение, содержащее П 3− ион или его эквивалент. Известно множество различных фосфидов с сильно различающейся структурой. [1] Чаще всего встречаются бинарные фосфиды, т.е. материалы, состоящие только из фосфора и менее электроотрицательного элемента. Многочисленны полифосфиды, представляющие собой твердые вещества, состоящие из анионных цепей или кластеров фосфора. Известны фосфиды, содержащие большинство менее электроотрицательных элементов, за исключением Hg , Pb , Sb , Bi , Te и Po . [2] Наконец, некоторые фосфиды являются молекулярными.
Бинарные фосфиды
[ редактировать ]Бинарные фосфиды включают фосфор и еще один элемент. Примером фосфида группы 1 является фосфид натрия ( На 3 П ). Другие известные примеры включают фосфид алюминия ( AlP ) и фосфид кальция ( Ca 3 P 2 ), которые используются в качестве пестицидов, поскольку при гидролизе они выделяют токсичный фосфин . Фосфид магния ( Mg 3 P 2 ) также чувствителен к влаге. Фосфид индия ( InP ) и фосфид галлия ( GaP ) используются в качестве полупроводников, часто в сочетании с родственными арсенидами . [3] фосфид меди ( Cu 3 P ) иллюстрирует редкую стехиометрию фосфида. Эти виды нерастворимы во всех растворителях — они представляют собой трехмерные твердотельные полимеры. Для тех, у кого есть электроположительные металлы, материалы гидролизуются:
- Ca 3 P 2 + 6 H 2 O → 3 Ca(OH) 2 + 2 PH 3

Полифосфиды
[ редактировать ]

Полифосфиды содержат P-P- облигации. Простейшие полифосфиды будут производными P 4−
2 . Свободные анионы встречаются редко, поскольку они являются основными. Большинство членов следуют правилу октетов.
Хорошо изученные полифосфиды являются производными P 7 3- . [4]
Номенклатура полифосфидов может быть обманчивой. Как подтверждено рентгеноструктурным анализом, трифосфид олова и трифосфид германия являются не трифосфидами, а гексафосфидами . Они состоят из гофрированного цикло -П 6 6- субъединицы. [5] Другим примером вводящей в заблуждение номенклатуры является «пентафосфид тория», который состоит из полимерного полифосфида, родственного фосфору Хитторфа . [6]
Некоторые полифосфиды содержат кластер P 3−
11 ионов и анионов полимерной цепи (например, спиральных (P −
)
n- ион) и сложные листовые или трехмерные анионы. [7] Ассортимент конструкций обширен. Калий имеет девять фосфидов: К3П P, К 4 П 3 , К 5 П 4 , КП , К 4 П 6 , К3П7 P7, К 3 П 11 , КП 10.3 , КП 15 . восемь моно- и полифосфидов никеля : ( Также существуют Девять 3 П , Ни5П2 P2, № 12 П 5 , Ни 2 П , Ни 5 П 4 , НиП , НиП 2 , НиП 3 ). [2]
Два полифосфид-иона, P 4−
3 найдено в К
4 П
3 и П 5−
4 найдено в K 5 P 4 , представляют собой анионы-радикалы с нечетным числом валентных электронов . [2]
Получение фосфидных и полифосфидных материалов
[ редактировать ]Существует множество способов получения фосфидных соединений. Один из распространенных способов включает нагрев металла и красного фосфора (P) в инертных атмосферных условиях или в вакууме. В принципе, все фосфиды и полифосфиды металлов можно синтезировать из элементарного фосфора и соответствующего металлического элемента в стехиометрических формах. Однако синтез затруднен из-за ряда проблем. Экзотермические реакции часто бывают взрывоопасными из-за местного перегрева. Окисленные металлы или даже просто окисленный слой на внешней стороне металла вызывают экстремальные и неприемлемо высокие температуры для начала фосфорирования. [8] Гидротермальные реакции получения фосфидов никеля привели к образованию чистых и хорошо кристаллизованных соединений фосфида никеля. Ni 2 P и Ни 12 П 5 . Эти соединения были синтезированы посредством твердожидкостной реакции между NiCl 2 ·12H 2 O и красный фосфор при 200 °С в течение 24 и 48 часов соответственно. [9]
Фосфиды металлов также получают реакцией трис (триметилсилил) фосфина с галогенидами металлов. В этом методе галогенид высвобождается в виде летучего триметилсилилхлорида .
Способ приготовления о K 2 P 16 из красного фосфора и этилата калия . Сообщалось [10]
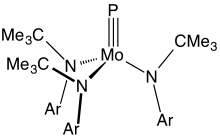
Молекулярные фосфиды
[ редактировать ]Соединения с тройными связями между металлом и фосфором встречаются редко. Основные примеры имеют формулу Mo(P)(NR 2 ) 3 , где R – объемный органический заместитель. [11]
Органические фосфиды
[ редактировать ]Известны многие органофосфиды. Общие примеры имеют формулу R 2 PM , где R представляет собой органический заместитель, а М представляет собой металл. Одним из примеров является дифенилфосфид лития . Кластер Цинтля P 3−
7 получают с использованием различных производных щелочных металлов.
Естественные примеры
[ редактировать ]Минерал шрайберзит (Fe,Ni) 3P часто встречается в некоторых метеоритах.
Ссылки
[ редактировать ]- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Jump up to: а б с Фон Шнеринг Х.Г. и Хёнле В. (1994) «Фосфиды - химия твердого тела» в Энциклопедии неорганической химии . Р. Брюс Кинг (ред.). Джон Уайли и сыновья ISBN 0-471-93620-0
- ^ Блэкман, CS; Кармальт, CJ ; О'Нил, ЮАР; Паркин, ИП; Моллой, КЦ; Апостолико, Л. (2003). «Химическое осаждение из паровой фазы тонких пленок фосфидов металлов группы Vb» (PDF) . Журнал химии материалов . 13 (8): 1930. doi : 10.1039/b304084b .
- ^ Мейер, Теодоро; Хёнле, Вольфганг; фон Шнеринг, Ганс Георг (1987). «О химии и структурной химии фосфидов и полифосфидов. 44. Гептафосфид трицезия Cs 3 P 7 : представление, строение и свойства». Журнал неорганической и общей химии . 552 (9): 69–80. дои : 10.1002/zaac.19875520907 .
- ^ Галлман, Ян; Олофссон, Олле (1 ноября 1972 г.). «Кристаллическая структура SnP3 и заметка о кристаллической структуре GeP3 » . Журнал химии твердого тела . 5 (3): 441–445. дои : 10.1016/0022-4596(72)90091-6 . ISSN 0022-4596 . Проверено 28 марта 2024 г.
- ^ Олофссон, Олле; Галлман, Ян; Сётофте, Ингер; Бероний, П.; Энгебрецен, Ян Э.; Эренберг, Л. (1971). «Кристаллическая структура TIP 5 ». Acta Chemica Scandinavica . 25 : 1327–1337. doi : 10.3891/acta.chem.scand.25-1327 .
- ^ Джейчко, В.; Мёллер, МХ (1987). «Фосфиды и полифосфиды переходных металлов». Фосфор и сера и родственные им элементы . 30 (1–2): 413–416. дои : 10.1080/03086648708080608 .
- ^ фон Шнеринг, Ханс-Георг; Хёнле, Вольфганг (1988). «Преодоление пропасти с помощью фосфидов». Химические обзоры . 88 : 243–273. дои : 10.1021/cr00083a012 .
- ^ Лю, Цзунъи; Хуан, Сян; Чжу, Жибин; Дай, Цзиньхуэй (2010). «Простой мягкий гидротермальный путь синтеза порошков фосфида никеля». Керамика Интернешнл . 36 (3): 1155–1158. doi : 10.1016/j.ceramint.2009.12.015 .
- ^ Драгулеску-Андраши, Алина; Миллер, Л. Зейн; Чен, Банхао; Маккуэйд, Д. Тайлер; Шатрук, Михаил (14 марта 2016 г.). «Простое преобразование красного фосфора в растворимые полифосфид-анионы путем реакции с этоксидом калия» . Angewandte Chemie, международное издание . 55 (12): 3904–3908. дои : 10.1002/anie.201511186 . ПМИД 26928980 .
- ^ Коссер, Б.М.; Пиро, Северная Каролина; Камминс, CC (2010). «Активация и трансформация белого фосфора, опосредованная ранними переходными металлами». Химические обзоры . 110 (7): 4164–77. CiteSeerX 10.1.1.666.8019 . дои : 10.1021/cr9003709 . ПМИД 20175534 .