Алюминат натрия
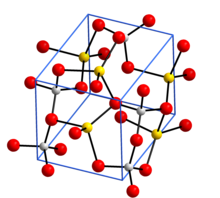 Кристаллическая структура: натрий - желтый, алюминий - серый и кислород - красный. [1] | |
 Образец металлоалюмината натрия | |
| Имена | |
|---|---|
| Название ИЮПАК Алюминат натрия | |
| Другие имена оксид алюминия-натрия, Металлоалюминат натрия Алюминат, ((AlO 2 ) 1− ), натрий | |
| Идентификаторы | |
3D model ( JSmol ) | |
| Информационная карта ECHA | 100.013.728 |
| Номер ЕС |
|
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| НаАлО 2 | |
| Молярная масса | 81.97 g/mol |
| Появление | белый порошок (иногда светло-желтоватый) гигроскопичен/ при растворении в воде образуется коллоидный черный раствор |
| Запах | без запаха |
| Плотность | 1,5 г/см 3 |
| Температура плавления | 1650 ° C (3000 ° F; 1920 К) |
| хорошо растворимый | |
| Растворимость | Нерастворим в спирте [2] |
Показатель преломления ( n D ) | 1.566 |
| Структура | |
| орторомбический | |
| Термохимия | |
Теплоемкость ( С ) | 73,6 Дж/моль К |
Стандартный моляр энтропия ( S ⦵ 298 ) | 70,4 Дж/моль К |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | -1133,2 кДж/моль |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Алюминат натрия — это неорганическое химическое вещество, которое используется в качестве эффективного источника гидроксида алюминия для многих промышленных и технических применений. Чистый натрия алюминат ( безводный ) представляет собой белое кристаллическое твердое вещество, имеющее формулу, по-разному обозначаемую как NaAlO 2 , NaAl(OH) 4 ( гидратированный ), [3] Na 2 O·Al 2 O 3 или Na 2 Al 2 O 4 . Коммерческий алюминат натрия доступен в виде раствора или твердого вещества.
Другие родственные соединения, иногда называемые алюминатом натрия, полученные реакцией Na 2 O и Al 2 O 3, представляют собой Na 5 AlO 4 , который содержит дискретный AlO 4. 5− анионы Na 7 Al 3 O 8 и Na 17 Al 5 O 16 , которые содержат сложные полимерные анионы, и NaAl 11 O 17 , который когда-то ошибочно считали β-оксидом алюминия, фазой оксида алюминия . [4] [5]
Структура
[ редактировать ]Безводный алюминат натрия NaAlO 2 содержит трехмерный каркас из AlO 4 тетраэдров , соединенных углами. Гидратированная форма NaAlO 2 ·5/4H 2 O имеет слои тетраэдров AlO 4 , соединенных в кольца, и эти слои удерживаются вместе ионами натрия и молекулами воды, которые образуют водородные связи с атомами O в тетраэдрах AlO 4 . [6]
Производство
[ редактировать ]Алюминат натрия получают растворением гидроксида алюминия (Al(OH) 3 ) в растворе каустической соды (NaOH). Гидроксид алюминия ( гиббсит ) можно растворить в 20–25% водном растворе NaOH при температуре, близкой к температуре кипения. Использование более концентрированных растворов NaOH приводит к получению полутвердого продукта. Процесс необходимо проводить в нагреваемых паром сосудах из никеля или стали , а гидроксид алюминия кипятить примерно с 50%-ным водным раствором едкого натра до образования пульпы. Готовую смесь необходимо вылить в резервуар и остудить; затем образуется твердая масса, содержащая около 70% NaAlO 2 . После измельчения этот продукт обезвоживают во вращающейся печи. Полученный продукт содержит 90% NaAlO 2 и 1% воды, а также 1% свободного NaOH.
Реакция алюминия и щелочи
[ редактировать ]Алюминат натрия также образуется при действии гидроксида натрия на элементарный алюминий, который является амфотерным металлом. После установления реакции реакция становится сильно экзотермической и сопровождается быстрым выделением газообразного водорода. Реакцию иногда записывают так:
- 2Al + 2NaOH + 2H 2 O → 2NaAlO 2 + 3H 2
Однако вещества, образующиеся в растворе, вероятно, содержат [Al(OH) 4 ] − ион или, возможно, [Al(H 2 O) 2 (OH) 4 ] − ион. [7]
Использование
[ редактировать ]При очистке воды он используется в качестве дополнения к системам умягчения воды, в качестве коагулянта для улучшения флокуляции , а также для удаления растворенного кремнезема и фосфатов .
В строительной технологии алюминат натрия применяют для ускорения затвердевания бетона , главным образом при работах в морозы.
Алюминат натрия также используется в бумажной промышленности , для производства огнеупорного кирпича , производства глинозема и т.д.
Растворы алюмината натрия являются полупродуктами в производстве цеолитов . [8] [9]
Ссылки
[ редактировать ]- ^ Кадук, Джеймс А.; Пей, Шию (1995). «Кристаллическая структура гидратированного алюмината натрия NaAlO 2 •5/4H 2 O и продукта его дегидратации». Журнал химии твердого тела . 115 (1): 126–139. дои : 10.1006/jssc.1995.1111 .
- ^ Индекс Merck. 10-е изд. Рэуэй, Нью-Джерси: Merck Co., Inc., 1983., стр. 1229
- ^ «Алюминий» . chemguide.co.uk .
- ^ «Идентификация и характеристика трех новых соединений в системе натрий-алюминий-кислород», Мартен Г. Баркер, Пол Г. Гэдд и Майкл Дж. Бегли, J. Chem. Соц. , Далтон Транс., 1984, 1139–1146, дои : 10.1039/DT9840001139
- ^ Эгон Виберг, Арнольд Фредерик Холлеман (2001) Неорганическая химия , Elsevier ISBN 0-12-352651-5
- ^ «Кристаллическая структура гидратированного алюмината натрия, NaAlO 2 ·5/4H 2 O, и продукта его дегидратации», Джеймс А. Кадук, Шию Пей, Журнал химии твердого тела , 115, 1, 1995, 126–139, два : 10.1006/jssc.1995.1111
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Ланкапати, Хенилкумар М.; Латия, Дхармеш Р.; Чоудхари, Лалита; Далай, Аджай К.; Махерия, Калпана К. (2020). «Цеолит типа морденита из зольной пыли отходов угля: синтез, характеристика и его применение в качестве сорбента для удаления ионов металлов» . ХимияВыбрать . 5 (3): 1193–1198. дои : 10.1002/slct.201903715 . S2CID 213214375 .
- ^ Алан Дайер, (1994), Энциклопедия неорганической химии , Р. Брюс Кинг (ред.), John Wiley & Sons, ISBN 0-471-93620-0